胶质瘤是中枢神经系统最常见的原发肿瘤,其独特的免疫微环境与患者的不良预后密切相关。胶质瘤细胞可以通过将特定的miRNA分子分选到外泌体中,进而改造免疫微环境。胶质瘤免疫微环境中的低氧环境与外泌体的分选过程密切相关,但相关机制尚不明确。因此,深入阐明胶质瘤中miRNA的外泌体分选过程及低氧在其中发挥的作用,有助于我们深入了解胶质瘤免疫微环境的形成过程并开发针对胶质瘤免疫微环境的诊疗策略。
该研究基于胶质瘤患者脑脊液外泌体测序结果,发现了向肿瘤外泌体中分选富集的肿瘤抑制性分子miR-204-3p,并揭示了miR-204-3p在胶质瘤细胞及胶质瘤免疫微环境中的作用。该研究还阐明了胶质瘤细胞在低氧环境下通过上调hnRNP A2/B1类泛素化促进外泌体分选清除肿瘤抑制性分子miR-204-3p的机制,为深入认识胶质瘤细胞通过外泌体改造胶质瘤免疫微环境的方式,进而开发针对性的诊疗策略提供了理论依据。

首先选取了来自山东大学齐鲁医院患者的脑脊液及肿瘤组织样本,并对这些样品进行了测序分析。测序结果提示,胶质瘤组织及脑脊液外泌体中存在差异表达的miRNA(图1 a-b)。通过对在肿瘤组织中下调、在胶质瘤患者脑脊液外泌体中上调的miRNA分子取交集,筛选出了miR-204-3p等11个向胶质瘤外泌体中分选富集的miRNA分子(图1 c),其中miR-204-3p在胶质瘤外泌体中表达量较高且表达差异较为明显,因此后续实验主要围其展开。
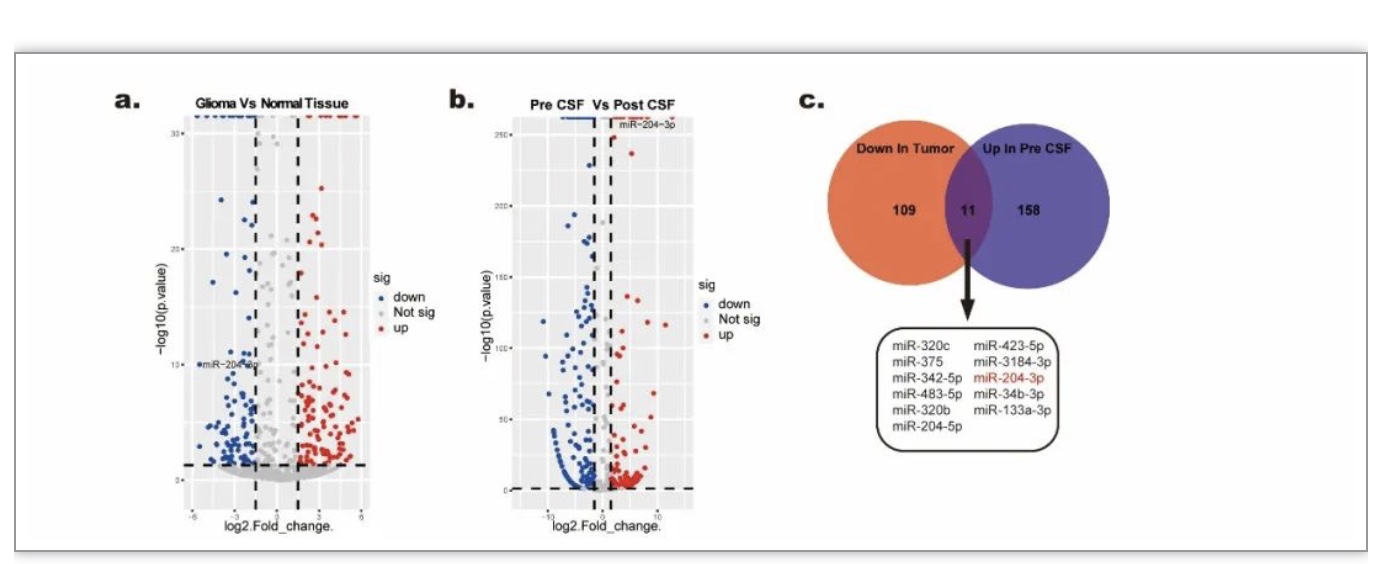
图1. miR-204-3p向胶质瘤外泌体中富集
(图源:Guo Q, et al., Cell Death Dis, 2023)
首先探究了miR-204-3p在胶质瘤细胞中的作用。CCK8、平板克隆及EdU实验提示miR-204-3p能抑制胶质瘤细胞的生长(图2 a-c),进一步通过TargetScan等数据库对miR-204-3p的下游靶点分子进行了预测(图2 d)。实验数据表明,miR-204-3p能够下调CACNA1C(图2 e)。双荧光素酶报告基因实验及Western blot实验结果证实miR-204-3p能够靶向CACNA1C,并通过CACNA1C/MAPK通路发挥抑制肿瘤生长的作用(图2 f-g)。
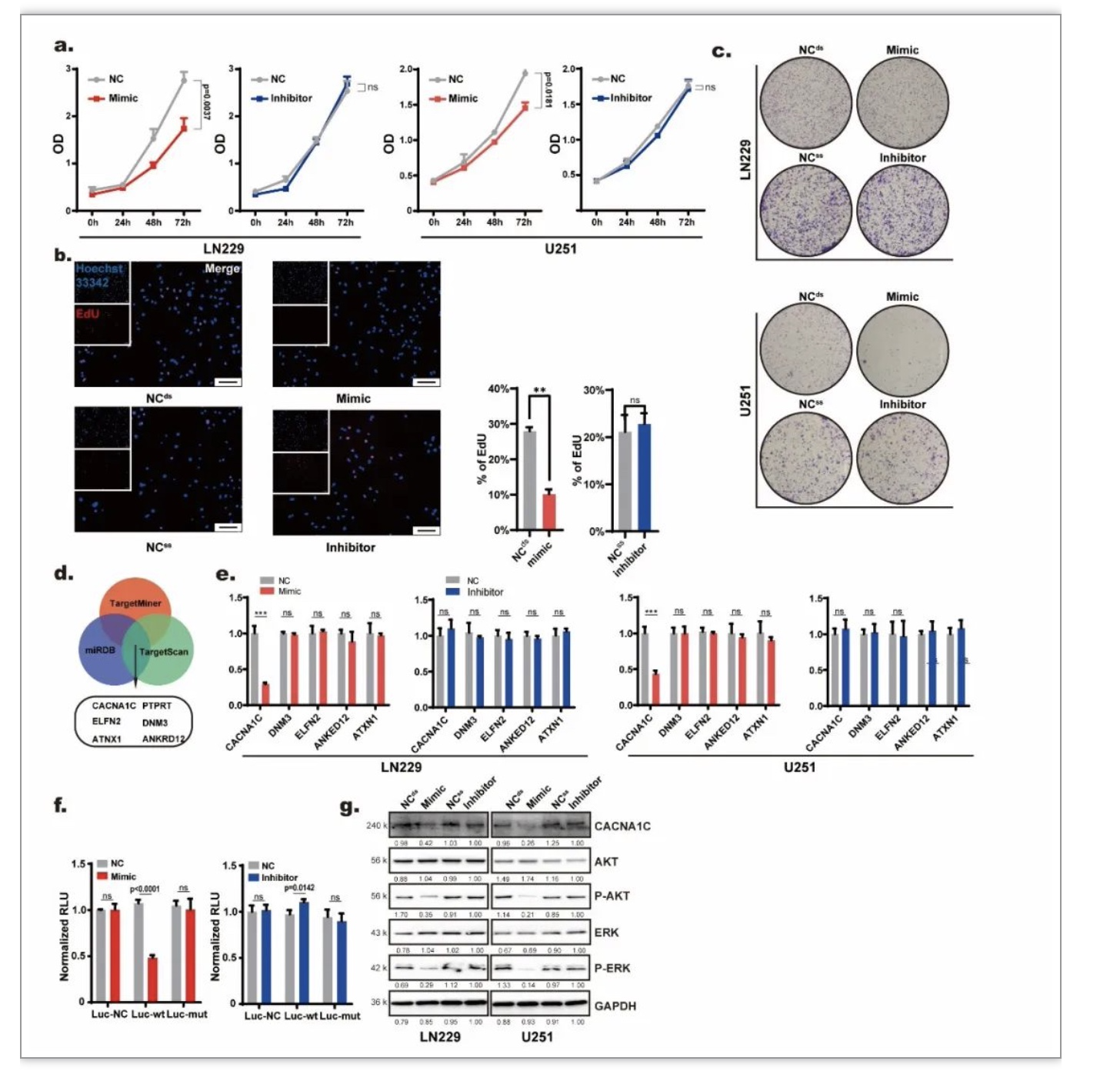
图2. miR-204-3p通过CACNA1C/MAPK通路抑制胶质瘤增殖
(图源:Guo Q, et al., Cell Death Dis, 2023)
低氧能够影响外泌体的释放过程和外泌体的内容物成分。实验结果提示,低氧下miR-204-3p向外泌体中分选的过程明显增强(图3 a)。有文献报道hnRNP家族成员能够通过识别miRNA的特定序列介导其向外泌体分选,StarBase数据库提示miR-204-3p的3’端存在hnRNP A2/B1的识别序列(图3 b),敲减hnRNP A2/B1抑制了低氧条件下miR-204-3p向外泌体中分选的过程(图3 c-d);该研究还进一步通过RIP和RNA pulldown实验对hnRNP A2/B1与miR-204-3p结合的序列和结构域进行了验证(图3 e-g)。
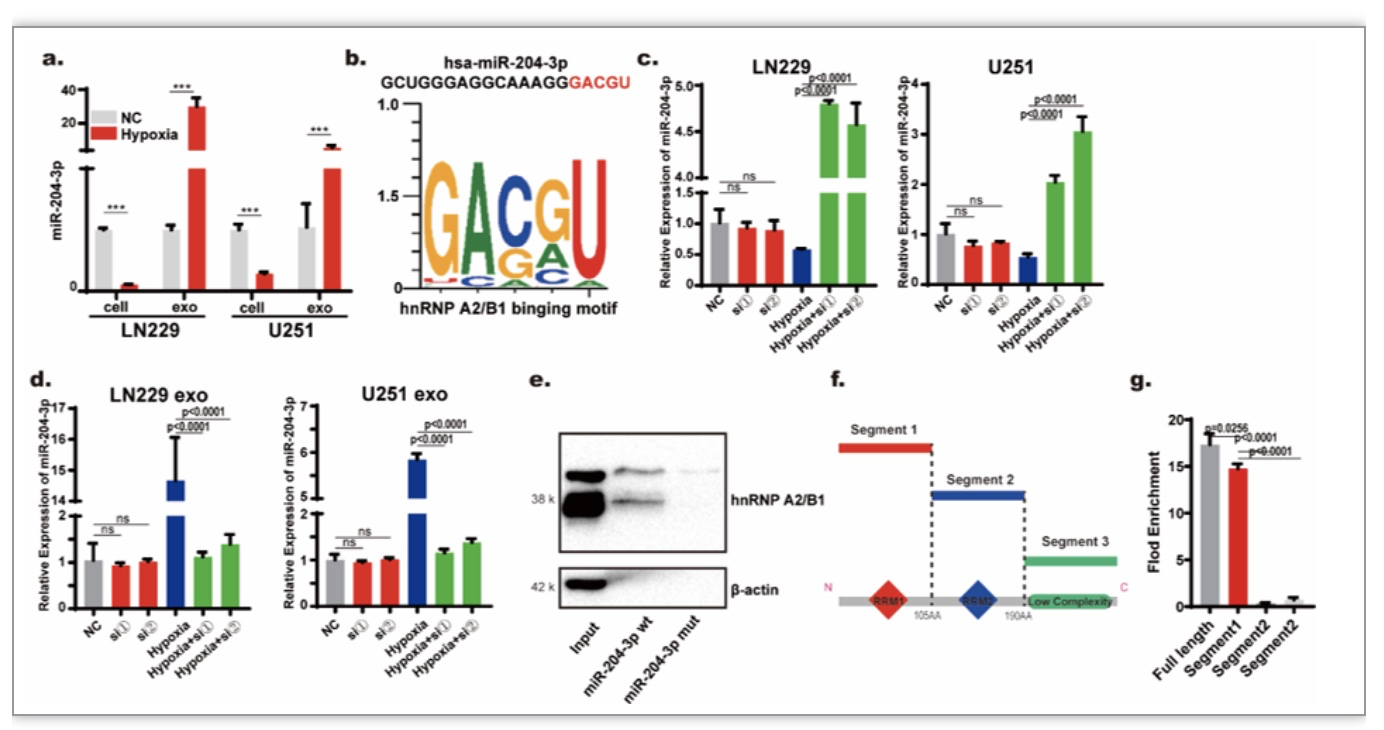
图3. hnRNP A2/B1介导miR-204-3p的外泌体分选
(图源:Guo Q, et al., Cell Death Dis, 2023)
外泌体的形成发生在细胞质中,而hnRNP A2/B1主要定位在细胞核中。低氧可能通过诱导hnRNP A2/B1向细胞质中定位促进miR-204-3p向外泌体中分选。免疫荧光实验结果表明低氧下细胞质中的hnRNP A2/B1的比例升高,且这种提高能够被类泛素化抑制剂漆树酸消除(图4 a)。实验结果进一步提示低氧下类泛素化关键分子UBC9上升(图4 b-c)。低氧能够上调hnRNP A2/B1的类泛素化修饰,且类泛素化修饰的hnRNP A2/B1主要定位于细胞质中(图4 d),这些结果表明低氧通过提高hnRNP A2/B1的类泛素化修饰促进miR-204-3p向外泌体中分选。
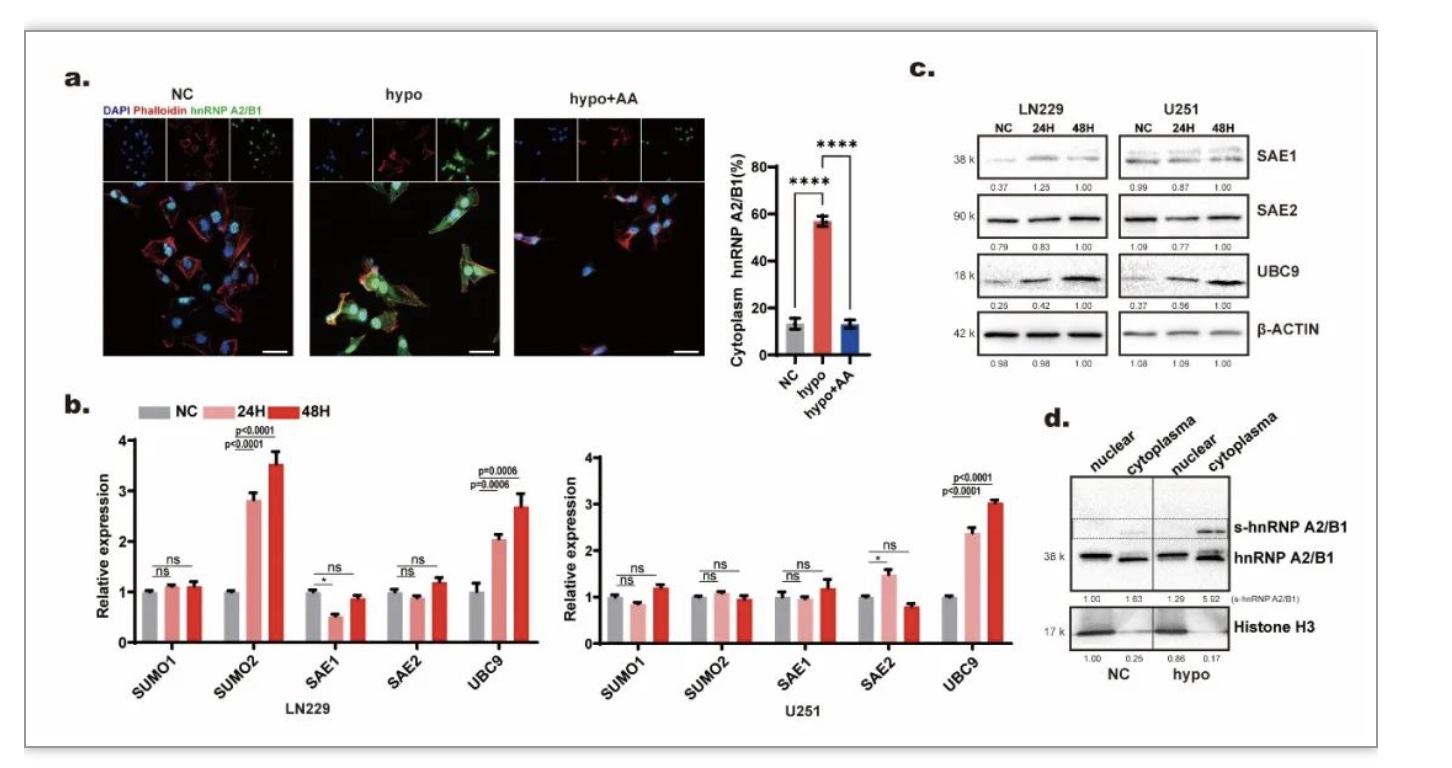
图4. 低氧提高hnRNP A2/B1类泛素化水平促进其向细胞质中定位
(图源:Guo Q, et al., Cell Death Dis, 2023)
通过敲减hnRNP A2/B1阻断外泌体分选后,低氧下细胞内miR-204-3p的含量上升(图3 c),这一结果提示低氧可能促进了miR-204-3p的合成。生信分析提示SOX9可能是控制miR-204-3p合成的转录因子,进一步研究表明敲减SOX9能够降低miR-204-3p在胶质瘤细胞及外泌体中的表达量(图5 a-b),同时双荧光素酶报告基因实验和CHIP实验也证实SOX9能与miR-204-3p启动子区域结合(图5 c-d)。低氧下SOX9表达量明显上调(图5 e-f),且敲减SOX9能降低低氧条件下miR-204-3p前体pri-204-3p的表达量(图5 g);以上结果表明低氧通过上调SOX9促进miR-204-3p的转录。
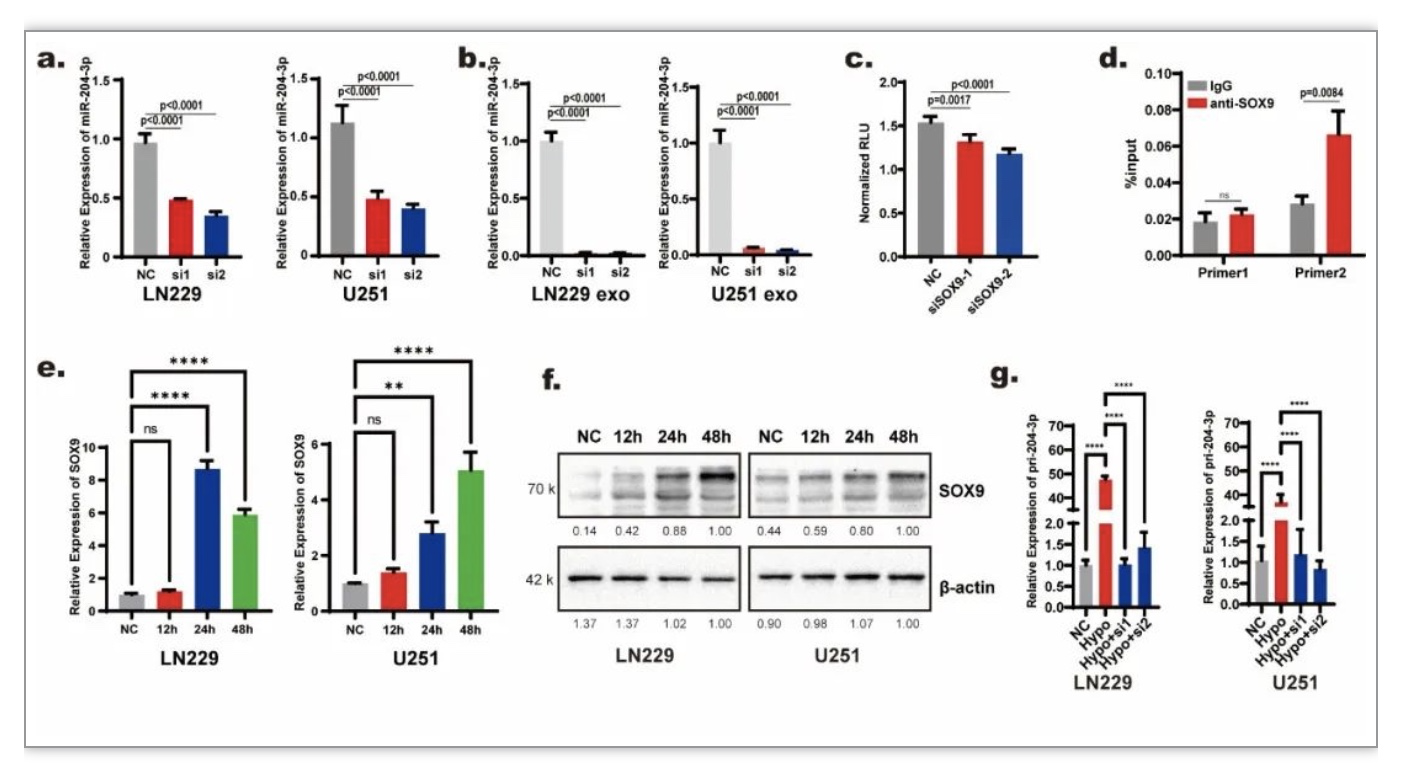
图5. 低氧通过上调SOX9促进miR-204-3p的转录
(图源:Guo Q, et al., Cell Death Dis, 2023)
胶质瘤细胞可以通过外泌体改造免疫微环境。胶质瘤来源的外泌体能够被血管上皮细胞吞噬(图6 a)。外泌体能够促进血管上皮细胞的成管及迁移,敲减外泌体中的miR-204-3p能够明显降低这种促进作用(图6 b-c)。转染miR-204-3p的mimic能显著下调ATXN1、STAT3及p-STAT3(图6 d-e),且双荧光素酶报告基因实验证实miR-204-3p能够靶向ATXN1(图6 f)。这些结果说明外泌体miR-204-3p能够通过ATXN1/STAT3通路促进血管上皮细胞的血管生成。
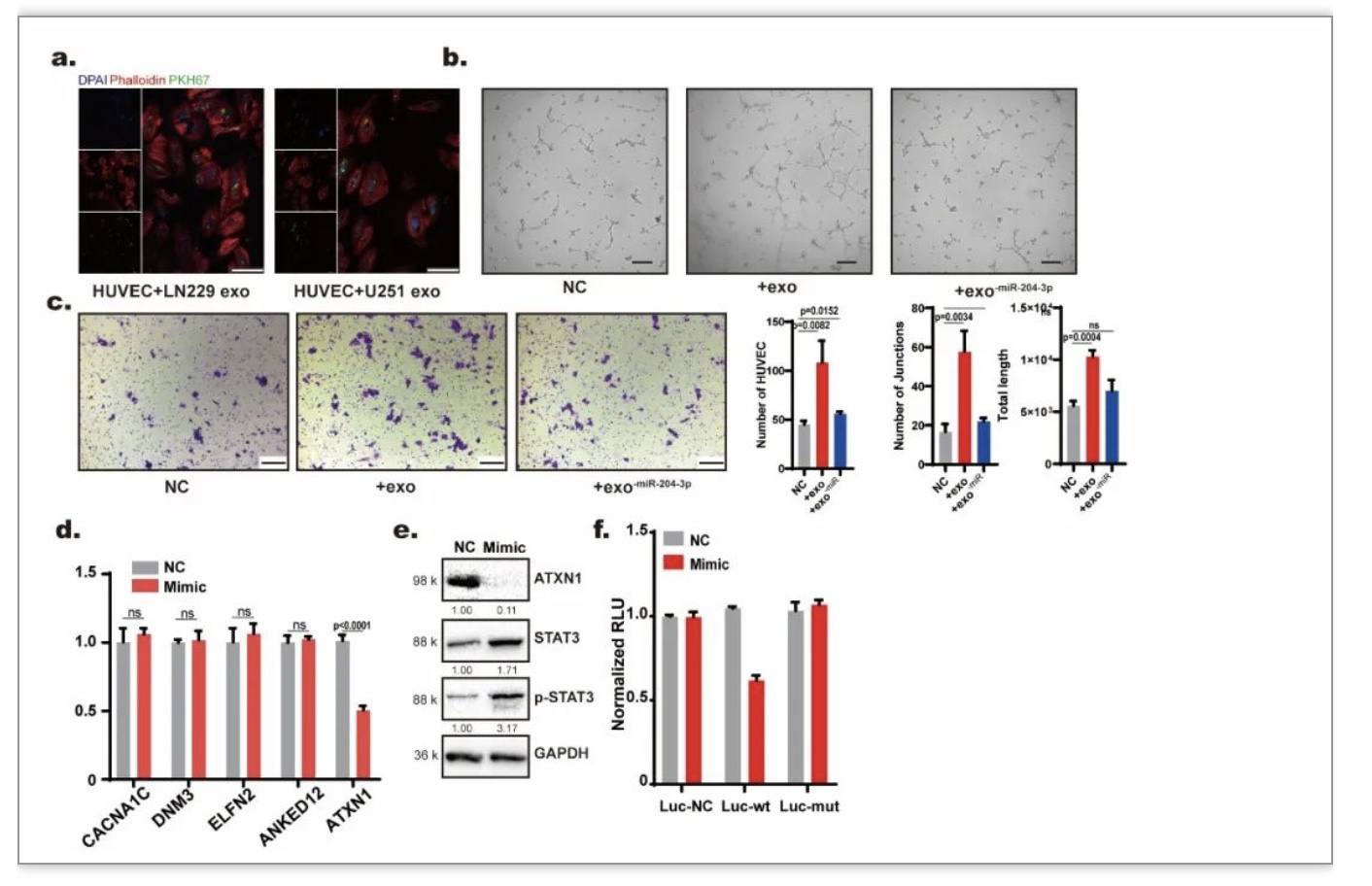
图6.外泌体miR-204-3p通过ATXN1/STAT3通路促进血管上皮细胞成管及迁移
(图源:Guo Q, et al., Cell Death Dis, 2023)
该研究还针对以上miR-204-3p外泌体分选机制选取了类泛素化抑制剂TAK-981作为治疗药物。实验结果提示TAK-981能够降低胶质瘤细胞内的hnRNP A2/B1的类泛素化水平,降低低氧下外泌体中miR-204-3p的表达量(图7 a-b)。TAK-981也在动物模型中抑制了肿瘤的生长、减少了肿瘤内的血管生成(图7 c-d),表现出了良好的抗肿瘤效果。
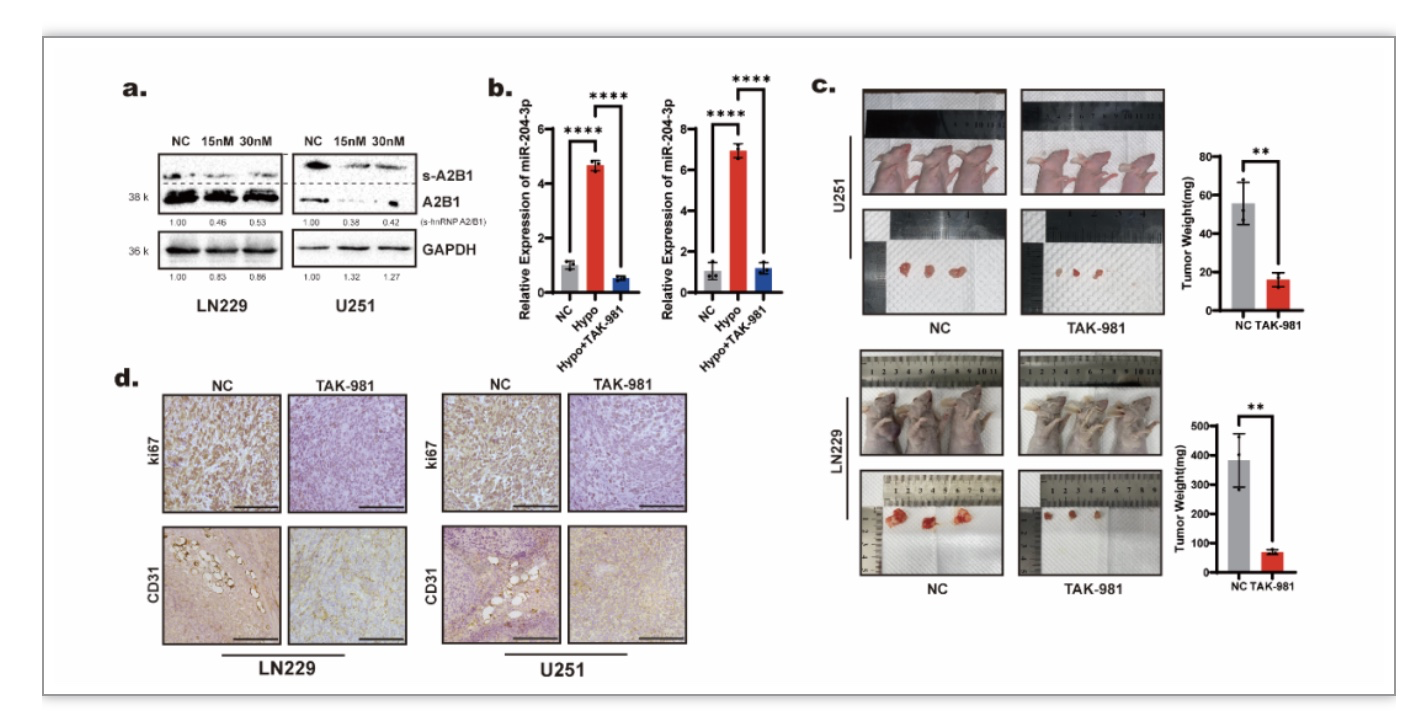
图7. 类泛素化抑制剂TAK-981能够减少血管生成并抑制胶质瘤生长
(图源:Guo Q, et al., Cell Death Dis, 2023)

