信号转导和转录激活因子(STAT)最初作为DNA结合蛋白被发现,可介导干扰素依赖性基因的表达。哺乳动物STAT家族包括STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6,它们介导多种细胞内信号通路。其中,STAT3(Signal transducer and activator of transcription 3)为白细胞介素-6(IL-6)激活的急性期反应因子 (APRF) 复合物的一个组成部分;可被细胞因子、生长因子受体和非受体样酪氨酸激酶激活。
STAT3往往在恶性肿瘤中高表达和持续性激活,通过调节与癌细胞存活、增殖、侵袭、转移、耐药性及免疫逃避相关的基因促进胃癌等多种恶性肿瘤的进展与转移。因此,靶向STAT3的小分子药物开发也成为近二十年来研究热点之一。已有报道多种化合物具有STAT3相关通路抑制活性,但尚未有STAT3靶向药物上市。研究团队长期关注STAT3在恶性肿瘤及免疫疾病发生发展中的功能与靶向策略,利用醌类基团以及查尔酮发现多个STAT3小分子抑制剂[1,2]。天然产物中存在着许多具有独特结构的化合物,是具有潜在抗癌价值药物的重要来源。在过去的研究中,通过基于结构的虚拟筛选,研究人员从药用植物和海洋真菌中识别具有抗癌功效的新活性化合物,它们可以作为潜在的STAT3抑制剂并进行进一步的开发[3] 。

该研究通过人类胃癌细胞系生存能力的依赖性评分发现STAT3在近一半的胃癌细胞系中是必不可少的。(图1A,B)进一步生物信息学分析表明STAT3的mRNA表达在肿瘤组织中显著上调并且STAT3与癌症患者的总体生存时间呈负相关。(图1C,D)实验数据证实了STAT3在胃癌中发挥重要作用。
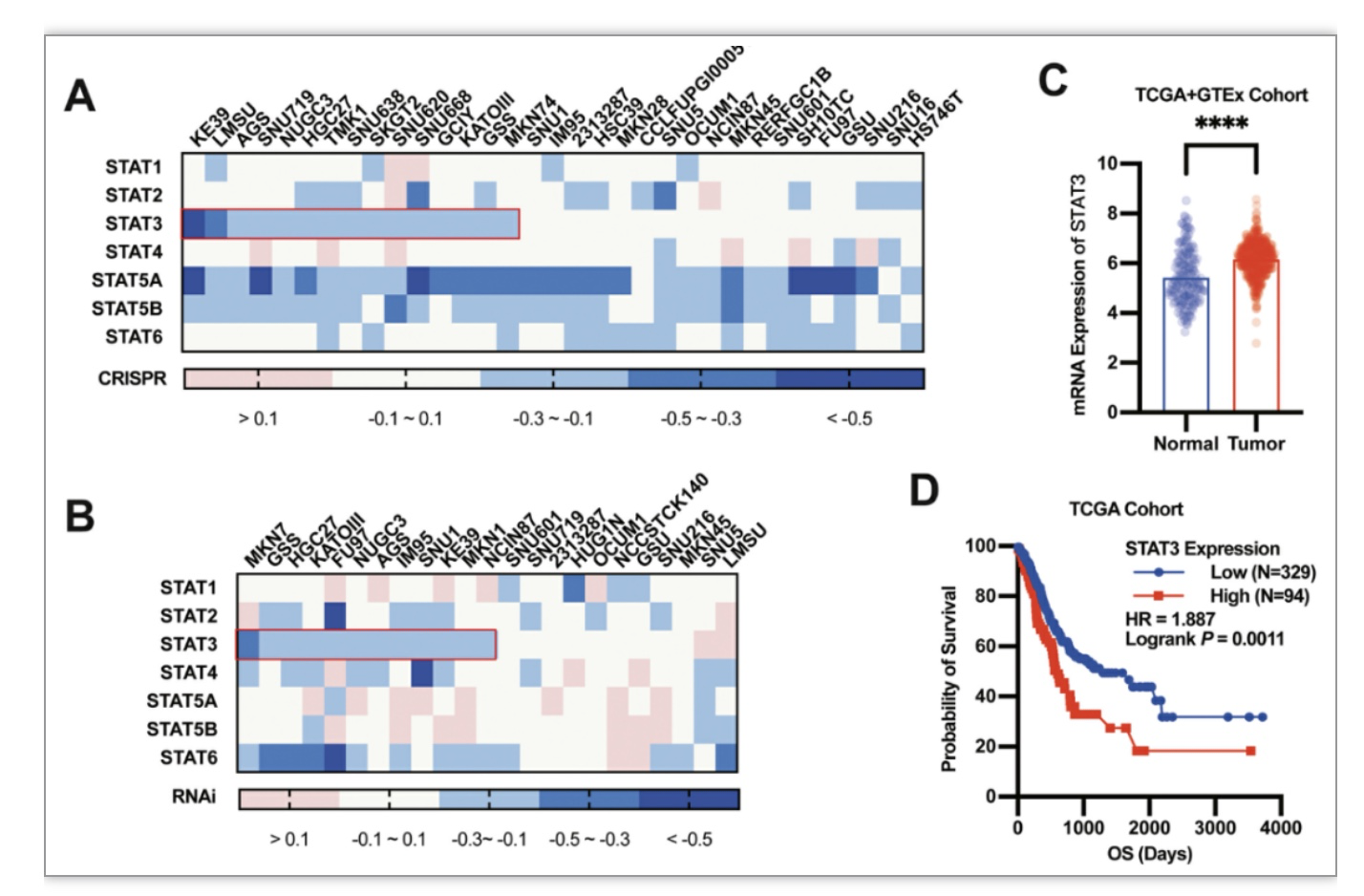
图1 STAT3在癌症中至关重要
(图源:Xiaoqing Guan et al., Pharmacological Research, 2023)
该研究为了筛选出有效的STAT3的小分子抑制剂,通过虚拟筛选试验发现了一种名为XYA-2(N-(3,7-二甲基-2,6-辛二烯基)−2-氮杂-2-脱氧财阀病毒素a)的活性化合物。(图2A)该研究利用电子对接和以C188–9作阳性对照的SPR分析结果表明XYA-2与STAT3 SH2结构域相互作用(Kd = 3.29 μM),并发挥抗癌活性。(图2B-D)为了进一步阐明XYA-2的分子机制,该研究对XYA-2处理后MGC803细胞进行了RNA-seq分析和基于多重等压标签的定量MS,揭示了2786个基因和575个蛋白质的差异表达。其中最重要的是IL-6/STAT3信号通路中典型存在的基因表达减少(图2G-J)。该研究通过免疫荧光分析和Western Blot实验,进一步证实了XYA-2在体外抑制IL-6诱导的STAT3易位入核,和磷酸化STAT3(Tyr705)的表达(图2K-M)。
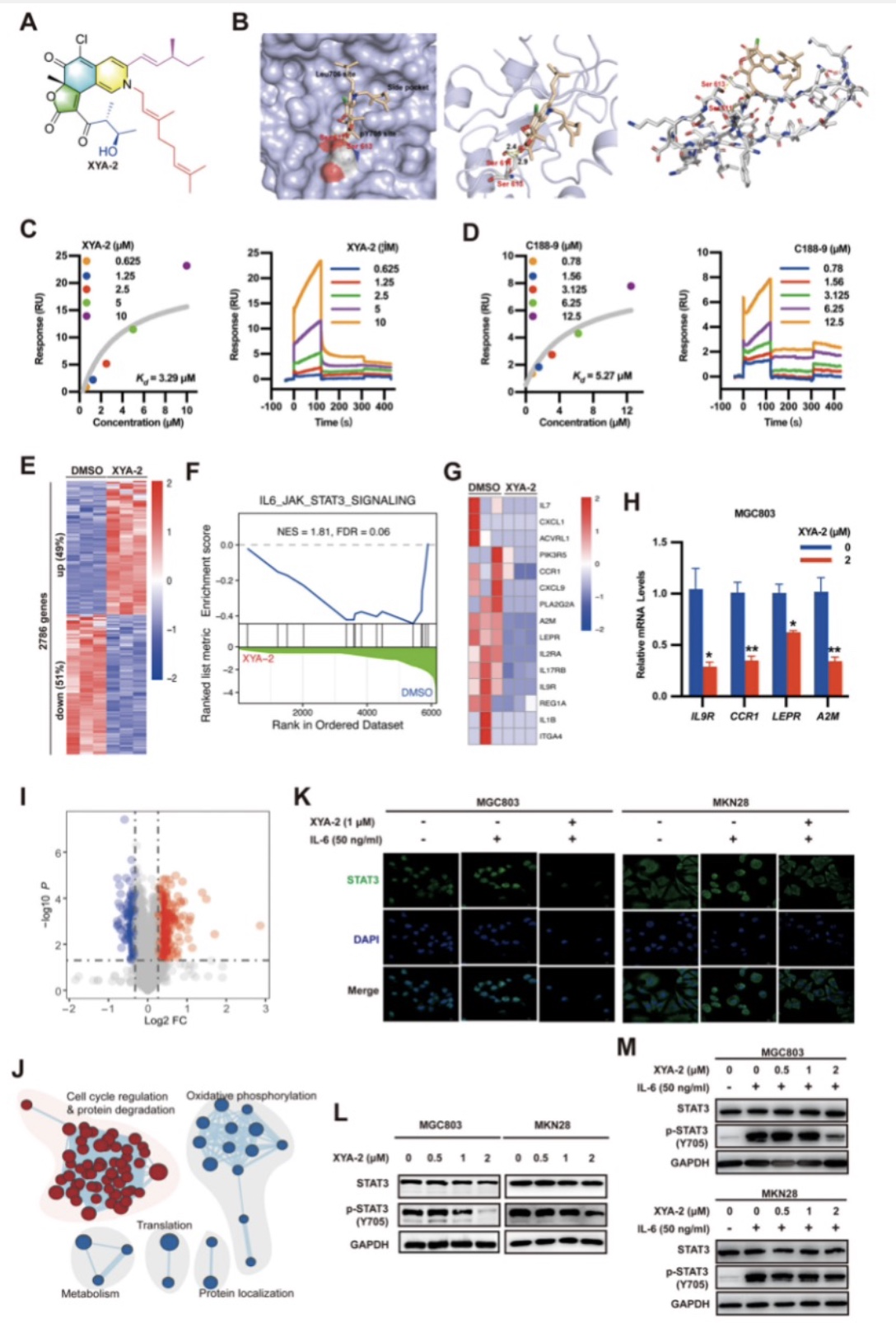
图2 XYA-2通过直接结合SH2结构域抑制STAT3磷酸化
(图源:Xiaoqing Guan et al., Pharmacological Research, 2023)
此外,体外研究证实XYA-2对多种胃癌细胞株有显著抑制活性,其IC50值介于0.5至0.7 μΜ之间。(图3A-C)同时,XYA-2被发现能显著抑制胃癌MGC803和MKN28细胞的克隆形成和迁移。(图3D,E)为了确定XYA-2在体内的抗胃癌疗效,该研究对MKN28衍生的异种移植小鼠模型进行腹腔注射XYA-2(10 mg/kg/day,7天/周),结果显示XYA-2有显著抑制肿瘤生长且小鼠的体重无显著差异。(图4A-D)另外,该研究先在SCID小鼠中构建了MGC803原位胃癌小鼠模型,再进行活体动物体内光学成像实验和各器官的H&E染色实验,结果显示XYA-2能抑制体内肝脏和脾脏转移且无明显的宿主毒性。(图4E-K)进一步进行Western Blot实验,与载体组相比,XYA-2处理小鼠的肿瘤组织中Tyr705上STAT3的磷酸化减少。(图4L)据数据显示XYA-2在体内外均表现出抑制胃癌生长和迁移能力。
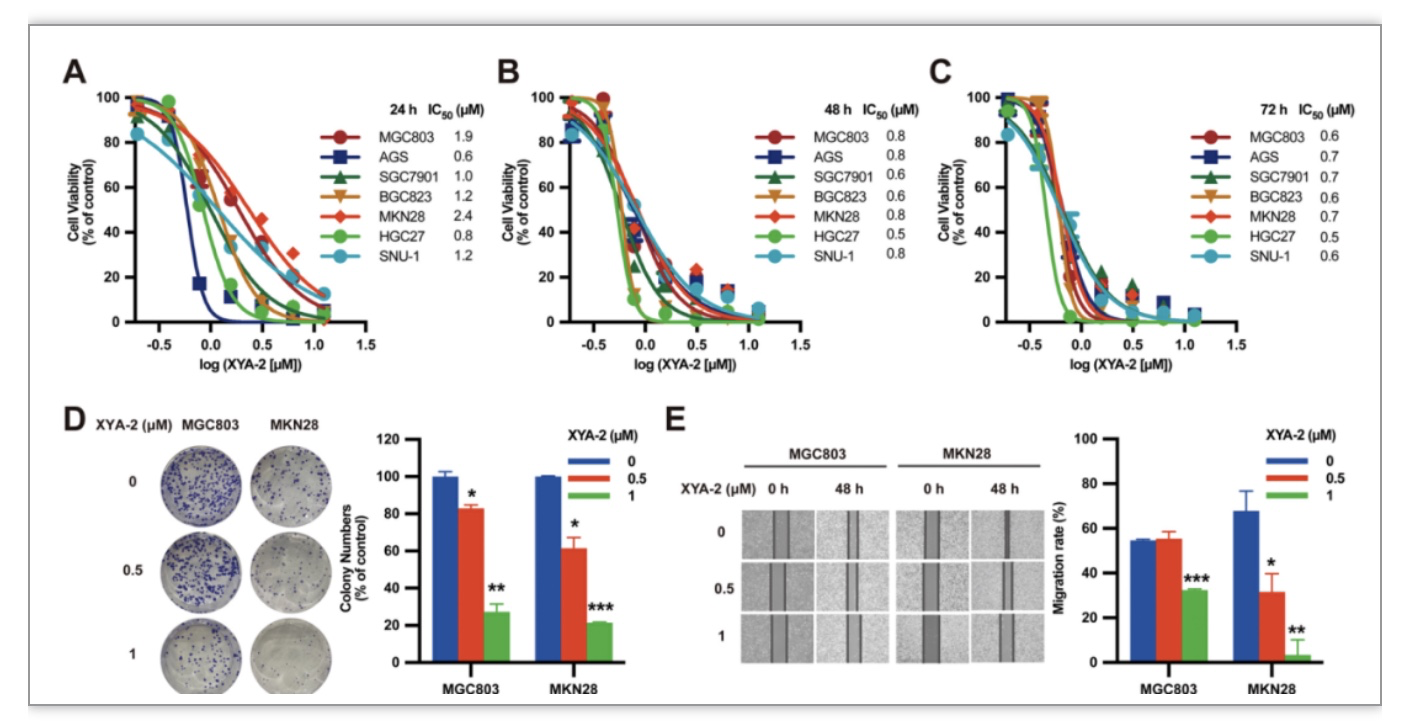
图3 XYA-2显著抑制胃癌细胞的增殖和迁移
(图源:Xiaoqing Guan et al., Pharmacological Research, 2023)
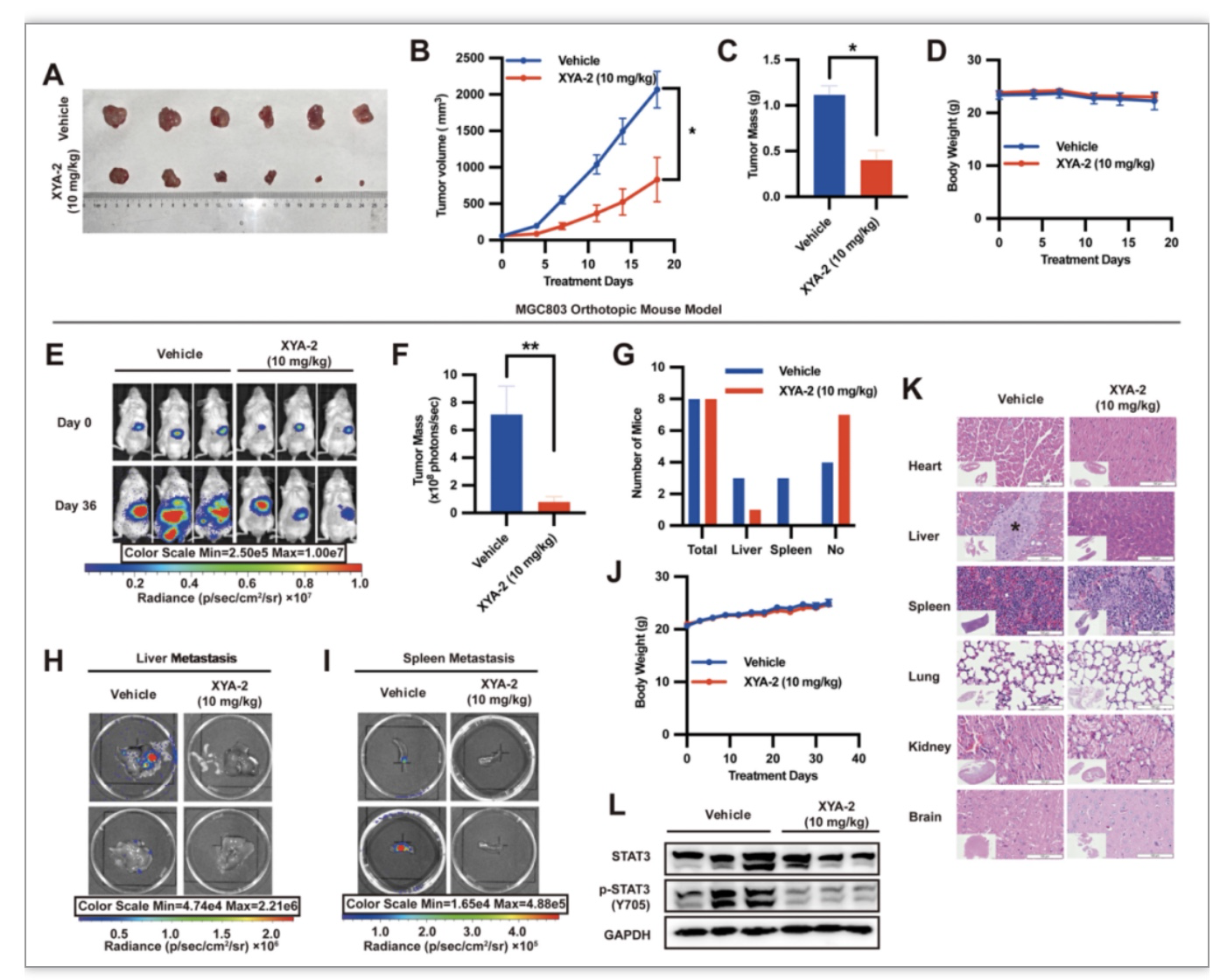
图4 XYA-2在体内抑制肿瘤生长和转移
(图源:Xiaoqing Guan et al., Pharmacological Research, 2023)
为了进一步探索XYA-2的分子机制,该研究通过GO和KEGG富集分析揭示了细胞周期调节和蛋白质降解途径的相对上调,以及氧化磷酸化、翻译、蛋白质定位和代谢途径的下调。(图5A-D)已有研究显示,STAT3抑制剂通过抑制STAT3/MYC信号通路实现抑制增殖作用。因此,该研究推断XYA-2可能也通过该途径发挥作用。为了证明这一推测,该研究进行了Western Blot实验,发现MYC蛋白以XYA-2浓度依赖的方式显著下调。(图5E,F)另一方面,该研究对比RNA-seq数据集发现在基因和蛋白质水平上SLC39A10显著下调。先前的研究表明,SLC39A10在锌稳态中发挥着不可或缺的作用,锌以多种方式参与细胞分裂与增殖。并且该研究通过实验再次证明SLC39A10表达高与患者的总体生存期短相关,其表达水平受STAT3负调节。(图5J-L)进一步对XYA-2处理MGC803和MKN28细胞进行qRT-PCR和Western Blot分析,揭示SLC39A10以浓度依赖的方式被XYA-2负调控在mRNA和蛋白质水平。(图5M,N)此外,为了在更具临床相关性的动物模型中观察XYA-2对肿瘤生长的影响,该研究对患者来源的异种移植(PDX)小鼠模型进行与以顺铂为对照的实验,XYA-2在体内仍然表现出相似的肿瘤抑制活性,并延长了荷瘤小鼠的存活时间。(图6A-C)同时结果表明XYA-2抑制STAT3的磷酸化水平,下调MYC和SLC39A10的mRNA表达。(图6D-E)。
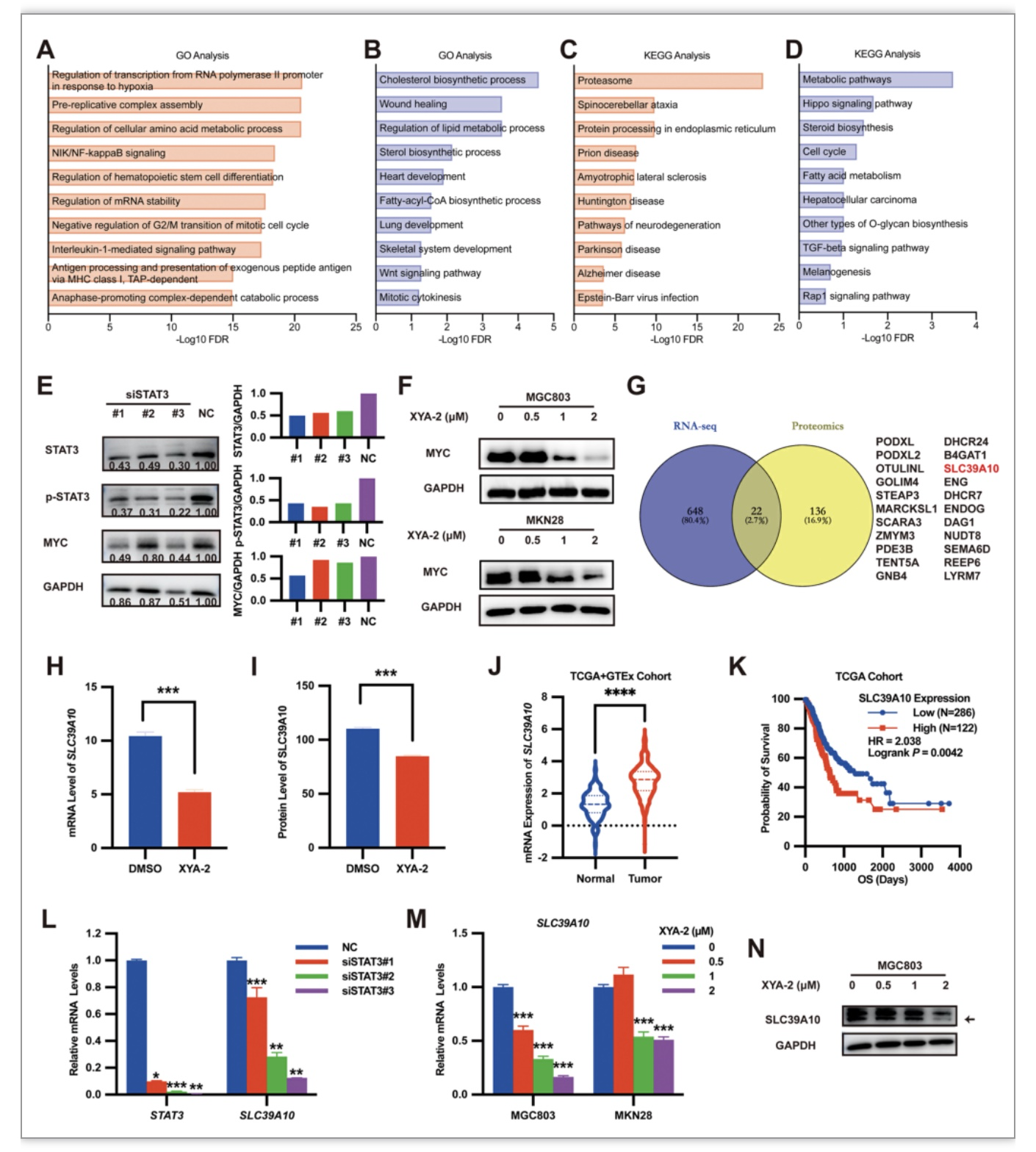
图5 XYA-2通过MYC和SLC39A10的双重抑制抑制STAT3信号通路
(图源:Xiaoqing Guan et al., Pharmacological Research, 2023)
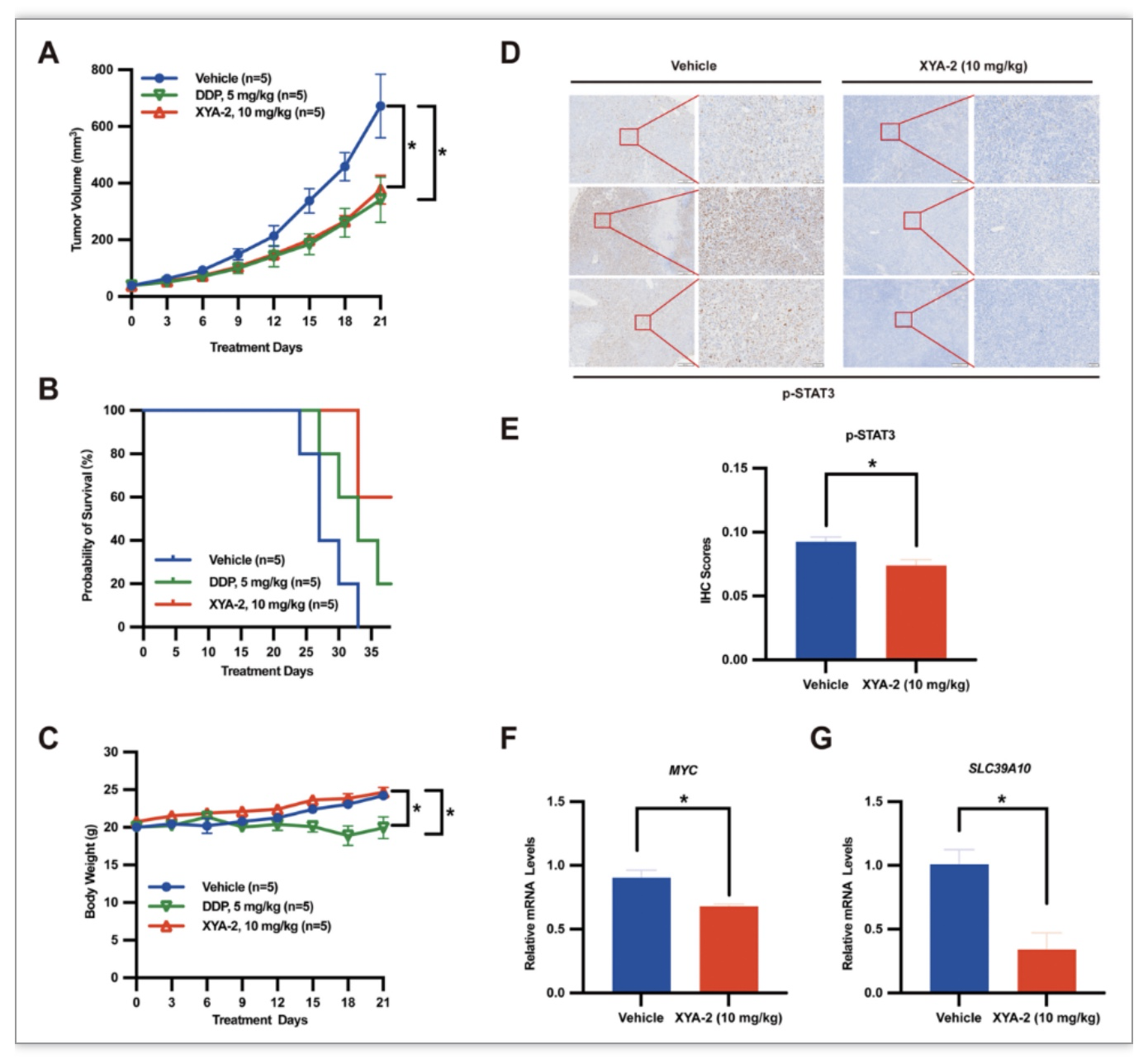
图6 XYA-2显著抑制胃癌患者异种移植模型中的肿瘤生长
(图源:Xiaoqing Guan et al., Pharmacological Research, 2023)
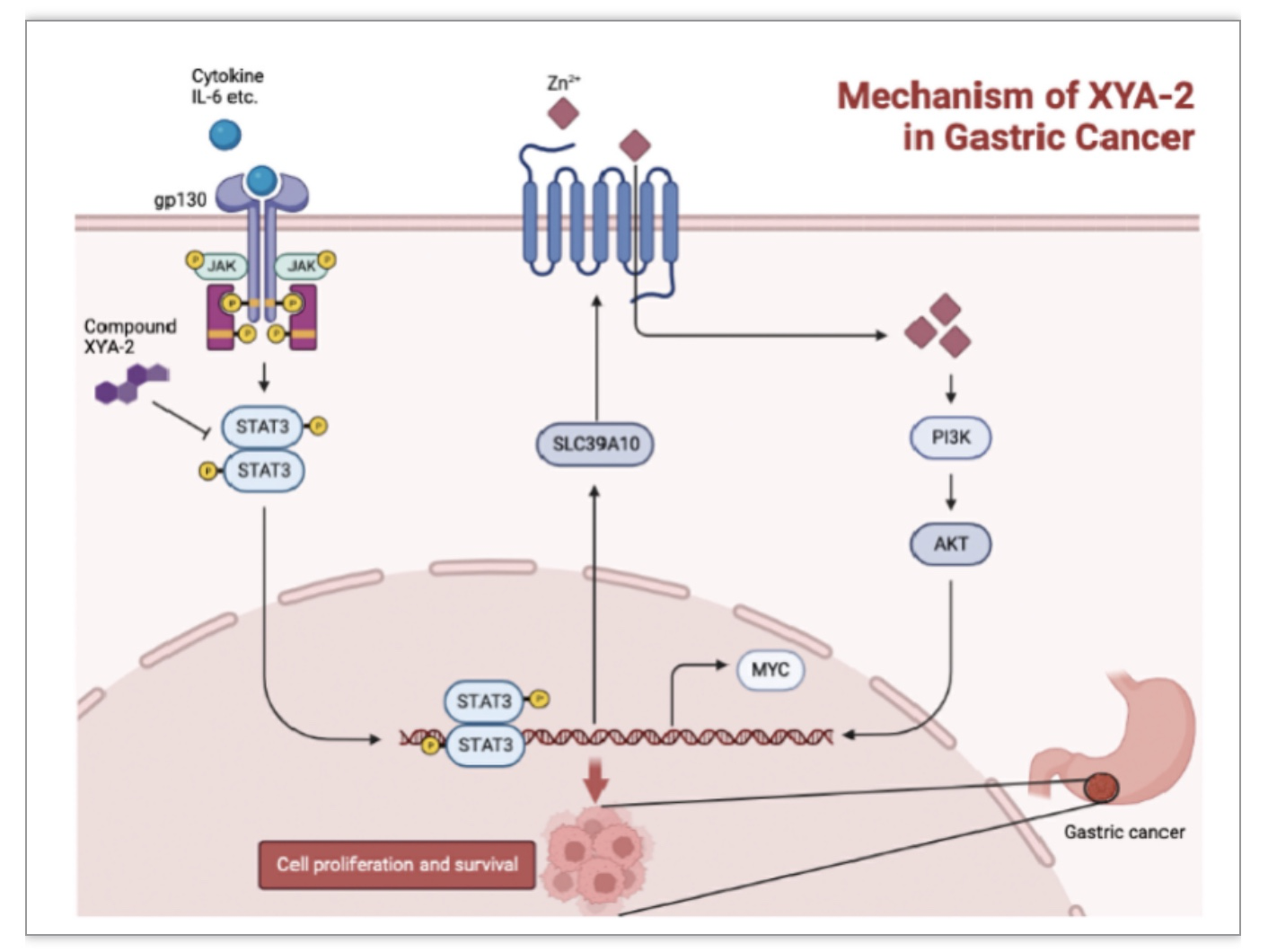
图7 XYA-2在癌症中的双重抑制机制示意图
(图源:Xiaoqing Guan et al., Pharmacological Research, 2023)
综上所述,该研究在计算建模中发现直接与STAT3的SH2结构域相互作用的有效小分子抑制剂XYA-2。进一步的体内评估表明XYA-2显著抑制了肿瘤组织的生长与迁移。同时该研究揭示了XYA-2较为复杂的抗肿瘤活性的分子机制。XYA-2直接结合STAT3的SH2结构域,阻断其磷酸化激活和核移位,抑制MYC和SLC39A10的表达,在体内外发挥抗癌症的功效。因此,XYA-2可能是用于治疗胃癌的有效STAT3抑制剂,而MYC和SLC39A10的双重抑制有望成为STAT3驱动的癌症的有效治疗策略。该研究中的发现证明了XYA-2作为一种STAT3抑制剂进一步开发抗癌症的潜在价值,并可能在未来有广泛的应用。

