近年来,世界范围内2型糖尿病、多囊卵巢综合征、肥胖等复杂代谢性疾病高发,为公共卫生健康带来巨大负担。多囊卵巢综合征是育龄期女性最常见最复杂的生殖内分泌代谢性疾病。多个欧洲人群的全基因组关联研究发现THADA为2型糖尿病的易感基因[5-7],且THADA基因变异与人群胰岛素分泌反应性显著相关[8]。然而十余年来,THADA在葡萄糖代谢调控中的作用及其参与T2D和PCOS发病的具体分子机制仍然不清。

围绕生殖代谢性疾病,十年磨一剑,从遗传学角度聚焦2型糖尿病(T2D)和多囊卵巢综合征(PCOS)共有遗传易感基因THADA,进行了系统功能研究。该研究发现THADA通过调控胰岛β细胞功能和β细胞凋亡参与2型糖尿病发生发展,THADA缺失通过改善胰岛素分泌对高血糖小鼠发挥代谢保护作用,从而为代谢性疾病防治提供了新的分子靶点和干预策略。
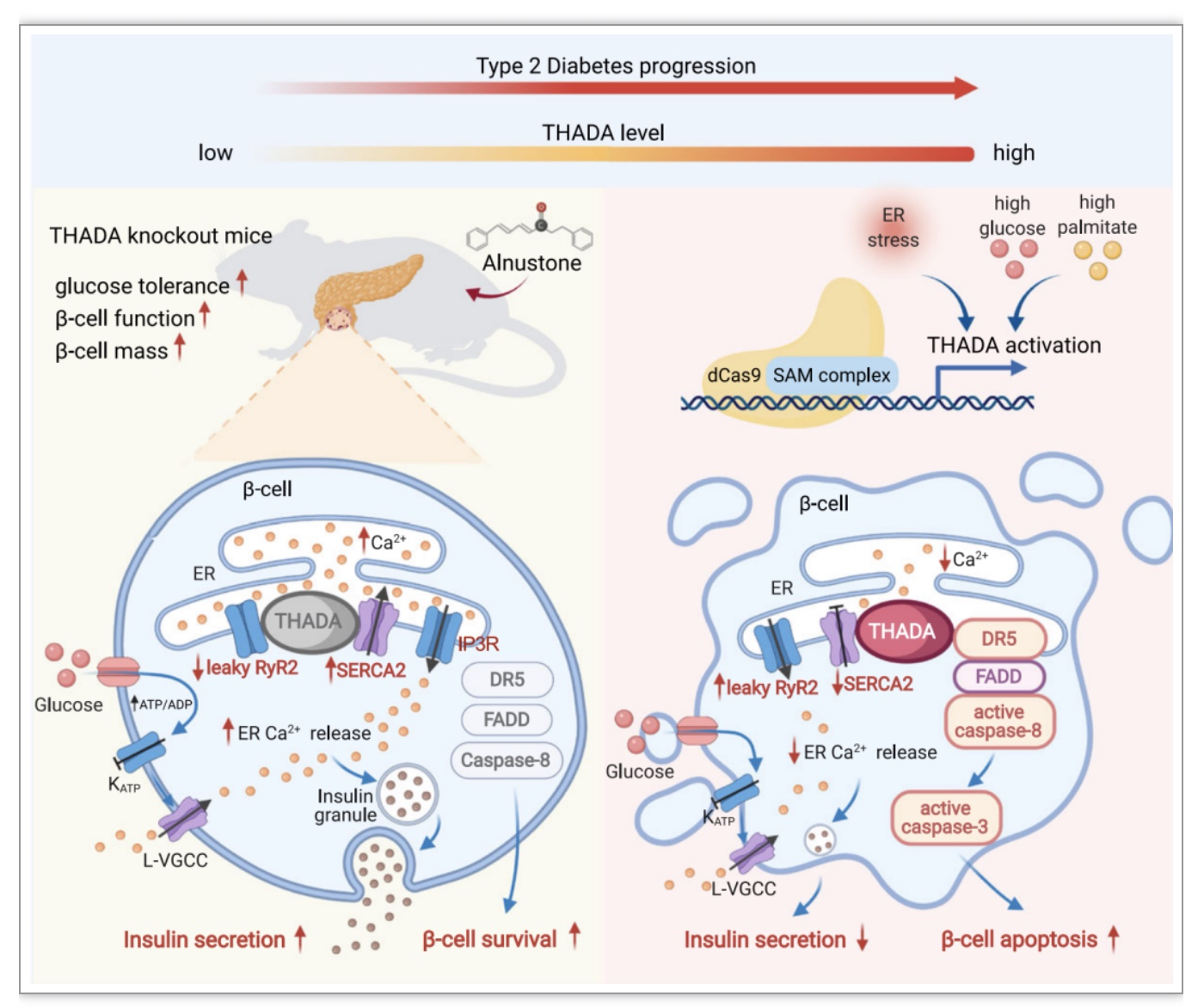
研究人员发现在2型糖尿病患者胰腺、db/db小鼠、高脂高糖饮食诱导的2型糖尿病小鼠胰岛中,THADA表达水平显著上调。为明确THADA在机体代谢稳态调控中的作用,研究者构建了Thada基因大片段敲除小鼠,发现雄性和雌性敲除小鼠的进食后血糖和葡萄糖耐量均显著改善。研究者进一步构建了β细胞特异性Thada敲除小鼠(Thadaf/f, Ins1-Cre),发现该小鼠可重现全身敲除小鼠的代谢表型,证实血糖稳态的改善由胰岛β细胞所介导。
进一步体内外研究发现Thada敲除可显著增强胰岛素分泌,并抑制β细胞凋亡、增加β细胞质量。而利用CRSPR/dCas9技术内源性激活Thada表达后,则会抑制胰岛素分泌,并促进内质网应激诱导的细胞凋亡。研究者通过钙成像实验,结合免疫共沉淀、邻位连接测定、免疫荧光等分子生物学手段,发现THADA通过结合内质网钙泵SERCA2抑制内质网的Ca2+摄取,同时可与内质网钙通道蛋白RyR2结合引发内质网Ca2+泄漏,从而抑制Ca2+诱导的胰岛素囊泡分泌。在持续内质网应激下,THADA结合并激活DR5、FADD、Caspase-8组成的促凋亡复合体,从而加剧了内质网应激诱导的β细胞凋亡。
为了明确THADA缺失对2型糖尿病的保护作用,研究人员构建了高脂高糖饮食诱导、链脲佐菌素结合高脂饮食诱导的两种T2D小鼠模型。无论在雄性还是雌性小鼠中,Thada敲除均可通过促进胰岛素分泌并抑制β细胞凋亡,从而显著降低上述小鼠的高血糖、并改善其糖耐量损伤。研究者进一步通过高内涵筛选分析,发现了一种可能抑制THADA功能的天然小分子化合物,并在饮食诱导的肥胖小鼠模型中证实该化合物可有效改善小鼠糖代谢。
文章模式图
(图源自Nature Communications)
综上研究结果表明,THADA缺失可通过影响内质网钙储存和内质网应激诱导的凋亡,从而增强胰岛β细胞功能并保存β细胞质量、改善2型糖尿病小鼠的糖代谢,靶向THADA可作为2型糖尿病的全新有效干预手段。该研究不仅为解析T2D、PCOS等代谢性疾病的遗传发病机制提供了理论依据,而且确立了THADA在2型糖尿病中的致病作用,为高风险人群提供了预防或延缓糖尿病的潜在分子靶点。