树突状细胞(dendritic cell,DC)免疫疗法是近年的研究热点[1-3]。在器官移植中,最佳抑制性DC诱导策略尚未达成共识[4]。目前研究的热点主要集中在未成熟DC,然而,未成熟DC在炎症环境中可能分化为成熟DC或免疫原性DC[5]。因此,现阶段仍然需要开发新的抑制性DC诱导策略。
DC修饰的一个可能靶点是X-盒结合蛋白1(X box–binding protein 1,XBP1)。XBP1是一种多功能转录因子,参与多种生理和病理过程,包括内质网扩张、细胞分化以及缺氧反应等[6-9]。XBP1在多种免疫细胞的分化和功能调控中发挥重要作用[10-13]。研究表明,肿瘤微环境中骨髓源性树突状细胞(bone marrow-derived dendritic cells,BMDCs)中XBP1的组成性激活可降低细胞表面MHC-I,抑制CD8+T细胞活化和增殖,从而导致肿瘤细胞免疫逃逸[14, 15]。这种XBP1介导的免疫逃逸机制是否可以为诱导器官移植免疫耐受提供新的思路,值得进一步探讨。

据报道,XBP1敲除对DC的影响在不同的DC亚型中存在微调[16, 17],因此,作者首先检测了Xbp1−/−BMDCs的表型和功能。Xbp1−/−BMDCs低表达MHC-I,高表达MHC-II、CD40、CD80、CD86和PD-L1。体外混合淋巴细胞培养结果表明,Xbp1−/−BMDCs可抑制同种异体T细胞的增值及活化,促进其凋亡,是同种异体T细胞的弱刺激物(图1)。

图1 Xbp1−/−BMDCs低表达MHC-I,是同种异体T细胞的弱刺激物
(图源:KL Sun, et al., JHLT, 2022)
记忆T细胞(memory T cells,Tmem)与移植物不良预后有关[18]。体外淋巴细胞混合培养结果表明,Xbp1−/−BMDCs同时抑制了同种异体CD44hiCD62Lhi中枢记忆T细胞和CD44hiCD62Llo效应记忆T细胞的增殖。因此,BMDCs中XBP1的缺失损害了其诱导同种异体CD44+Tmem增殖的能力(图2)。
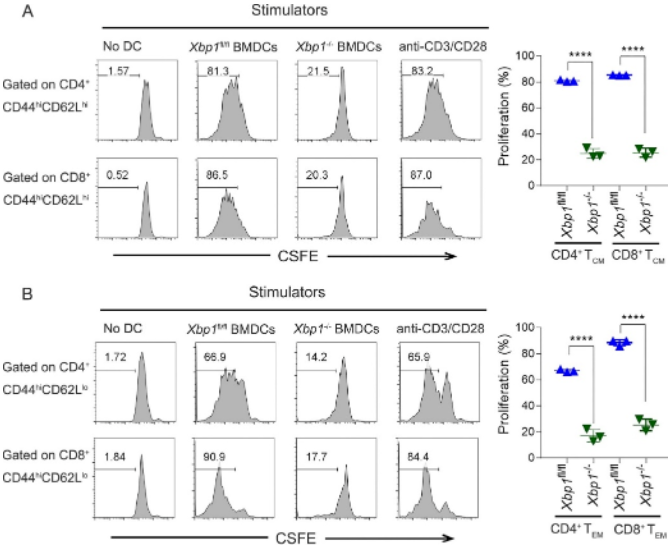
图2 Xbp1−/−BMDCs是同种异体CD44+ Tmem增殖的弱刺激物
(图源:KL Sun, et al., JHLT, 2022)
作者以C57BL/6小鼠为供者,Balb/c小鼠为受者,构建腹腔异位心脏移植模型[19, 20],探讨移植前Xbp1−/− BMDCs过继输注对体内同种异体移植排斥反应的影响。移植前Xbp1−/−BMDCs过继输注能减少免疫抑制剂的暴露,保护心脏移植物。移植后第5天,心脏移植物、受体脾脏以及外周血免疫分析显示,Xbp1−/−BMDCs过继输注可抑制CD8+ T细胞介导的同种异体排斥反应,并减少循环中供体特异性IgG的形成(图3)。
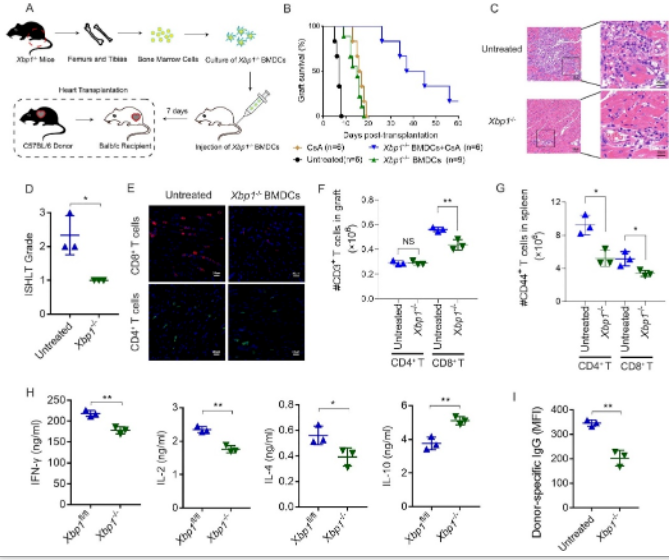
图3 Xbp1−/−BMDCs过继输注可抑制CD8+ T细胞介导的排斥反应,并减少循环中供体特异性IgG的含量,延长心脏移植物的存活时间
(图源:KL Sun, et al., JHLT, 2022)
细胞表面MHC-I的表达反映了MHC-I分子的翻译、折叠、组装及转运过程[21, 22]。MHC-I分子总量及亚细胞分布的定量分析结果显示,BMDCs中XBP1的缺失不影响MHC-I的总量,但可导致MHC-I滞留在内质网中,免疫电镜下也可观察到MHC-I分子在内质网中滞留。作者进一步定量检测了APM的表达,发现Xbp1−/−BMDCs中tapasin的表达水平显著降低。这些数据表明,Xbp1−/−BMDCs细胞表面MHC-I降低可能与tapasin减少有关(图4)。
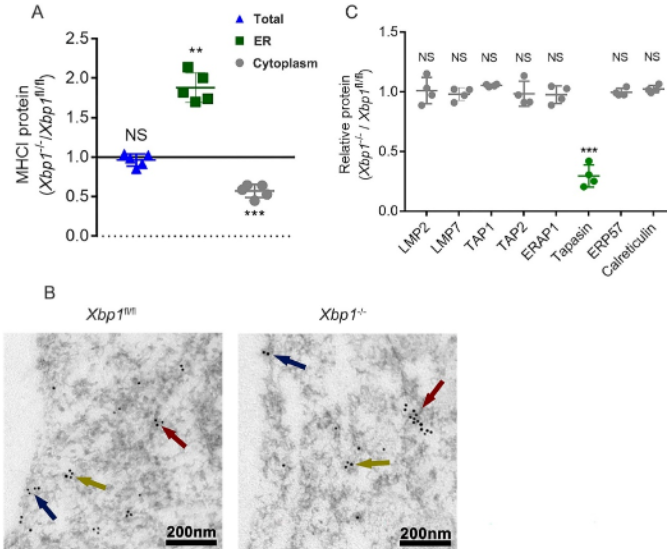
图4 Xbp1−/− BMDCs细胞表面MHC-I降低可能与tapasin减少有关
(图源:KL Sun, et al., JHLT, 2022)
既往研究报道,一些免疫细胞的XBP1依赖性表型与RIDD(IRE1-dependent decay)有关,而tapasin是RIDD的潜在靶点[14, 23]。因此,作者推测,Xbp1−/−BMDCs中tapasin的降低可能与RIDD有关。为了证明这一推测,作者首先检测内质网的结构和功能,验证了Xbp1−/−BMDCs中存在内质网应激,随后,通过检测p-IRE1α和RIDD靶分子表达水平的改变,证明了Xbp1−/−BMDCs中RIDD的过度激活。而化学抑制RIDD的活性能够将tapasin的表达恢复到内源水平。这些数据证明,Xbp1−/−BMDCs中tapasin的减少与RIDD的过度激活有关。
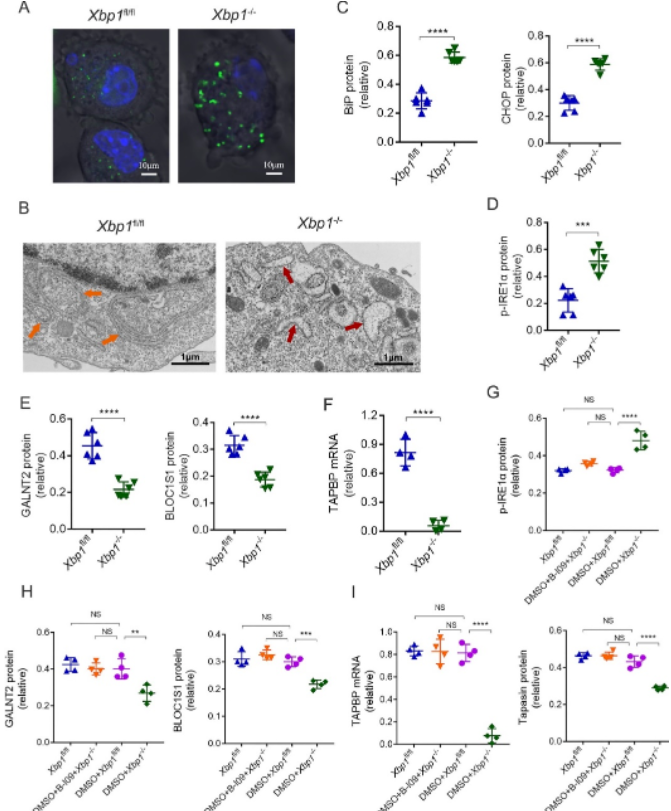
图5 在Xbp1−/−BMDCs中tapasin表达水平的降低是由RIDD的过度激活引起的
(图源:KL Sun, et al., JHLT, 2022)
此外,化学抑制RIDD可恢复Xbp1−/−BMDCs表面MHC-I表达,并恢复其刺激同种异体CD8+ T细胞增殖的能力(图6A)。
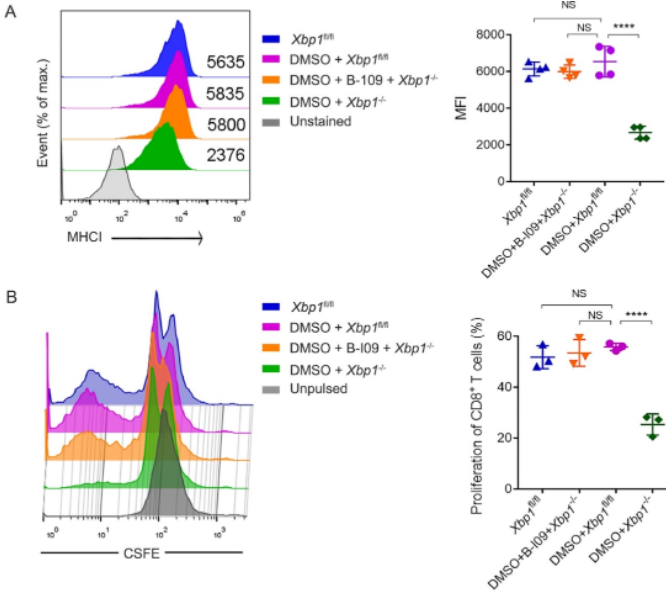
图6 化学抑制RIDD可恢复Xbp1−/−BMDCs表面MHC-I表达及其刺激同种异体CD8+ T细胞增殖的能力
(图源:KL Sun, et al., JHLT, 2022)
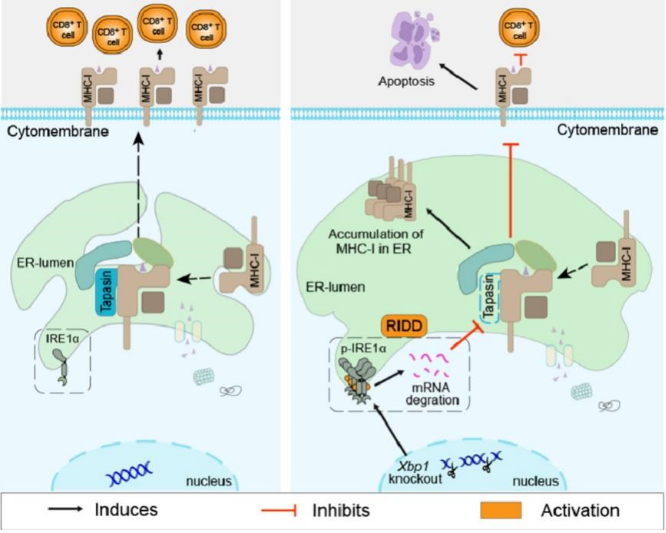
图7 BMDCs中XBP1的缺失引起内质网应激和RIDD的过度激活,通过TAPBP mRNA的RIDD降低tapasin的表达水平,进而降低细胞表面MHC-I表达水平,最终抑制CD8+ T细胞介导的同种异体排斥反应
(图源:KL Sun, et al., JHLT, 2022)

