液-液相分离(LLPS,liquid-liquid phase separation)是指关键分子达到阈值浓度时,与其他蛋白质或RNA等浓缩成密闭的液状隔室或溢出的动态过程。细胞内蛋白质和核酸等生物大分子通过LLPS自发转变为液滴(也称为无膜细胞器),通过控制核功能、调节细胞质量控制和组织生化网络,来维持细胞稳态[1]。液滴的异常调节导致多种神经退行性疾病和肿瘤发生[2-6]。p62与自噬起始蛋白FIP200相互作用以驱动大尺寸的自噬体形成,然后被自噬降解[7]。此外,p62缩合物通过与Keap1竞争性结合来干扰Keap1-Nrf2相互作用,导致Nrf2核易位并上调含有HO1等基因的抗氧化反应元件(ARE)的表达[8]。p62依赖性液-液相分离协同着聚集体形成与自噬降解来维持细胞内质量控制系统[9]。然而,调控p62参与LLPS的因素仍不清楚。该研究发现E3连接酶Smurf1促进p62液滴的形成和物质交换,并以此增强Nrf2激活、促进自噬。这项研究揭示了Smurf1、p62/Nrf2轴在通过LLPS机制确定Nrf2激活和底物清除中的复杂相互作用,为通过靶向Smurf1抑制GB环境适应力提供理论依据。

E3连接酶Smurf1在癌细胞中高度表达,并通过与新生的自噬体膜相互作用而被认为是选择性自噬的新介质[10,11]。有趣的是,团队发现在应激状态下Smurf1增加选择性自噬接头蛋白p62聚集体的数量和大小(图1)。团队成员发现这些p62聚集体具有液滴特性,能与周围环境进行分子交换。且Smurf1+p62+双阳性液滴的分子交换能力较p62+单阳性液滴强。团队发现Smurf1对p62相分离的这种促进作用增强Nrf2激活。
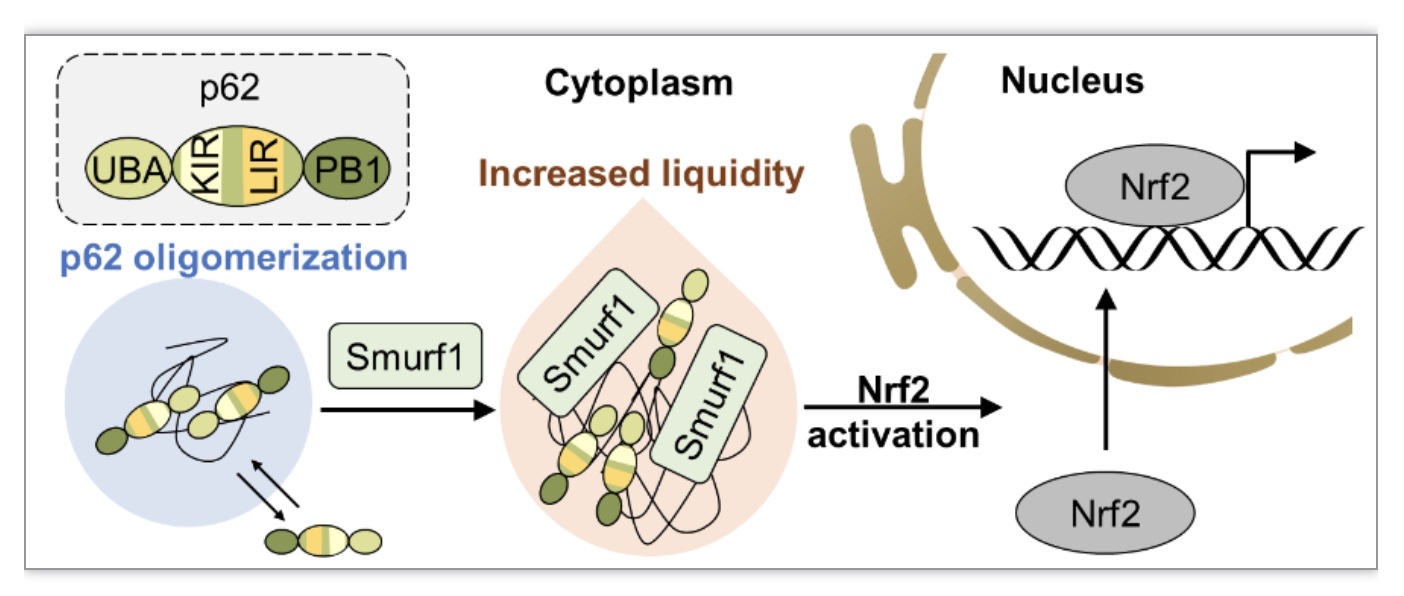
图1 p62聚集体具有液滴特性,能与周围环境进行分子交换
(图源:Xia Q, et al., Cell Biosci, 2023)
随后的机制探索实验证明,Smurf1以WW结构域和泛素链接酶活性依赖方式结合p62并促进p62与泛素结合,进而促进p62相分离发生。p62蛋白被证明与自噬接头蛋白NBR1、OPTN和NDP52协同作用[12-14]。团队发现过表达Smurf1特异性上调p62、NBR1蛋白水平及共定位。团队发现Nrf2是Smurf1和NBR1响应氧化反应的转录因子。应激诱导的Smurf1在Keap1-Nrf2氧化应激反应途径的激活过程中与p62和NBR1协作促进p62液滴的形成以及Nrf2的完全激活。Smurf1还通过p62与LC3结合促进液滴的自噬形成和降解。
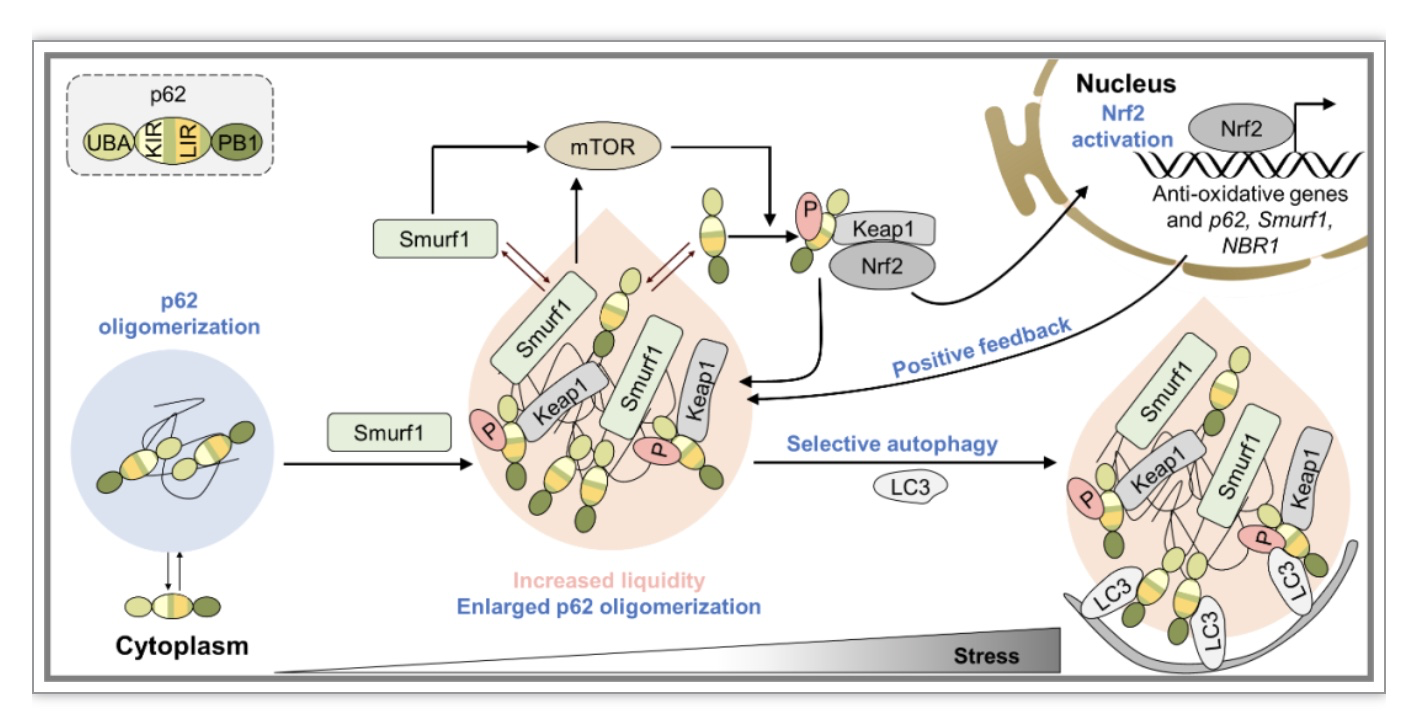
图2 工作机制图
(图源:Xia Q, et al., Cell Biosci, 2023)

