
作者先前的工作已经证明了在具有PI3KCA螺旋域突变的肿瘤中,p85β从PI3K复合物中解离并进入细胞核内从而促进肿瘤发生[5]。为进一步探究p85β核转位的生理条件或组织特异性,作者通过IHC检测了p85β在多种小鼠正常组织中(包括肝、肾、结肠、小肠、肺、脾、胃和心)的分布, 发现仅在小鼠肾脏的肾小管上皮细胞中,部分p85β明显定位于细胞核内,而在其他组织(比如:肺、心、小肠、结肠、脾、胃和肝)中p85β则主要定位于细胞浆中(图1)。之后作者通过对小鼠的正常组织进行细胞核-细胞质分离实验进一步确定了在肾组织的细胞质及细胞核蛋白中均存在大量p85β,而在其他组织中p85β主要出现在细胞浆中。同时作者在人的正常肾、肝和结肠组织观察到相似的结果,这些结果表明在人或小鼠的肾小管上皮细胞中p85β均存在明显的细胞核定位现象。
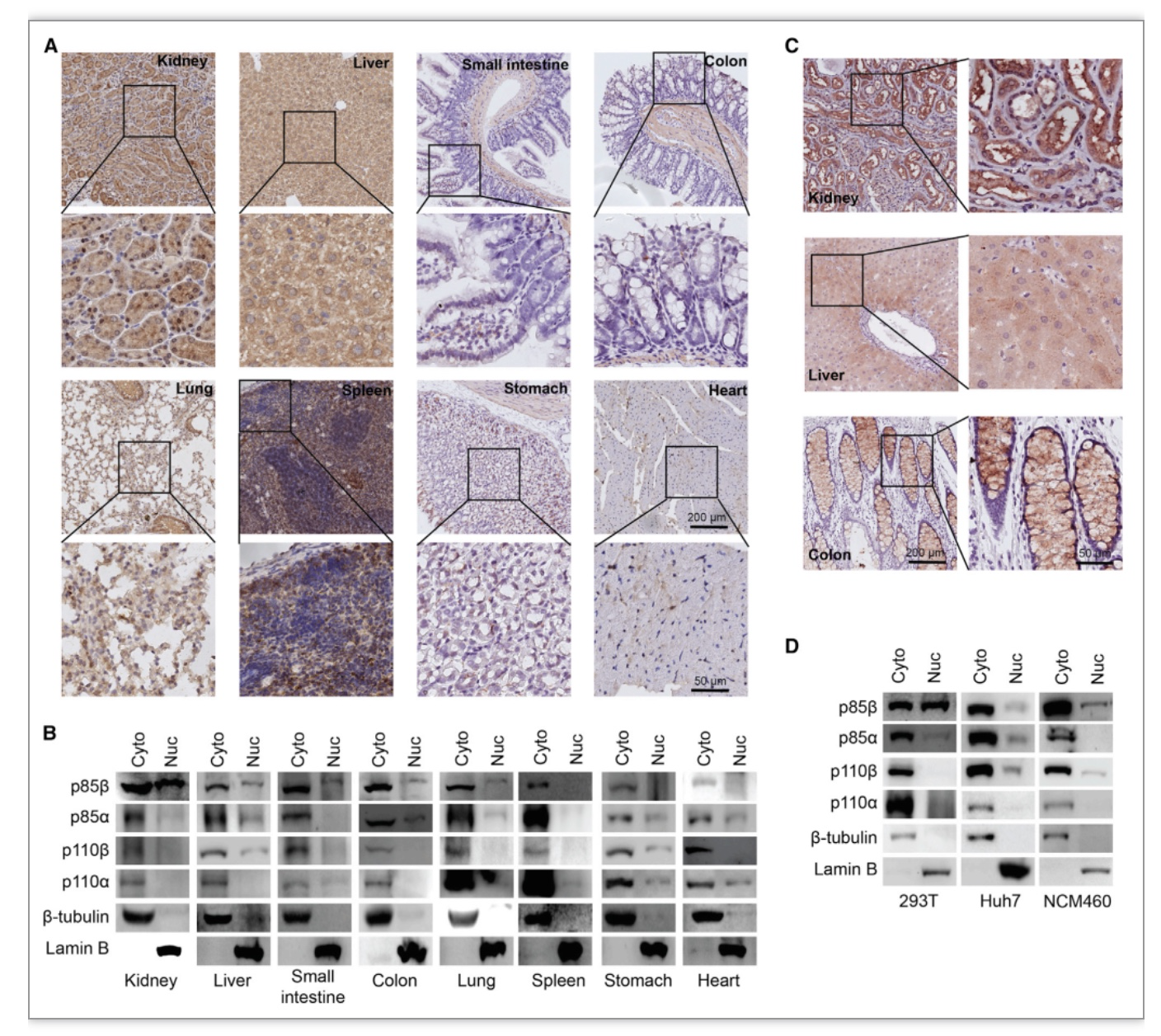
图1 一部分p85β在肾小管上皮细胞的细胞核中富集
(图源:Zhang Y, et al., Cell Reports, 2023)
为了探究p85β如何转移到肾脏细胞的细胞核中,作者首先利用Pull down 实验通过分别外源导入Myc-KPNA1或Myc-KPNA2与FLAG-p85β,发现KPNA1与p85β之间有较强的相互作用(图2)。然后在786-O和Caki-1中通过Co-IP进一步验证验证p85β和KPNA1之间的相互作用。此外,敲低KPNA1显著减少了细胞核内的p85β。这些数据表明细胞内p85β主要是通过与KPNA1结合而进入到细胞核内。接着作者通过突变p85β氨基酸序列中NLS附近的酪氨酸位点及Co-IP发现了p85β Y464F位点突变的质粒表达的蛋白与KPNA1的结合明显减弱。同时随后的免疫荧光,IHC, Western blot证实Y464位点磷酸化的p85β主要定位于细胞核内。这些结果显示p85β Y464位点的磷酸化促进p85β与KPNA1的结合及p85β的入核。
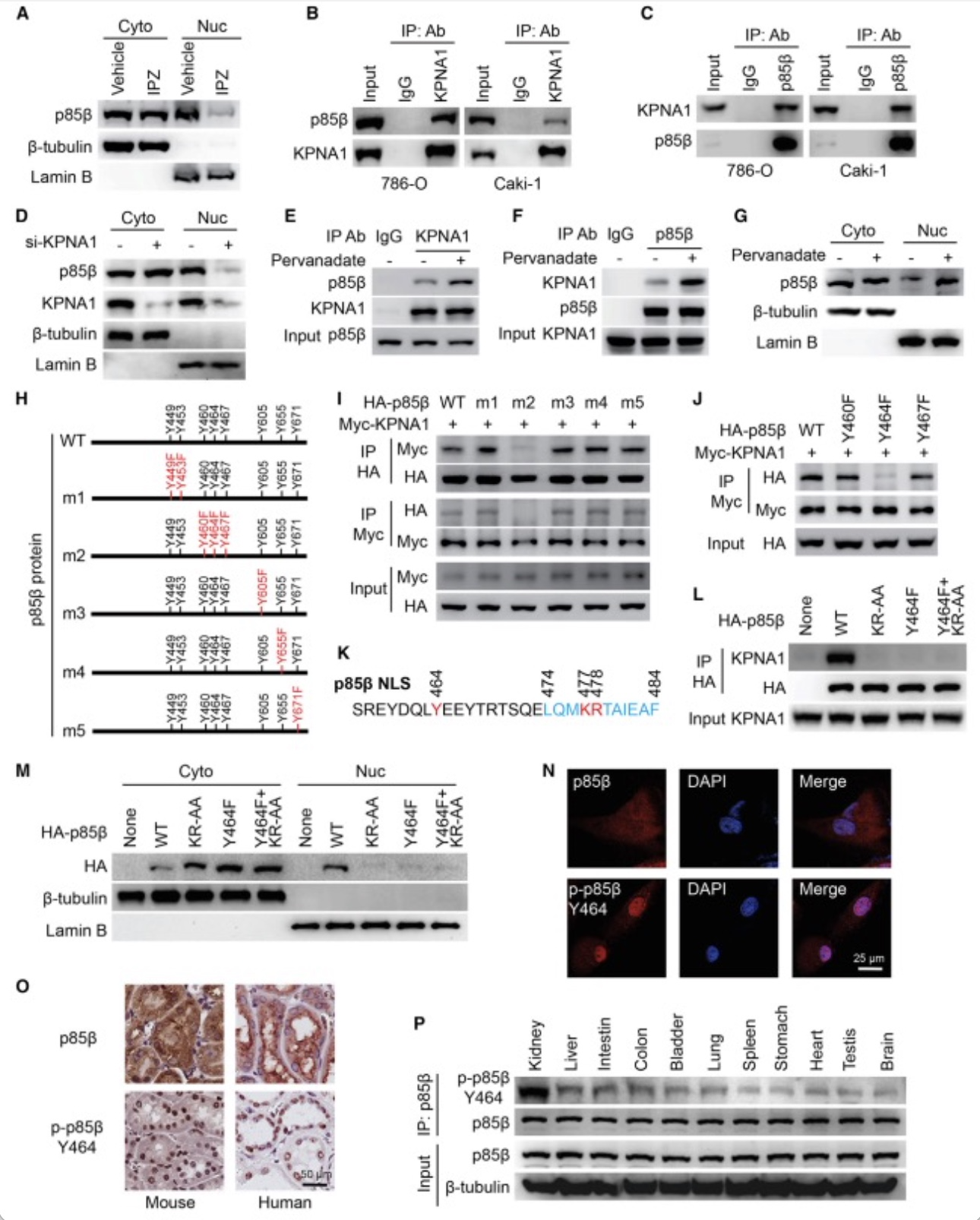
图2 p85β Y464位点的磷酸化促进p85β与KPNA1的结合及p85β进入细胞核
(图源:Zhang Y, et al., Cell Reports, 2023)
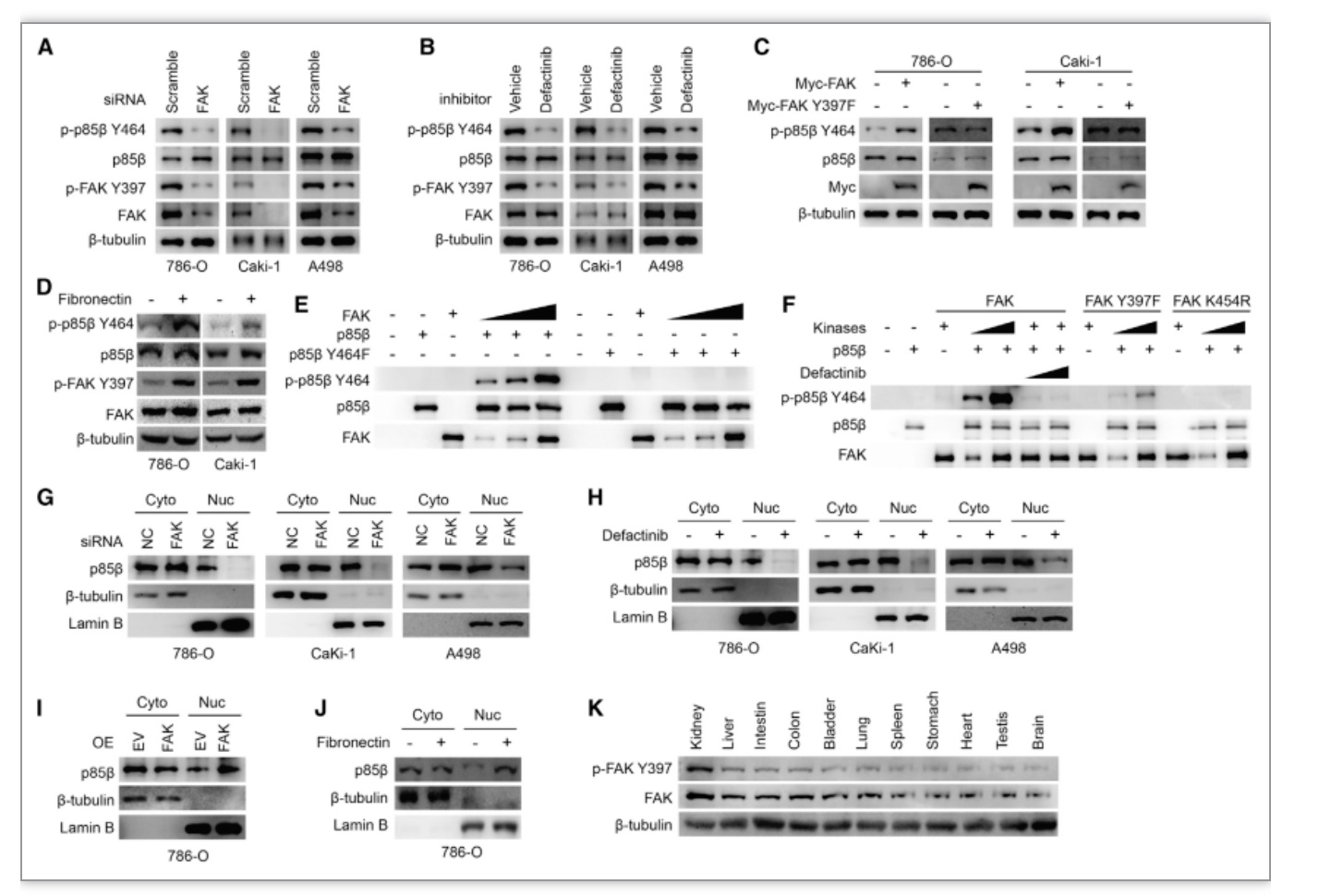
图3 FAK通过磷酸化p85β Y464位点从而调控p85β核转位
(图源:Zhang Y, et al., Cell Reports, 2023)
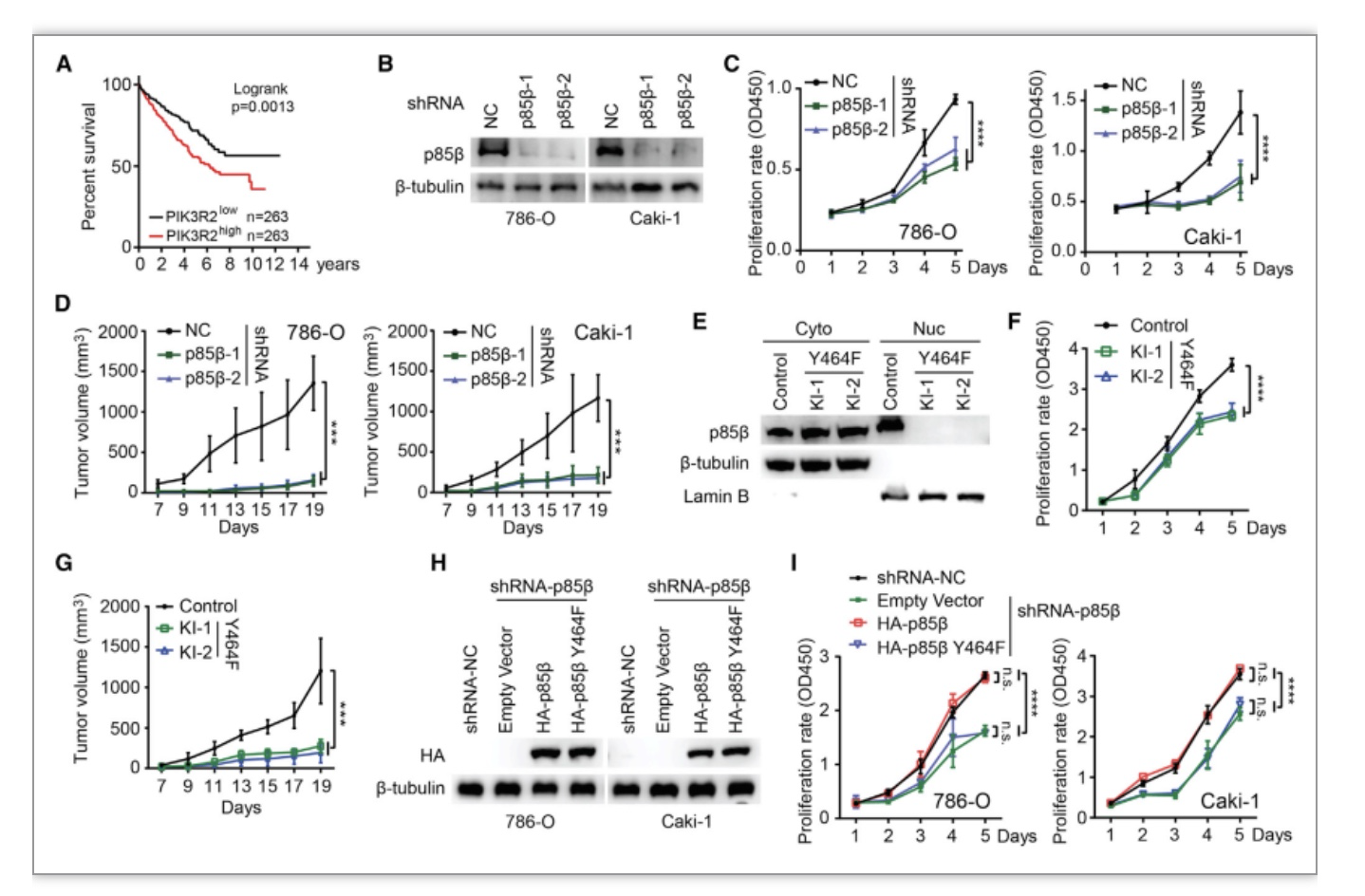
图4 核定位的p85β促进了肾癌细胞的增殖
(图源:Zhang Y, et al., Cell Reports, 2023)
接下来作者为了阐释核p85β如何促进ccRCC中的肿瘤发生,通过流式细胞术发现阻断p85β的细胞核定位会促使细胞周期阻滞在G1期,同时过表达p85β Y464F质粒(表达不具有细胞核定位的p85β)不能回复敲低p85β引起的细胞周期G1期阻滞,说明不是细胞质定位而是细胞核定位的p85β促进了肾癌细胞的细胞周期从G1期向S期转化(图5)。进一步研究发现p85β的低表达能过够显著提高RB1的mRNA水平和蛋白水平,同时RB1的敲低能够回补p85β敲低造成的细胞周期的停滞及体外生长的影响。这些结果说明细胞核定位的p85β是通过下调RB1的转录而影响细胞周期。
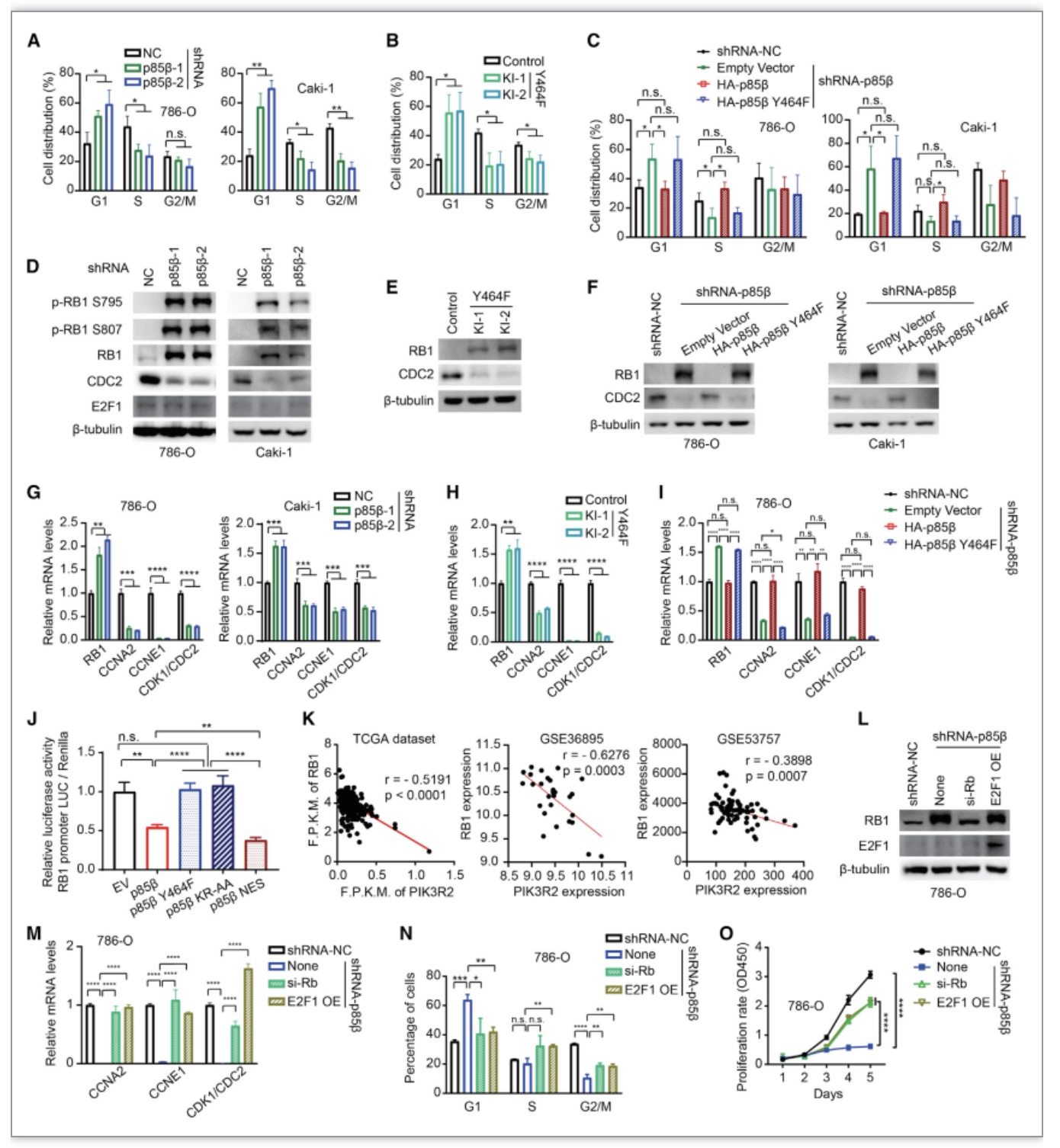
图5 核定位的p85β抑制RB1的表达而影响细胞周期
(图源:Zhang Y, et al., Cell Reports, 2023)
为了进一步探究p85β如何调控RB1的表达,基于前期的研究,作者推测细胞核定位的p85β可能通过H3K27me3这一途径抑制RB1的转录。为验证这一猜想,作者首先在肾癌细胞中敲低p85β,细胞内EZH1、EZH2和H3K27me3的蛋白水平明显降低,同时在p85β敲除细胞中过表达全长p85β可以提高EZH1/2和H3K27me3水平,但是过表达 p85β Y464F突变蛋白(不入核)对EZH1/2和H3K27me3水平没有影响(图6)。进一步研究发现无论是敲低EZH1还是敲低EZH2均可以明显降低细胞内H3K27me3和CDC2的水平并增加RB1的水平,同时引起细胞周期G1期阻滞,抑制细胞的增殖。同时作者在敲降p85β肾癌细胞中过表达EZH1/2能完全回补敲低p85β引起的细胞增殖抑制,这些结果显示核p85β通过稳定EZH1/2抑制RB1表达。
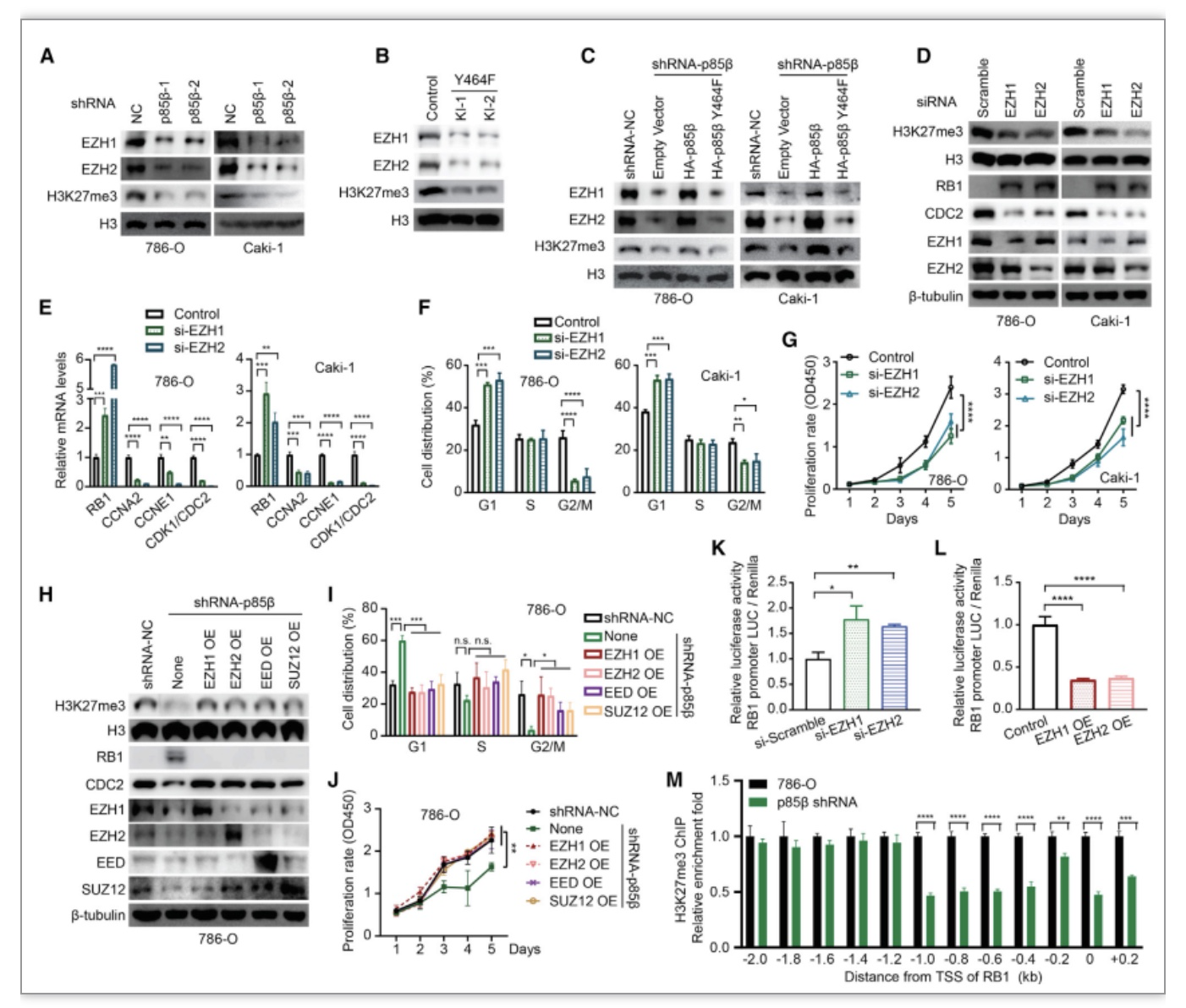
图6 核定位的p85β通过稳定EZH1/2抑制RB1表达
(图源:Zhang Y, et al., Cell Reports, 2023)
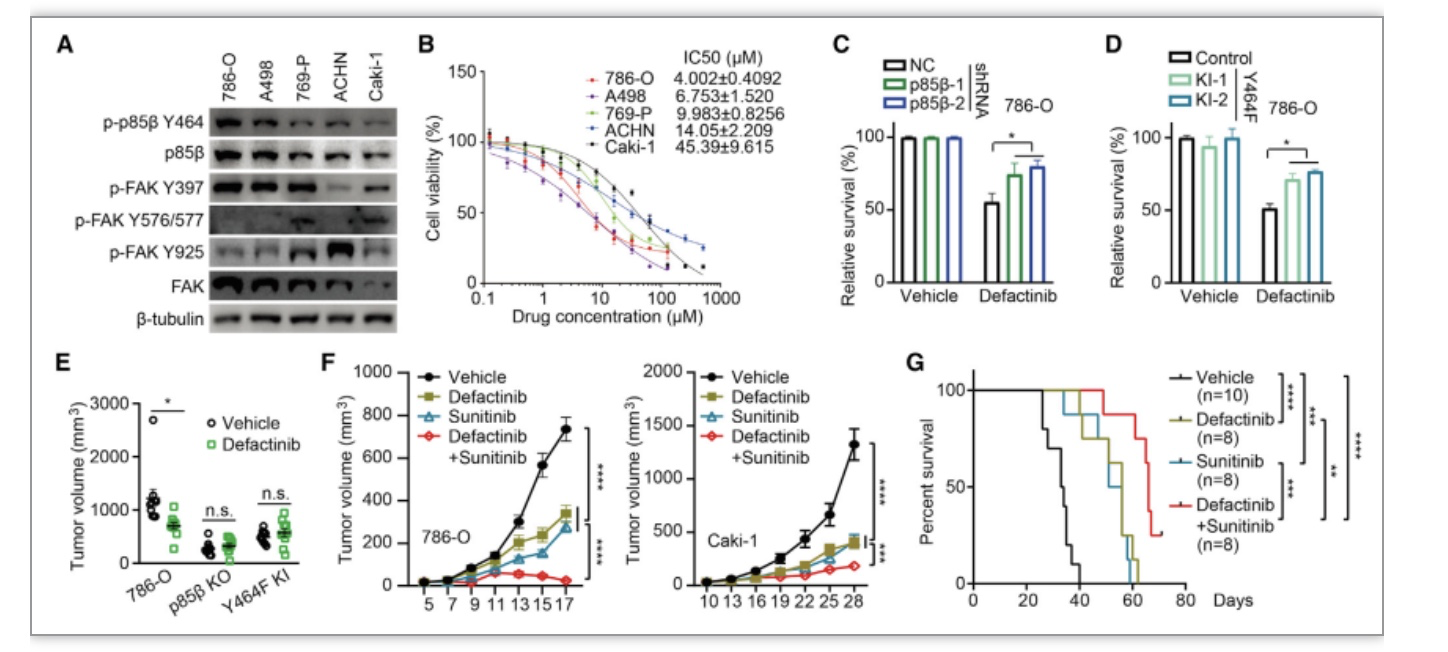
图7 FAK抑制能够通过降低p85β Y464磷酸化阻断p85β核易位从而有效抑制ccRCC肿瘤的生长
(图源:Zhang Y, et al., Cell Reports, 2023)
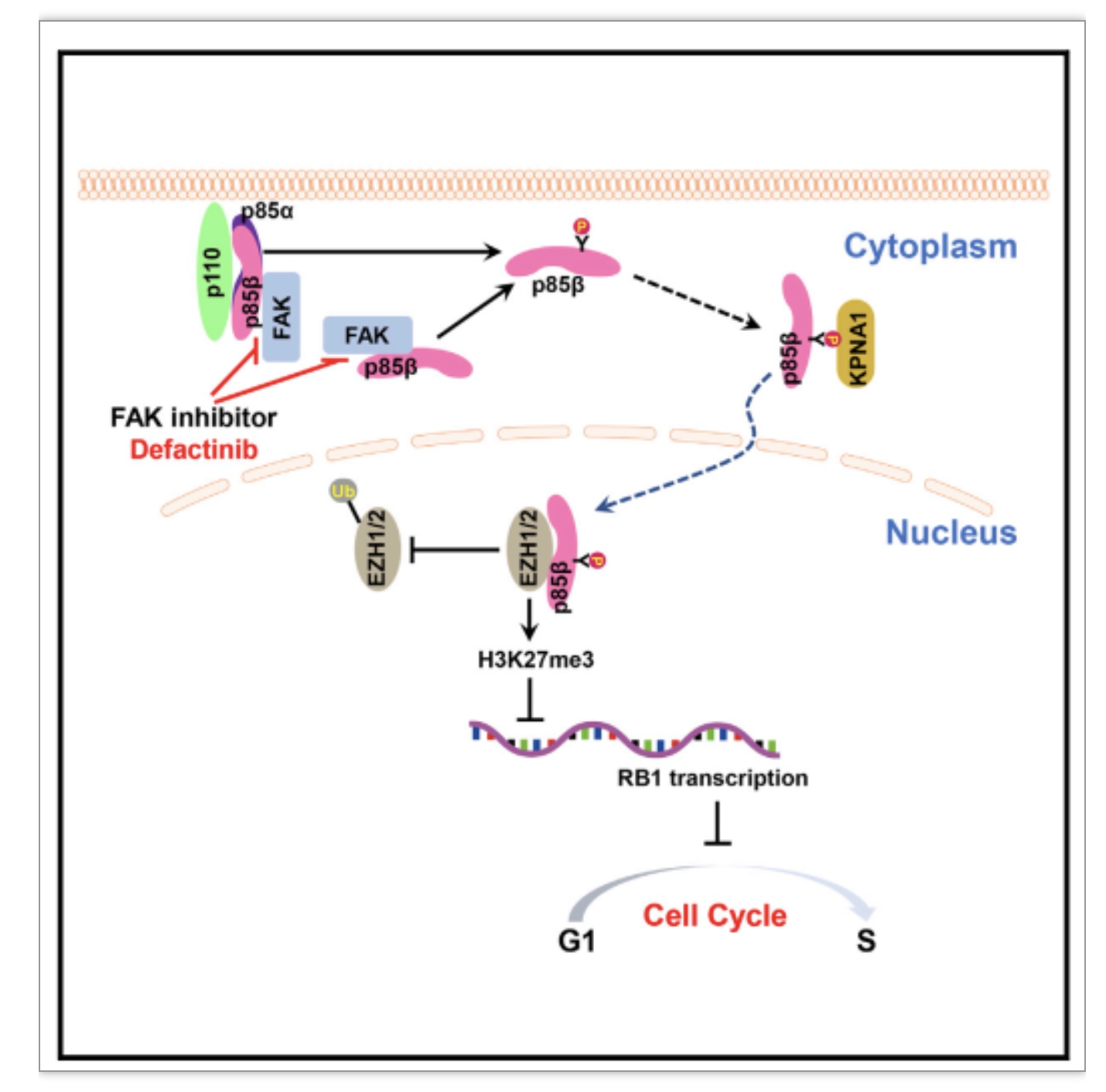
图8 机制图
(图源:Zhang Y, et al., Cell Reports, 2023)
综上所述,该研究首次描述了在肾透明细胞癌中PI3K复合体的调节亚基p85β通过细胞核定位而发挥促癌作用。该研究发现激酶FAK磷酸化p85β的Y464位点,促进p85β通过与KPNA1结合而进入细胞核,细胞核定位的p85β与EZH1、EZH2结合而增加它们的蛋白稳定性并提高H3K27me3的水平,抑制RB1基因的转录并促进细胞周期从G1期向S期转化,从而促进肾癌细胞的增殖和肿瘤的生长。此外,研究也表明肾癌细胞或肿瘤对FAK抑制剂的敏感性依赖于p85β Y464位点的磷酸化水平,FAK抑制剂与舒尼替尼具有协同抑制肿瘤生长的作用,为今后治疗肾透明细胞癌的病人提供了新的可能治疗策略。

