新冠病毒在世界范围内的大规模爆发流行,给人类的医疗、经济、生活带来了巨大冲击。目前,新冠病毒已在全球感染达6.8亿人,并致约7百万人死亡。由于新冠病毒频繁的变异,接种疫苗产生的中和抗体水平下降,导致其屡屡突破机体免疫防线,使得疫苗的保护效果被大大削弱。此外,新冠病毒感染对有基础代谢病史的个体尤其危险;例如,糖尿病和肥胖患者感染新冠病毒常引起重症甚至死亡[1],而部分新冠病毒感染患者又能产生胰岛素耐受,进一步导致糖尿病等代谢紊乱并发症[2,3]。目前,针对有基础代谢病患者的候选药物较少,临床上迫切需要开发能够同时缓解过度炎症反应和高血糖的干预措施。
丙酮酸是糖酵解的最终产物,可以在细胞质中还原为乳酸,也可以通过线粒体丙酮酸载体(MPC)进入线粒体,作为线粒体氧化代谢的燃料。糖酵解在巨噬细胞活化和炎症反应中起着关键作用[4]。此外,MPC介导的丙酮酸代谢在2型糖尿病的病理生理过程中发挥了重要作用[5,6]。然而,三羧酸(TCA)循环中丙酮酸氧化对巨噬细胞功能和炎症的贡献有待探究,是否参与调控呼吸道病毒感染尚不清楚。报道了第二代胰岛素增敏剂MSDC-0602K通过抑制MPC功能调控巨噬细胞介导的炎症反应,同时促进宿主代谢稳态,从而降低了野生型和肥胖小鼠感染流感病毒或新冠病毒后宿主发病率和死亡率。

首先,研究人员发现髓系免疫细胞MPC缺失小鼠对流感病毒和新冠病毒感染有更强的抵抗力。进一步,利用MPC抑制剂MSDC-0602K(MSDC,第二代噻唑烷二酮)处理流感病毒或新冠病毒感染小鼠,肺部炎症显著下调,小鼠存活率增加(图1)。
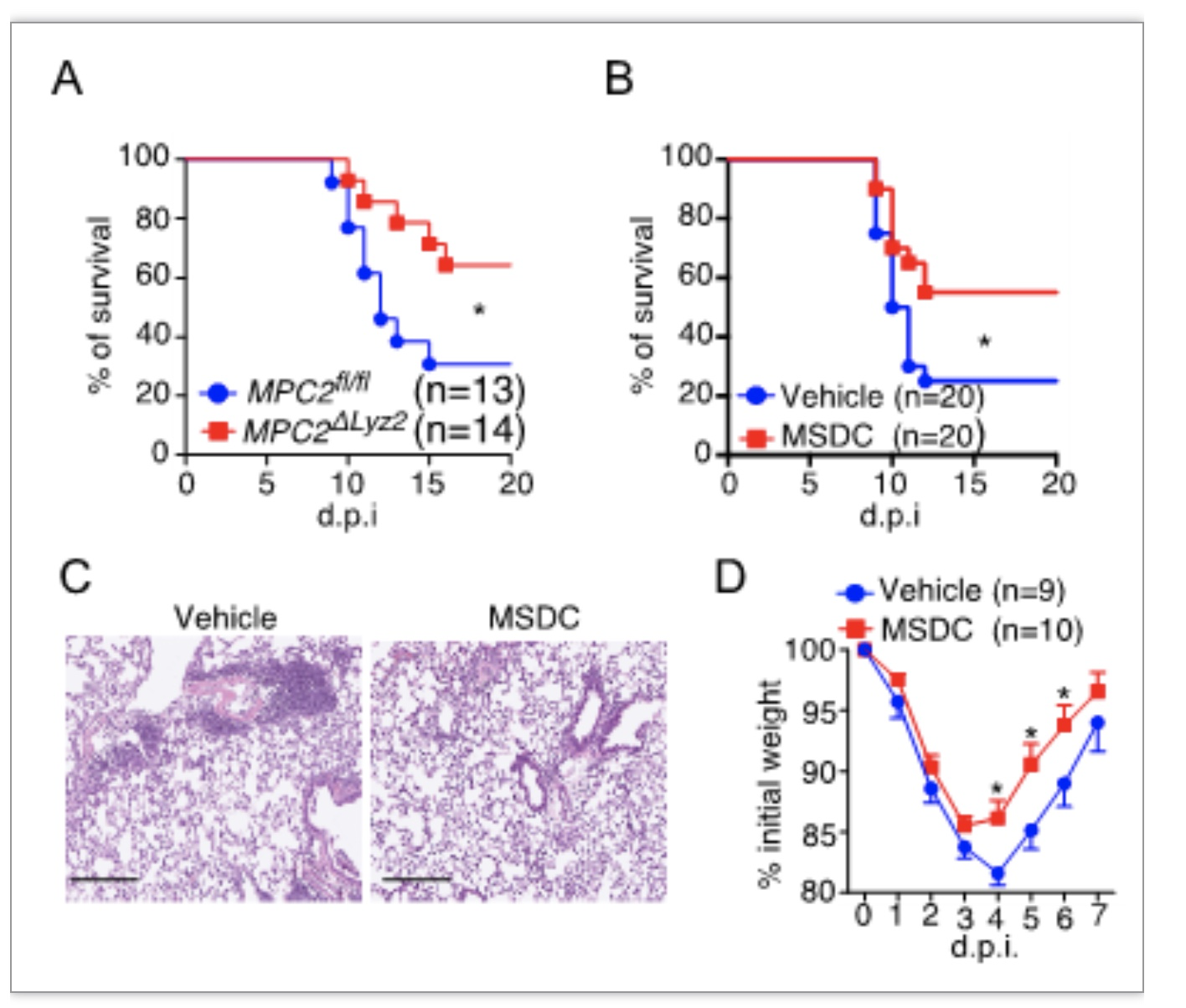
图1. 丙酮酸代谢促进呼吸道病毒致病
(图源:Zhu, B., et al., Science immunology, 2023)
为了进一步探讨MPC介导丙酮酸代谢调控呼吸道病毒感染的深层机制,研究人员利用单细胞测序分析了流感病毒感染肺组织细胞数量和功能的变化;结果表明,MSDC处理的小鼠肺泡巨噬细胞炎症反应显著下调,并通过一系列实验证实肺泡巨噬细胞是MSDC的靶细胞(图2)。

图2. MSDC调控肺泡巨噬细胞炎症反应
(图源:Zhu, B., et al., Science immunology, 2023)
进一步分子机制表明,MPC抑制剂MSDC增强了线粒体适应性;降低TCA循环中succinate的水平,从而影响HIF-1a的稳定性, 导致小鼠和人肺泡巨噬细胞炎症反应减弱(图3)。
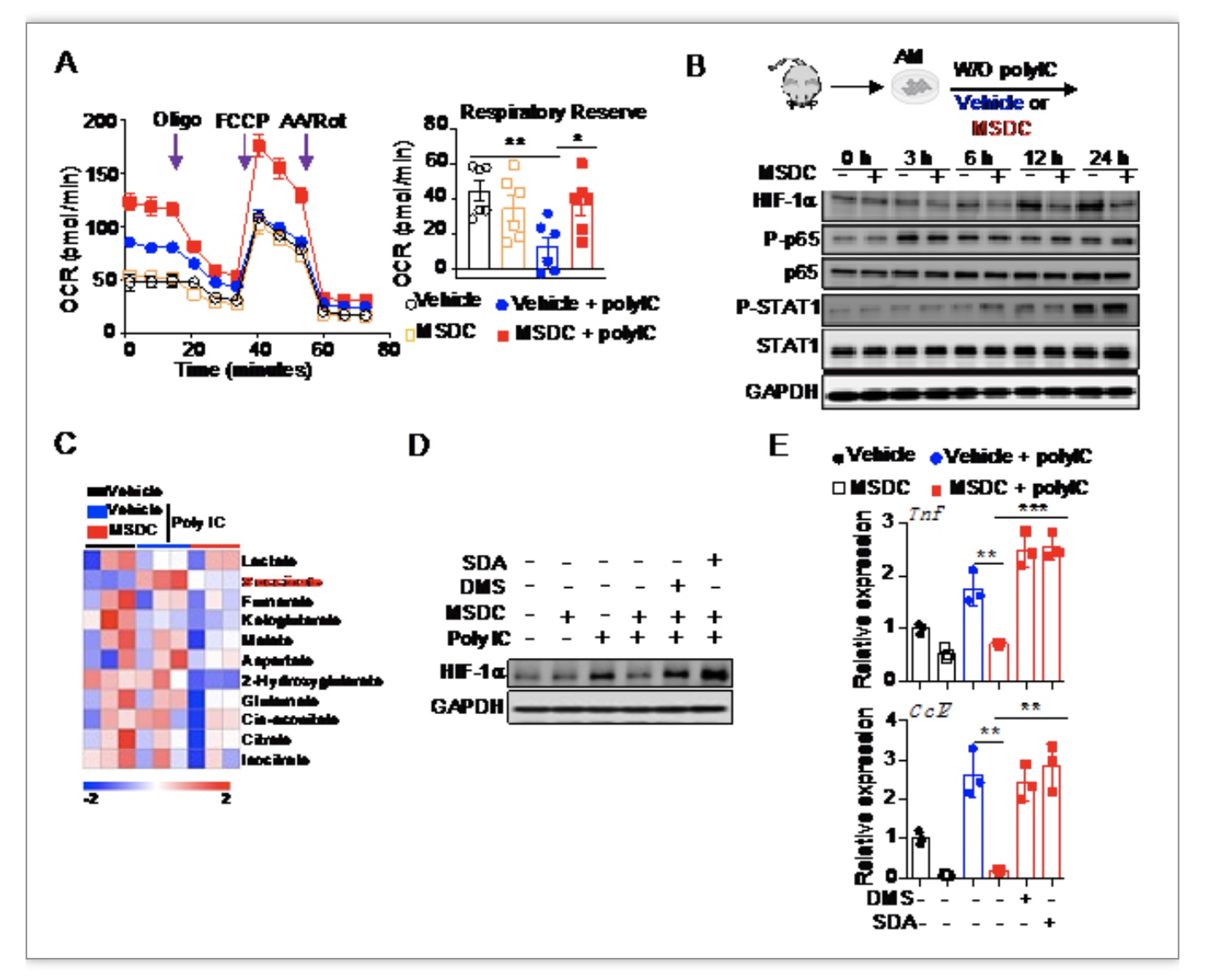
图3. MSDC调控巨噬细胞HIF-1a水平
(图源:Zhu, B., et al., Science immunology, 2023)
此外,MSDC治疗流感病毒或新冠病毒感染的肥胖小鼠可抑制呼吸道炎症,促进肺组织恢复,同时降低肥胖小鼠的血糖水平和高血脂,从而降低了肥胖小鼠死亡率。MSDC与nirmatrelvir(奈玛特韦片,PAXLOVID的抗病毒成分)协同作用,显著降低新冠病毒感染肥胖小鼠的死亡率和肺组织损伤。在体外,新冠病毒感染人肺泡巨噬细胞后,炎症反应相关基因上调,MSDC处理后,这些基因表达水平受到抑制(图4)。因此,MSDC可以作为有基础代谢病患者防治新冠肺炎的靶点。
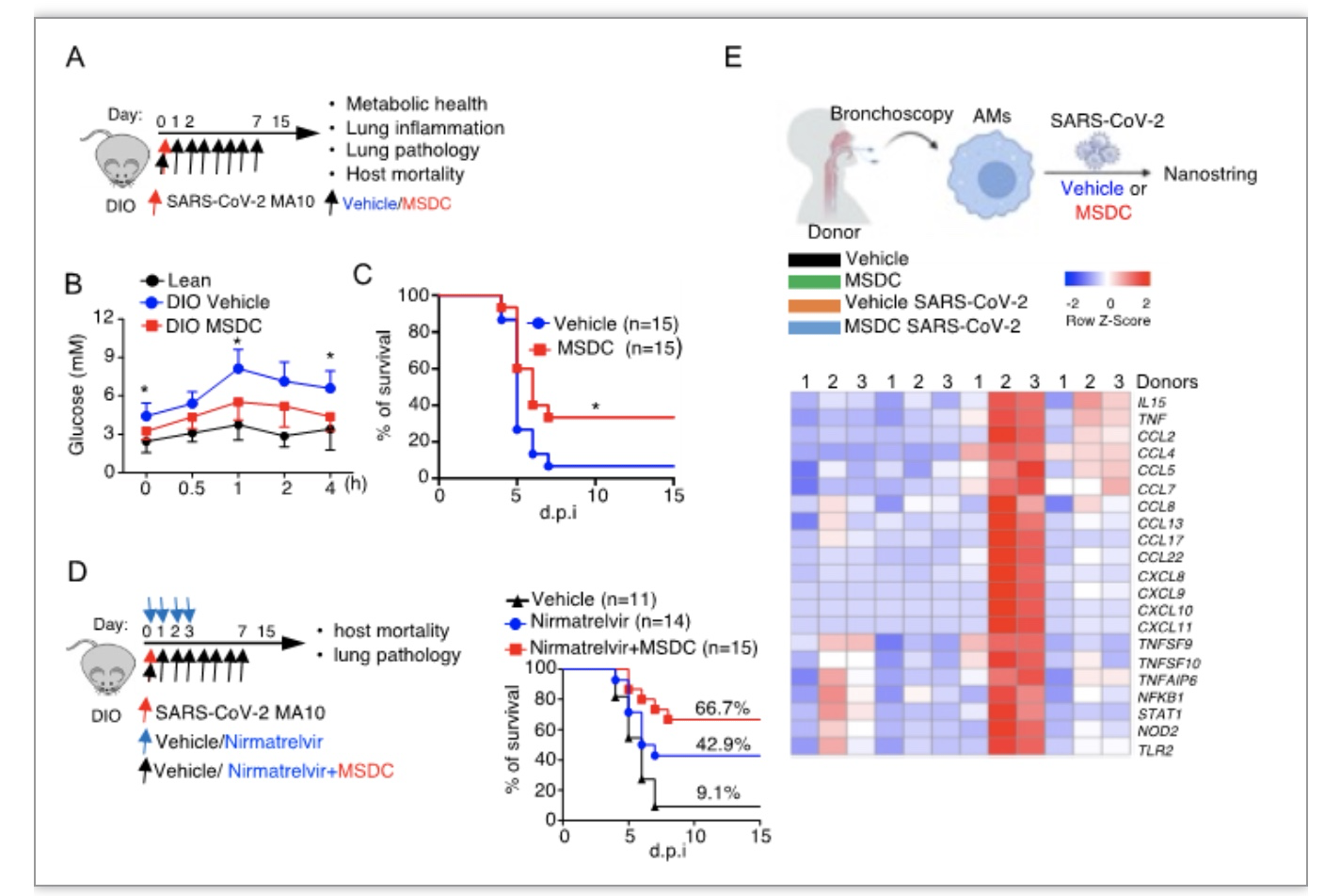
图4. MSDC促进肥胖小鼠抵抗呼吸道病毒感染
(图源:Zhu, B., et al., Science immunology, 2023)
综上所述,该研究揭示了MPC介导丙酮酸代谢调控呼吸道病毒感染引起的肺组织驻留巨噬细胞炎症反应的分子机制;通过靶向巨噬细胞丙酮酸代谢,抑制宿主炎症反应并促进组织修复。在新冠病毒感染肥胖小鼠模型中,MPC抑制剂同时降低血糖浓度和肺组织炎症反应,可为有基础代谢病患者防治新冠肺炎提供新的靶点,具有重要的转化潜力。值得注意的是,高血糖本身使宿主在病毒感染(包括SARS-CoV-2)后易患严重的疾病,但是,上述研究没有评估高血糖或巨噬细胞炎症反应在肥胖个体内驱动呼吸道病毒感染严重程度的相对贡献,未来可以在MPC缺失的肥胖小鼠体内探索这一科学问题。

