绝经后骨质疏松症是一种内分泌代谢性疾病,其特征是骨量减少和脆性骨折风险增加,尤其是椎骨和髋部骨折[1]。绝经后骨质疏松症主要由破骨细胞(OCs)过度活化引起骨吸收增加引起,抑制OCs的形成和再吸收功能是治疗骨质疏松症的主要策略之一[2]。在破骨细胞分化过程中,RAN KL信号通路和IRE1介导的非折叠蛋白反应起重要作用[3, 4]。IRE1同时具有激酶和核糖核酸内切酶活性。IRE1激酶活性可以激活JNK信号通路[5],而其核酸内切酶活性通过IRE1的自磷酸化(p-IRE1)而增强,p-IRE1进一步调控内质网应激过程中的非折叠蛋白反应[6, 7]。据报道,IRE1通路可促进NFATc1的转录,从而促进OC分化,敲除p-IRE1则可影响OC分化和功能[3]。然而,IRE1的激活如何受OC分化的RANK信号通路调控目前仍不清楚。
Cytohesins属于一类鸟嘌呤核苷酸交换因子(GEFs),该因子激活小鸟嘌呤核苷酸结合蛋白ARF1和ARF6 [8]。Cytohesins家族中有4个成员(cytoheisn-1、cytohesin-2、cytohesin-3和cytohesin-4),它们参与广泛的生物学过程,如信号转导、细胞分化、细胞结构组织和存活[8]。但他们在OCs中的作用既往尚无研究报道。尽管已有报道ARF1调节OC的迁移、增殖和融合[9],但尚不清楚ARF1如何影响这些过程,以及哪种cytohesin负责控制OC中的ARF1活性。
“Blocking the cytohesin-2/ARF1 axis by SecinH3 ameliorates osteoclast-induced bone loss via attenuating JNK-mediated IRE1 endoribonuclease activity”的研究性论文,揭示Cytohesin-2/ARF1调控破骨细胞分化和影响骨质疏松发生发展的机制。

研究发现,分别敲降三个cytohesin后,只有cytohesin-2影响破骨细胞分化,采用Cytohesin-2抑制剂SecinH3以后也能够抑制破骨细胞分化,进一步采用过表达实验发现cytohesin-2通过激活下游ARF1来调控破骨细胞分化和功能。采用SecinH3处理后能够抑制破骨细胞吸收功能,并在体内缓解卵巢切除引起的骨量丢失(图1)。

图1 阻断Cytohesin-2/ARF1后抑制破骨细胞分化并缓解卵巢切除引起的骨量丢失
(图源: YM Dong et al., Pharmacol Res, 2022)
通过转录组测序和差异基因分析,KEGG和GSEA通路分析,研究者发现阻断Cytohesin-2/ARF1轴以后主要通过抑制MAPK通路发挥作用。MAPK是破骨细胞分化过程中的重要信号通路,其包含三条下游通路,即JNK,P38和Erk通路。研究者通过蛋白实验进一步证实阻断Cytohesin-2/ARF1轴以后主要通过抑制MAPK通路中的JNK分支来发挥作用。采用SecinH3和敲降Cytohesin-2均能显著抑制JNK通路激活 (图2)。
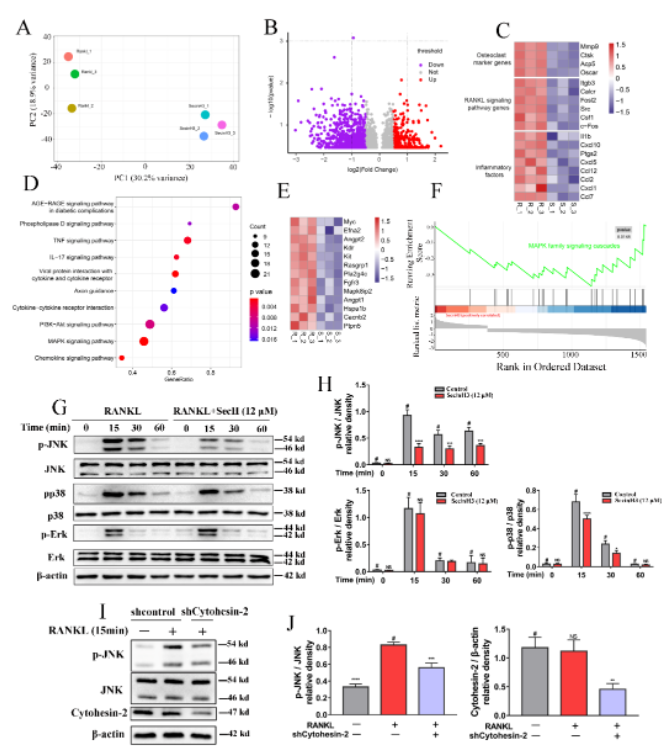
图2 转录组测序结合蛋白实验发现阻断Cytohesin-2/ARF1后显著抑制JNK通路的激活
(图源: YM Dong et al., Pharmacol Res, 2022)
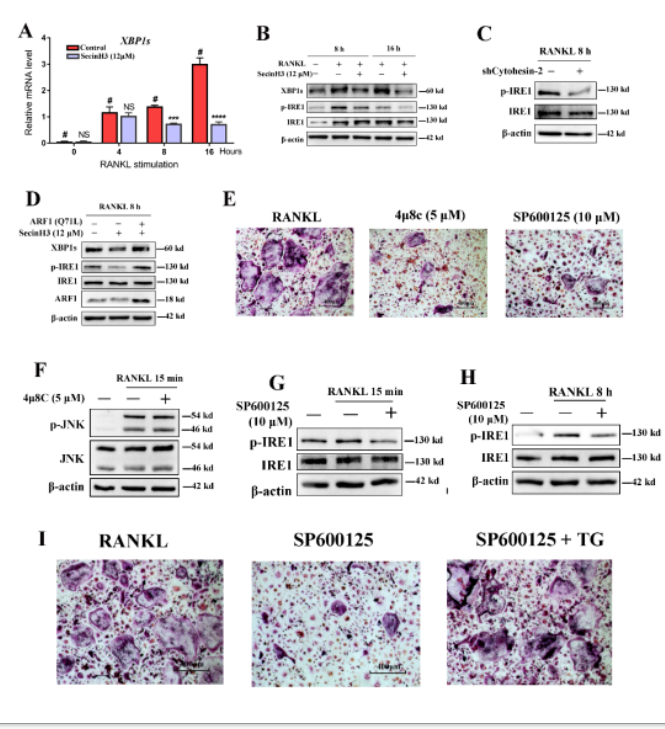
图3 阻断Cytohesin-2/ARF1后显著抑制JNK通路,进而抑制下游IRE1介导的非折叠蛋白反应
(图源: YM Dong et al., Pharmacol Res, 2022)
研究者进一步发现,阻断Cytohesin-2/ARF1轴以后能够抑制破骨细胞内质网应激过程中的非折叠蛋白反应;进而与JNK通路联系起来,发现JNK通路可以在上游调控IRE1的核酸内切酶活性,进而影响破骨细胞分化(图3)。JNK作为链接RANK和IRE1的中间分子,在破骨细胞RANK信号通路以及IRE1介导的内质网反应中发挥重要作用。而阻断Cytohesin-2/ARF1轴以后,能够抑制JNK介导的IRE1激活,并抑制破骨细胞激活(图4),从而为治疗破骨细胞过度活化引起的骨质疏松提供新的治疗方向。
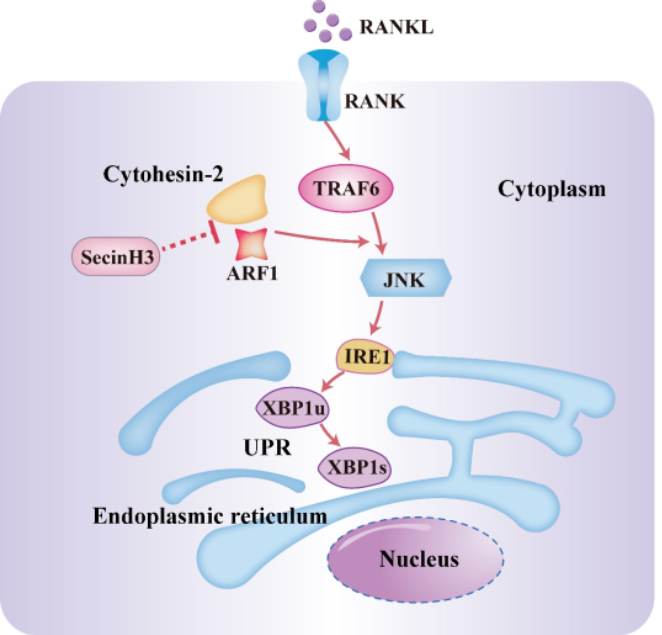
图4 机制示意图
(图源: YM Dong et al., Pharmacol Res, 2022)
IRE1同时具有激酶活性和核酸内切酶活性。既往一篇Science报道显示,IRE1的激酶活性可以在上游激活JNK通路,并介导一系列生物学过程[5]。本研究创新点在于发现JNK可以反过来,在上游调控IRE1的核酸内切酶活性,这为IRE1和JNK的调控关系提供了新的见解。同时也为以内质网应激和非折叠蛋白为靶点探索相关疾病的治疗提供的新的研究方向。本研究还有一个未解决的问题是,是否存在IRE1激酶活性激活JNK,随后JNK再反过来调控IRE1核酸内切酶活性,形成JNK介导的IRE1两种酶活性的调控环路?这一问题有待后进一步探索。

