结直肠癌(Colorectal cancer, CRC)是全球第二大常见恶性肿瘤,其发病率呈逐年上升趋势[1]。CRC患者初诊转移率高,转移后5年生存率低于20%[2]。近期研究表明,核因子IB (Nuclear factor IB, NFIB)在肿瘤中起重要作用[3,4,5]。课题组前期发现NFIB可以促进酸性环境下CRC细胞的增殖[6],而细胞增殖与能量代谢中心分子烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide, NAD+)密切相关[7,8]。课题组还发现NAD+主要合成途径(补救合成途径)中的关键限速酶-烟酰胺磷酸核糖基转移酶(Nicotinamide phosphoribosyl-transferase, NAMPT)在CRC中高表达,且与患者预后负相关[9]。然而,NFIB和NAD+合成在CRC中的调控机制仍有待阐明。因此,进一步揭示CRC中NFIB与NAD+代谢的分子机制,有望为CRC的治疗提供新的靶点。
该研究基于临床样本、细胞和小鼠模型,结合RNA-seq、ChIP-seq、代谢组测序、双荧光素酶报告基因检测以及空间转录组联合单细胞测序技术,证实了NFIB通过抑制miRNA-182-5p靶向并结合NAMPT促进NAD+合成,从而增强CRC细胞增殖。对深入认识NFIB如何调控结直肠癌NAD+代谢提供了新的理论依据。
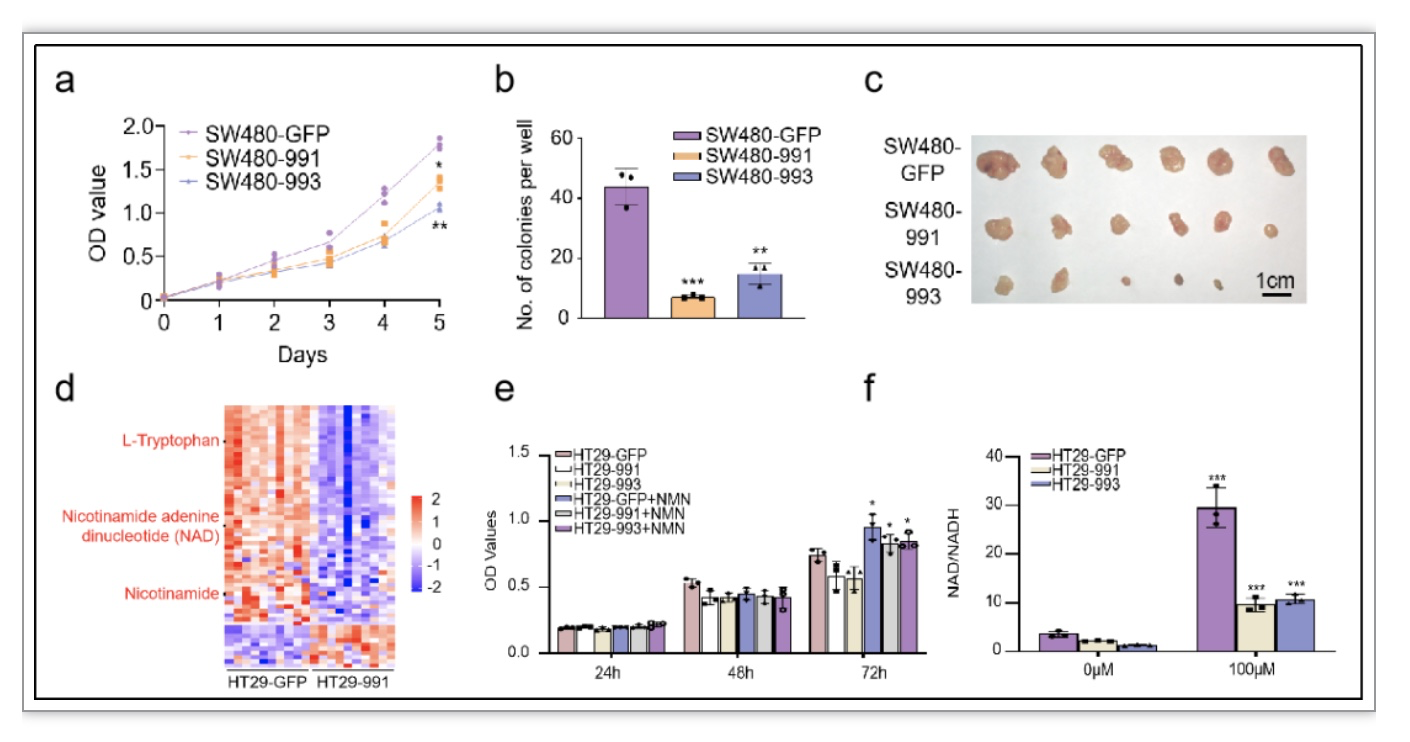
NFIB促进CRC细胞在体外和体内增殖(图1a-c)。代谢组测序结果显示敲低NFIB后CRC细胞的NAD+代谢组表达降低,体外检测敲低NFIB后细胞NAD+水平也显著降低,而添加NAD+前体NMN可以部分恢复细胞NAD+水平和增殖能力(图1d-f)。表明NFIB通过影响NAD+的产生促进CRC细胞增殖。
图1. NFIB在体内和体外对CRC细胞增殖能力和NAD+代谢的影响
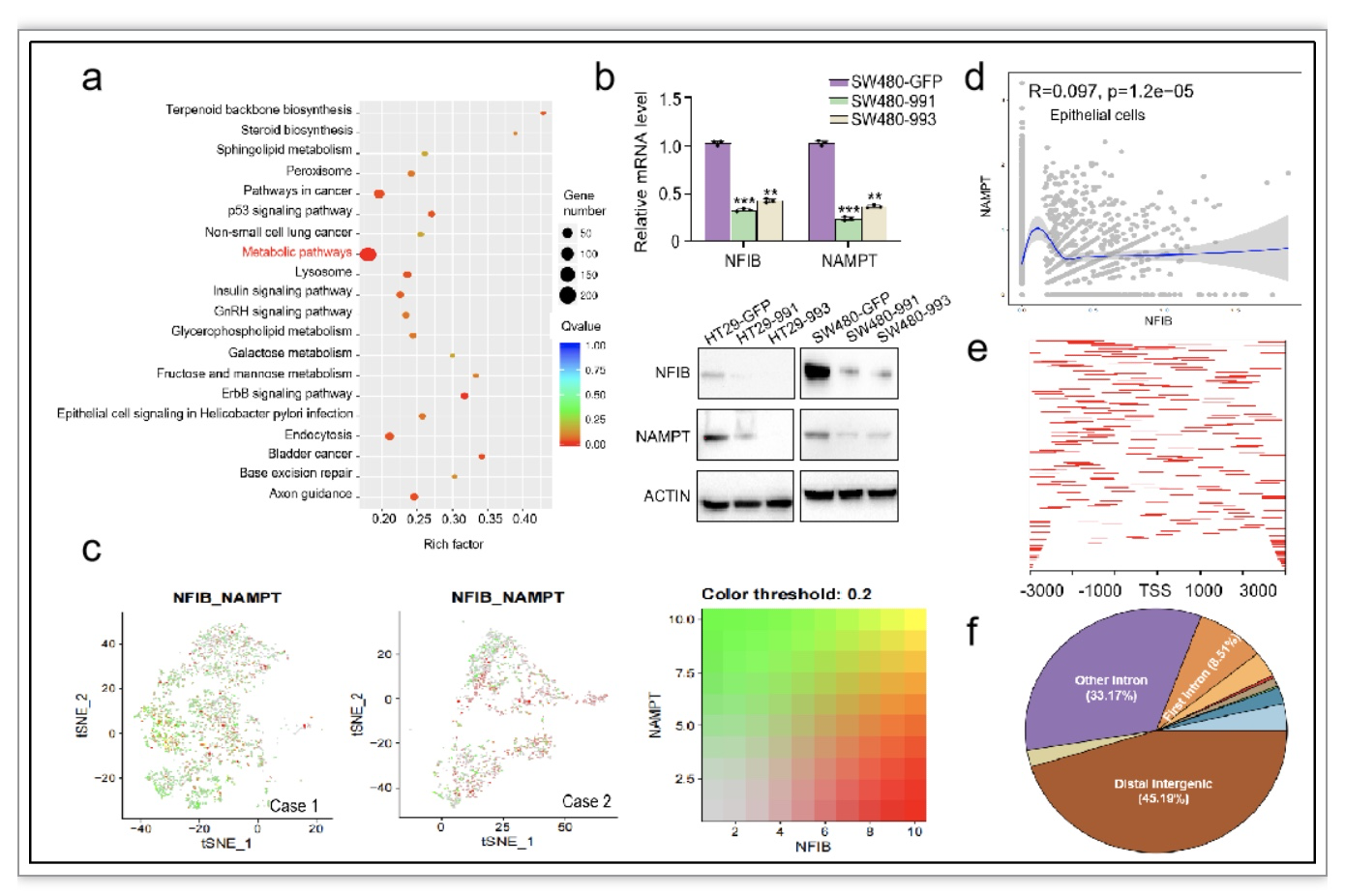
转录组测序结果显示敲低NFIB后CRC细胞的差异基因在代谢通路中富集(图2a)。体外实验证实NFIB可以促进NAMPT的表达(图2b)。临床样本空间转录组和单细胞测序结果显示在CRC组织中NFIB与NAMPT表达正相关(图2c, d)。结合ChIP-seq结果提示NFIB可能通过非直接转录结合的方式对NAMPT进行调控(图2e, f)。
图2. NFIB在CRC中上调NAD+补救合成途径关键限速酶NAMPT
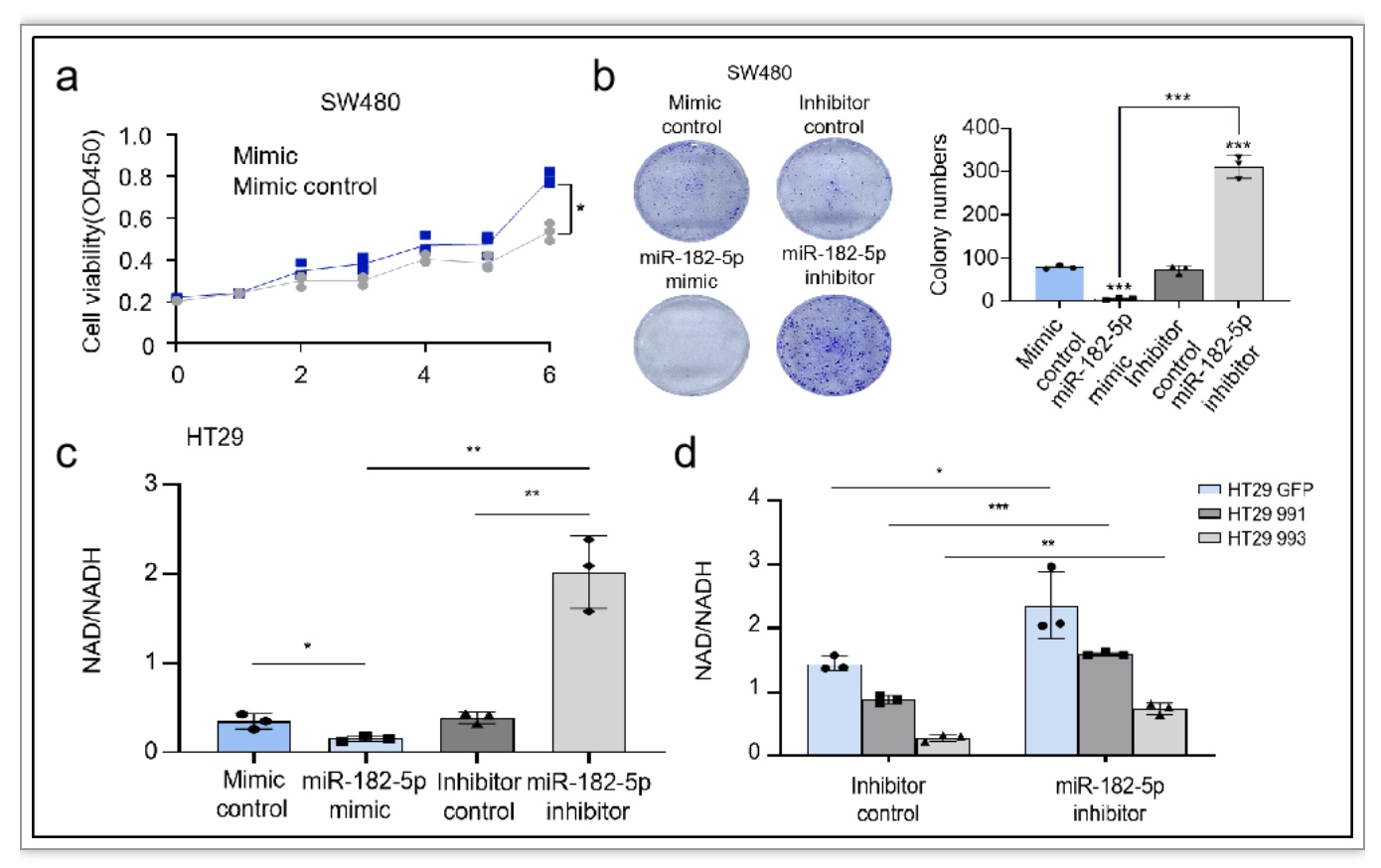
通过miRNA-seq检测CRC中miRNA的表达情况后发现,敲低NFIB后部分miRNA表达上调,其中miRNA-182-5p上调显著(图3a, b)。利用TargetScan、miRDB和PolymiRTS数据库分析得出miRNA-182-5p与NAMPT存在直接结合位点(图3c)。体外抑制和过表达miRNA-182-5p以及结合双荧光素酶报告基因检测后发现NFIB通过下调miRNA-182-5p介导的转录后调控,促进NAMPT表达(图3d-f)。miRNA-182-5p通过阻碍结直肠癌NAD+合成而抑制CRC细胞增殖(图4a-d)。
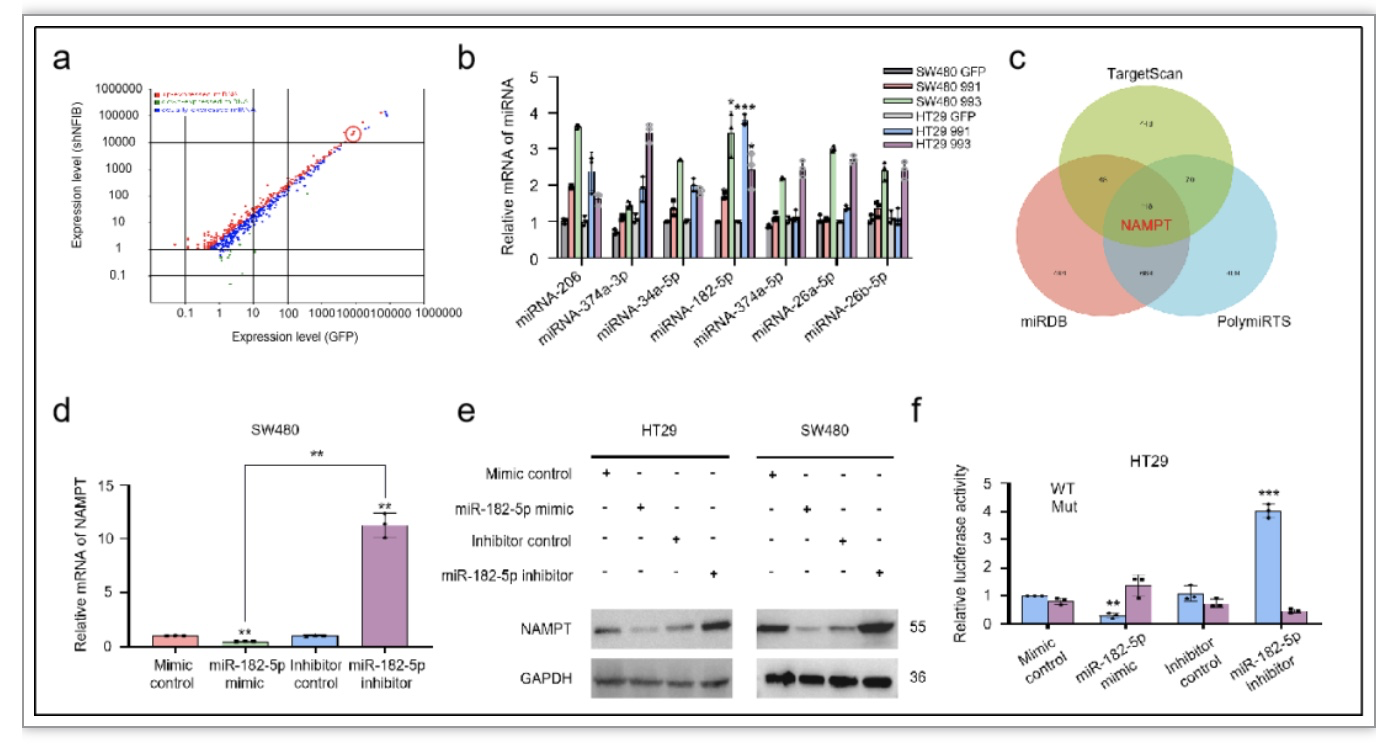
图3. NFIB下调miRNA-182-5p介导的NAMPT转录后调控
图4. miRNA-182-5p抑制结直肠癌NAD+合成和细胞增殖
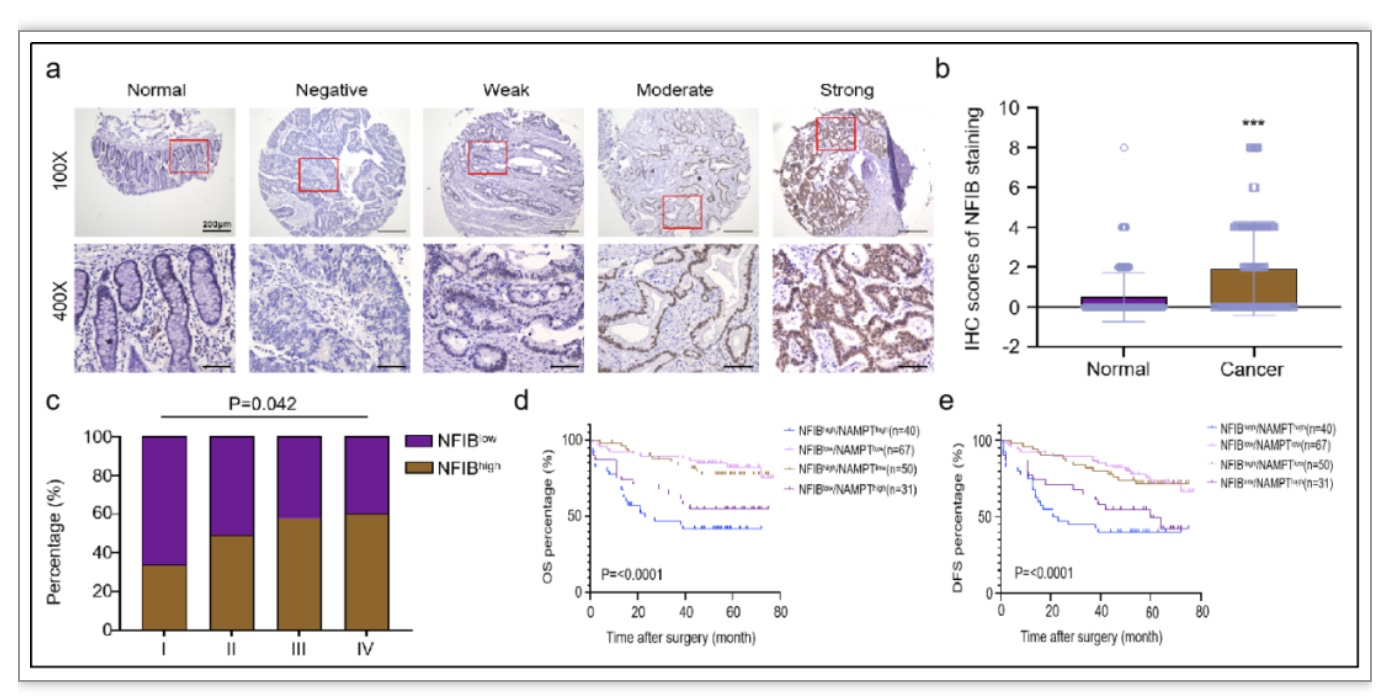
临床大宗样本免疫组织化学染色显示NFIB在CRC组织中高表达,并随着分期靠后高表达NFIB的比例逐渐增高(图5a-c)。生存分析结果显示NFIB和NAMPT同时高表达时CRC患者的预后最差(图5d, e)。
图5. NFIB和NAMPT高表达与CRC患者TNM分期及预后不良相关
综上所述,该研究基于体内外实验首次发现并提出NFIB通过增加细胞内NAD+水平促进结直肠癌生长。同时结合多项测序技术探索NFIB调控NAD+合成的分子机制,揭示出NFIB通过下调miRNA-182-5p介导的转录后调控,促进NAD+补救合成途径限速酶NAMPT的表达,从而增加CRC细胞内NAD+水平并促进细胞增殖,为结直肠癌的基础研究与临床治疗靶点提供了新思路。该研究同时检测了临床样本中NFIB与NAMPT的表达关系,通过空间转录组和单细胞测序技术从空间组学和单细胞层面对NFIB和NAMPT在CRC中的关系进行了剖析,并通过生存分析为临床CRC患者的预后判断提供了新依据。此外,由于NFIB对靶基因的调控方式存在多样性,且合成NAD+的代谢途径不仅限于补救合成途径,故后续需要进一步探究NFIB在CRC中调控下游基因和细胞代谢的方式和机制。