
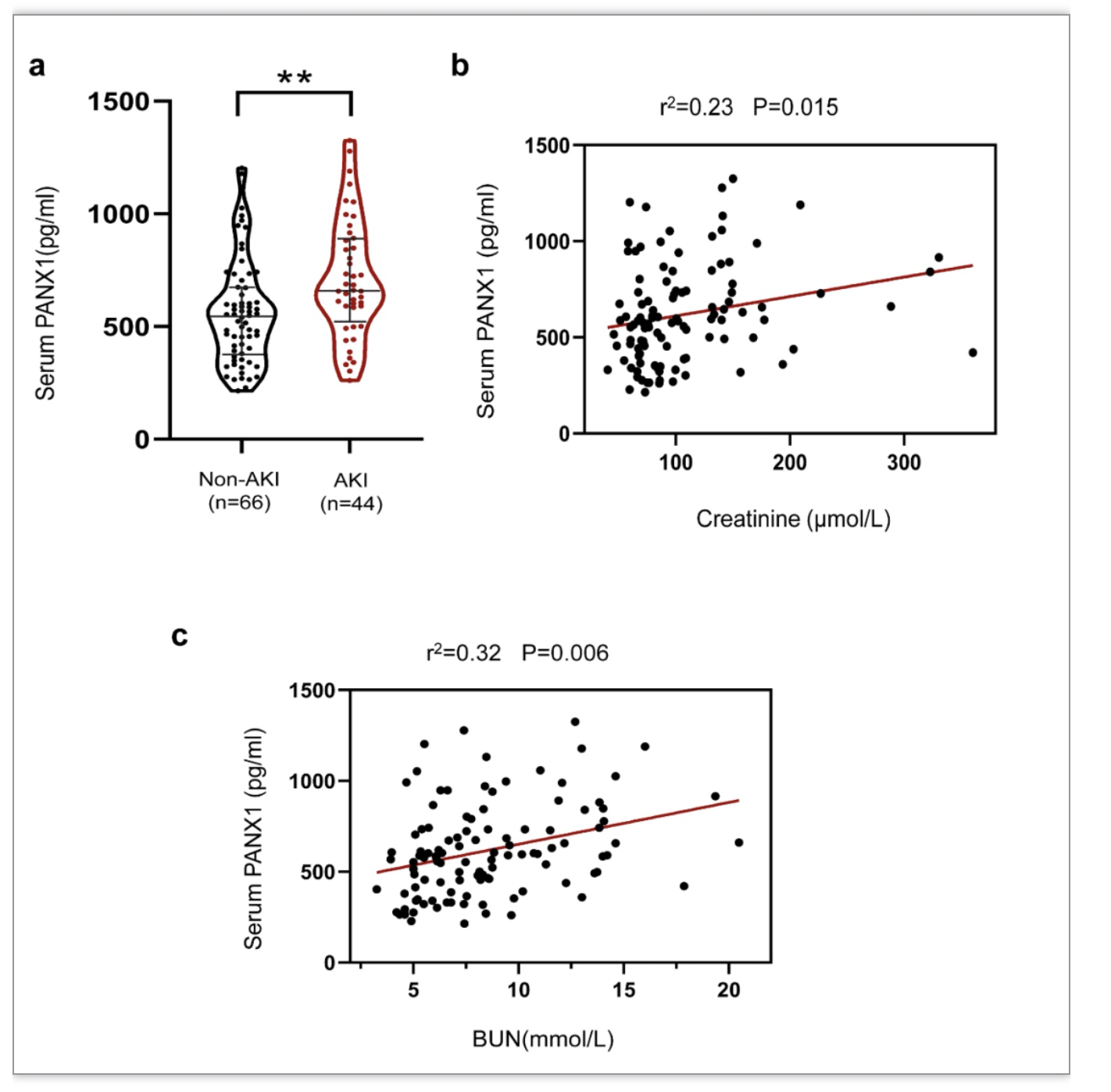
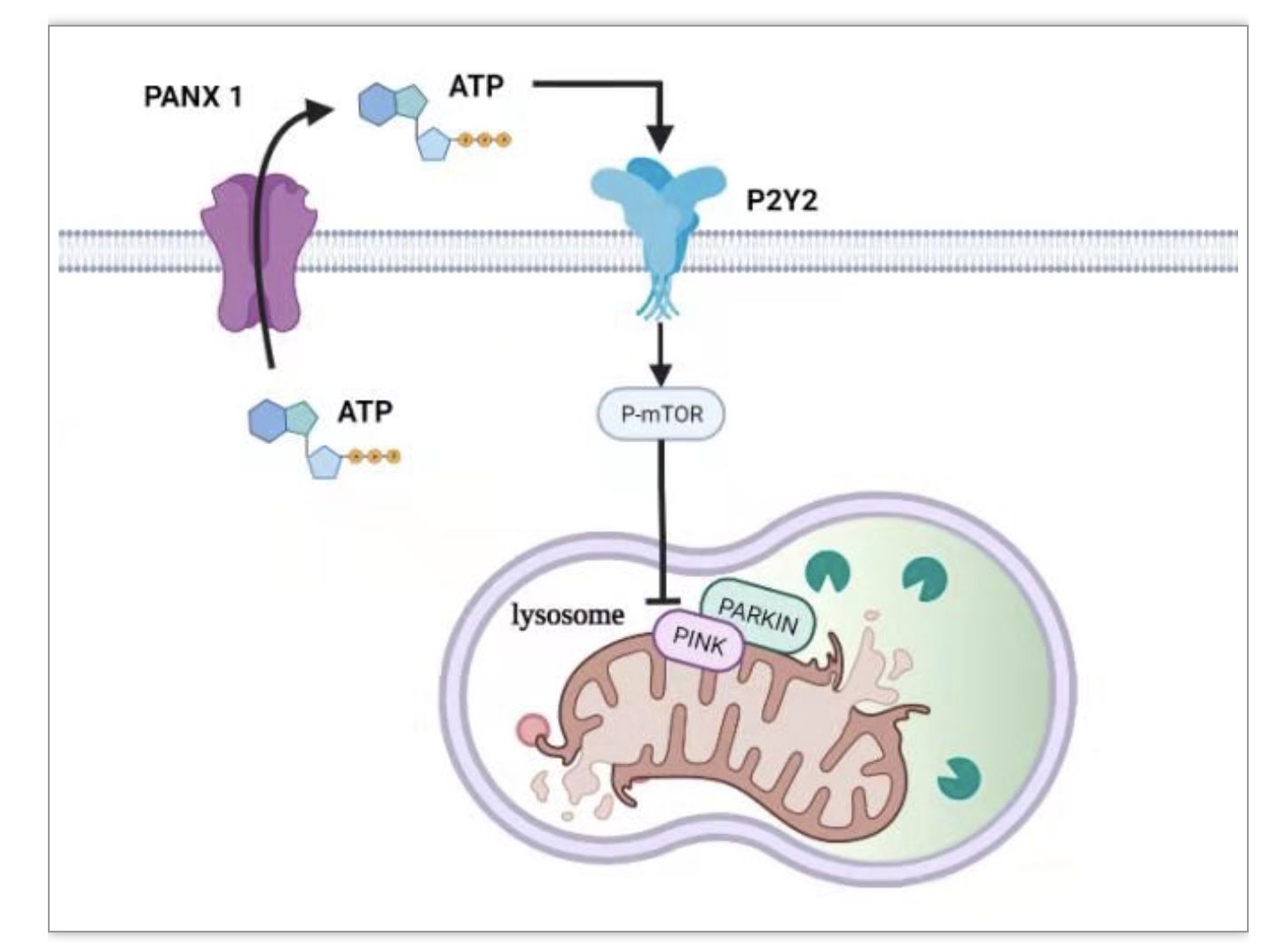
总之,研究团队证明了PANX1通道在I/R损伤后肾脏线粒体自噬中的负面作用。PANX1通道促进ATP释放以激活P2Y受体,从而激活mTOR信号传导,最终抑制线粒体自噬。PANX1通道显然可以在AKI的发展中发挥核心作用。因此,抑制PANX1通道可能是减少肾细胞凋亡和维持健康线粒体群体以对抗AKI发展的一种治疗方法。



总之,研究团队证明了PANX1通道在I/R损伤后肾脏线粒体自噬中的负面作用。PANX1通道促进ATP释放以激活P2Y受体,从而激活mTOR信号传导,最终抑制线粒体自噬。PANX1通道显然可以在AKI的发展中发挥核心作用。因此,抑制PANX1通道可能是减少肾细胞凋亡和维持健康线粒体群体以对抗AKI发展的一种治疗方法。