癌症是一个严重的公共卫生问题,在全球范围内是一个主要的死亡原因[1]。虽然化疗在癌症治疗方面取得了许多进展,但患者对抗癌药物的耐药性仍然是一个挑战,它导致了90%以上的癌症相关死亡[2]。在肿瘤学中,耐药性是指肿瘤细胞对于化疗药物作用的耐受性,这涉及到宿主因素、肿瘤因素以及肿瘤与宿主的相互作用。在靶向药物治疗过程中,癌细胞的耐药性的机制包括:1)药物外流增强,2)细胞死亡信号通路失调,3)DNA损伤修复,4)表观遗传学改变[3-5]。此外,其他机制还包括肿瘤内异质性和动态性、癌症干细胞的可塑性、癌细胞对肿瘤微环境的适应性,以及细胞外囊泡的耐药性细胞间转移等[6-9]。最近研究表明,双靶向治疗策略将有助于克服单靶向癌症药物的各种潜在耐药机制。与药物组合策略相比,一种药物同时调节两个药物靶点通常显示出较少的不良反应和较低的毒性[10]。因此,双靶点小分子已被广泛研究其用于克服癌症耐药性的潜力。
这篇综述总结了癌细胞的耐药性的机制包括:1)药物外流增强,2)细胞死亡信号通路失调,3)DNA损伤修复,4)表观遗传学改变。同时基于这些耐药机制,讨论了目前用于癌症治疗双靶点小分子克服耐药性的治疗策略,以期为双靶点小分子药物设计和开发提供新的思路。

迄今为止,上述几种ABC外流转运体抑制剂已经被开发出来,而临床试验表明,这些单靶点的ABC抑制剂大多具有副作用、意外的毒性以及与抗癌药物的不良相互作用,从而导致癌症患者获益有限。此外,只对ABC转运体中的一种进行选择性抑制,一般可由其余转运体进行补偿。因此,ABC转运体的双重抑制剂被进一步开发和使用,并为逆转耐药性提供了新的机会(图1)。
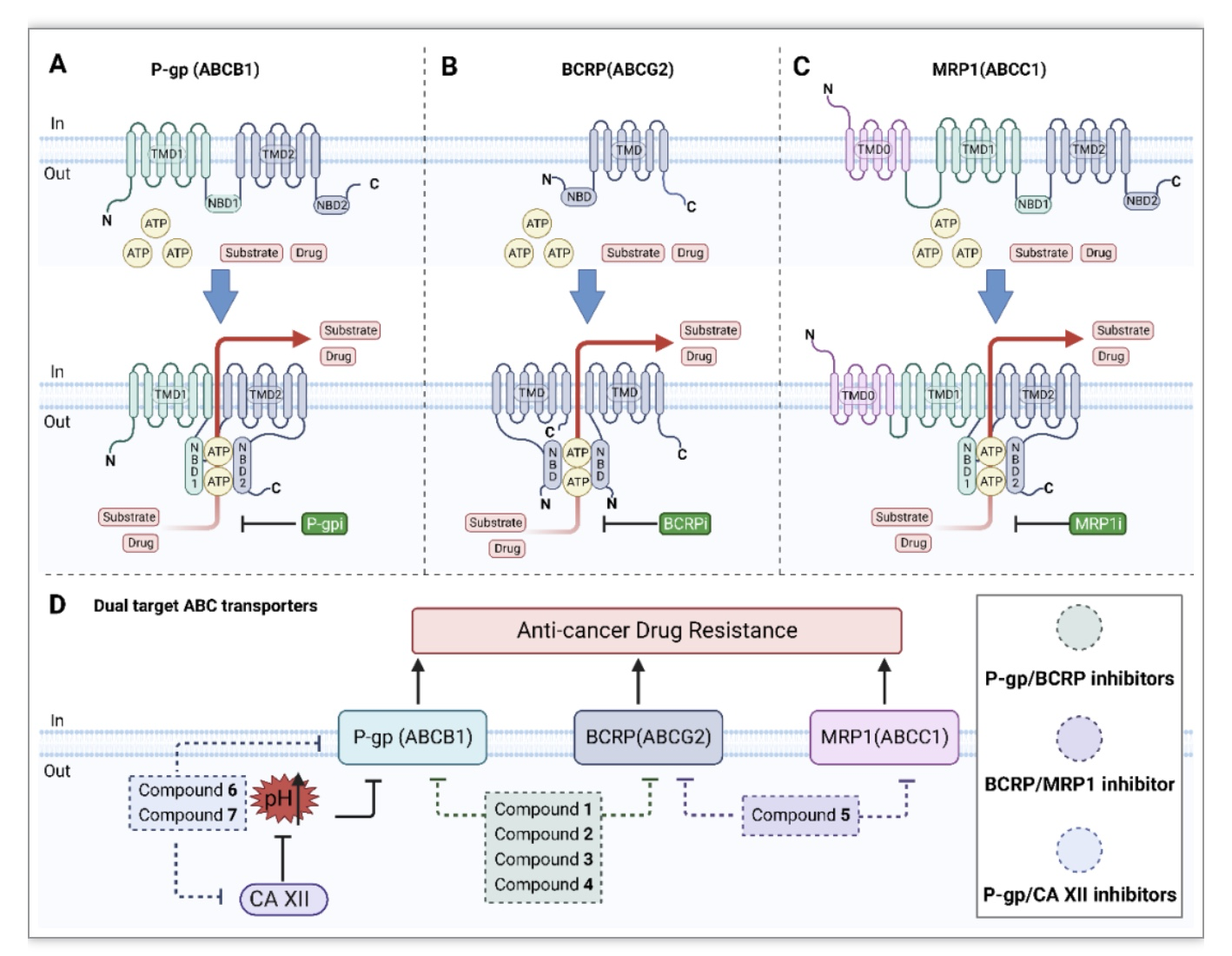
图1 由ABC转运蛋白介导的药物外流和相关双靶向小分子
(图源:Ye, J., et al., Biochimica et biophysica acta. Reviews on cancer, 2023)
目前,双靶点药物由于能调节参与肿瘤发生的不同靶点和途径,已成为防止细胞死亡失调避免耐药性的一种方法。双靶点小分子可以通过克服由靶点突变和功能旁路或替代性补偿途径从而克服细胞死亡失调机制介导的耐药性(图2)。
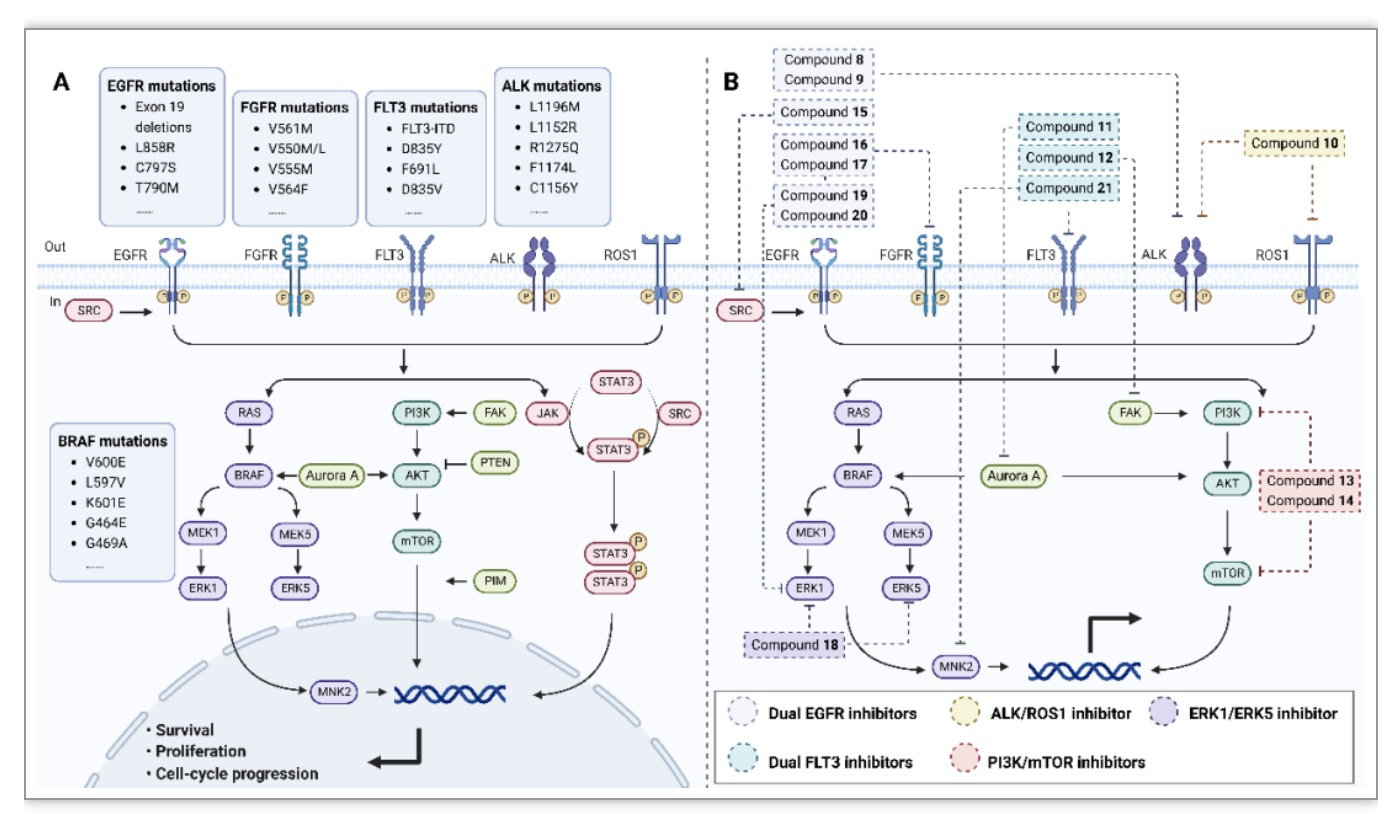
图2 细胞死亡失调的信号通路和相关双靶向小分子
(图源:Ye, J., et al., Biochimica et biophysica acta. Reviews on cancer, 2023)
DNA损伤反应(DDR)是一种逆转药物介导的DNA损伤的机制,癌细胞的DNA损伤修复能力已被认为在耐药性中起作用。DNA损伤通过不同的DNA修复途径进行修复,如错配修复、碱基切除修复、同源重组修复、非同源末端连接和核苷酸切除修复。鉴于聚ADP核糖聚合酶(Poly (ADP-ribose) polymerase,PARP)是DNA修复反应中研究最多的靶点,PARP双靶点小分子提供了克服DNA损伤修复的治疗策略的指导性例子。PARP抑制剂通过在乳腺癌症易感蛋白(breast cancer susceptibility protein, BRCA)突变的肿瘤细胞中造成持续和致命的DNA损伤,导致BRCA缺陷的癌症个体的抗癌活性,已经成功开发为治疗剂。然而,在临床前模型和临床中都有对PARP抑制剂产生抗性的报道。耐药机制主要与DNA修复途径的失调有关,这为双重PARP小分子药物提供了一些设计依据(图3)。
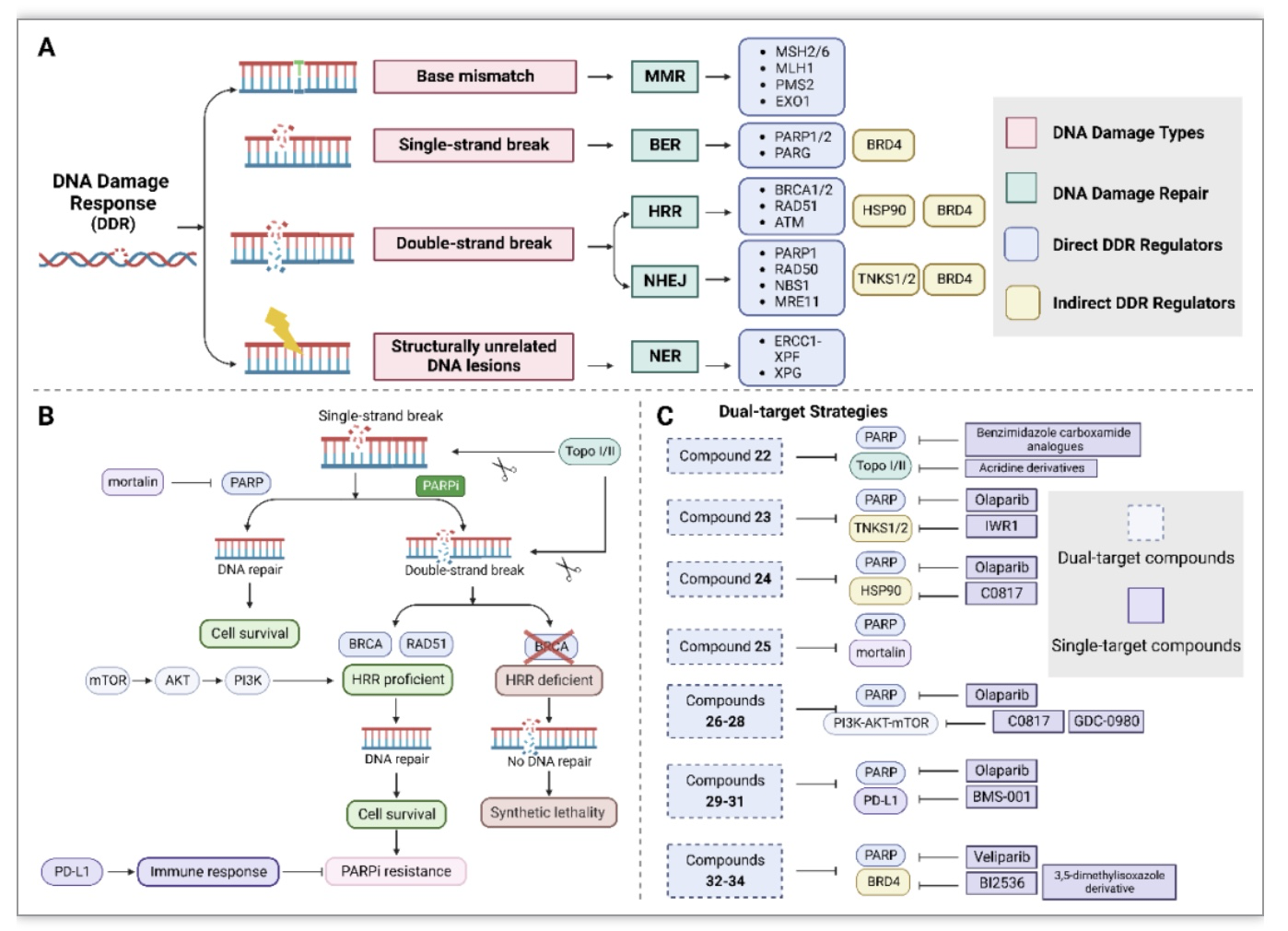
图3 DNA损伤反应和相关双靶向小分子
(图源:Ye, J., et al., Biochimica et biophysica acta. Reviews on cancer, 2023)
表观遗传学的改变在肿瘤发生和癌细胞的生存中起着重要作用,为治疗提供了有吸引力的药物靶点。同时调控两个表观遗传学靶点已被认为是一种实用的药物治疗策略以扭转表观遗传学改变引起的耐药性(图4)。
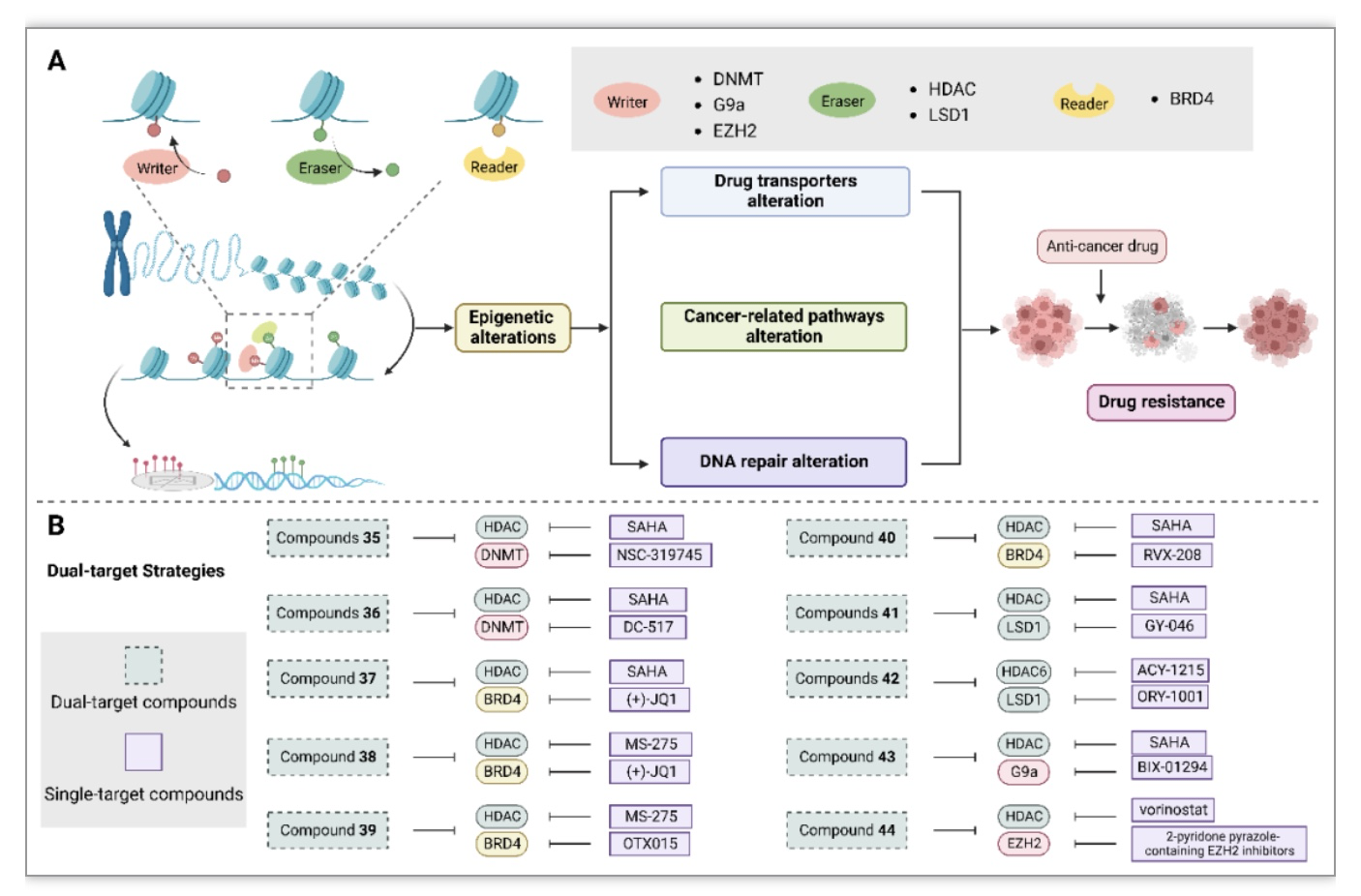
图4 表观遗传改变和相关双靶向小分子
(图源:Ye, J., et al., Biochimica et biophysica acta. Reviews on cancer, 2023)
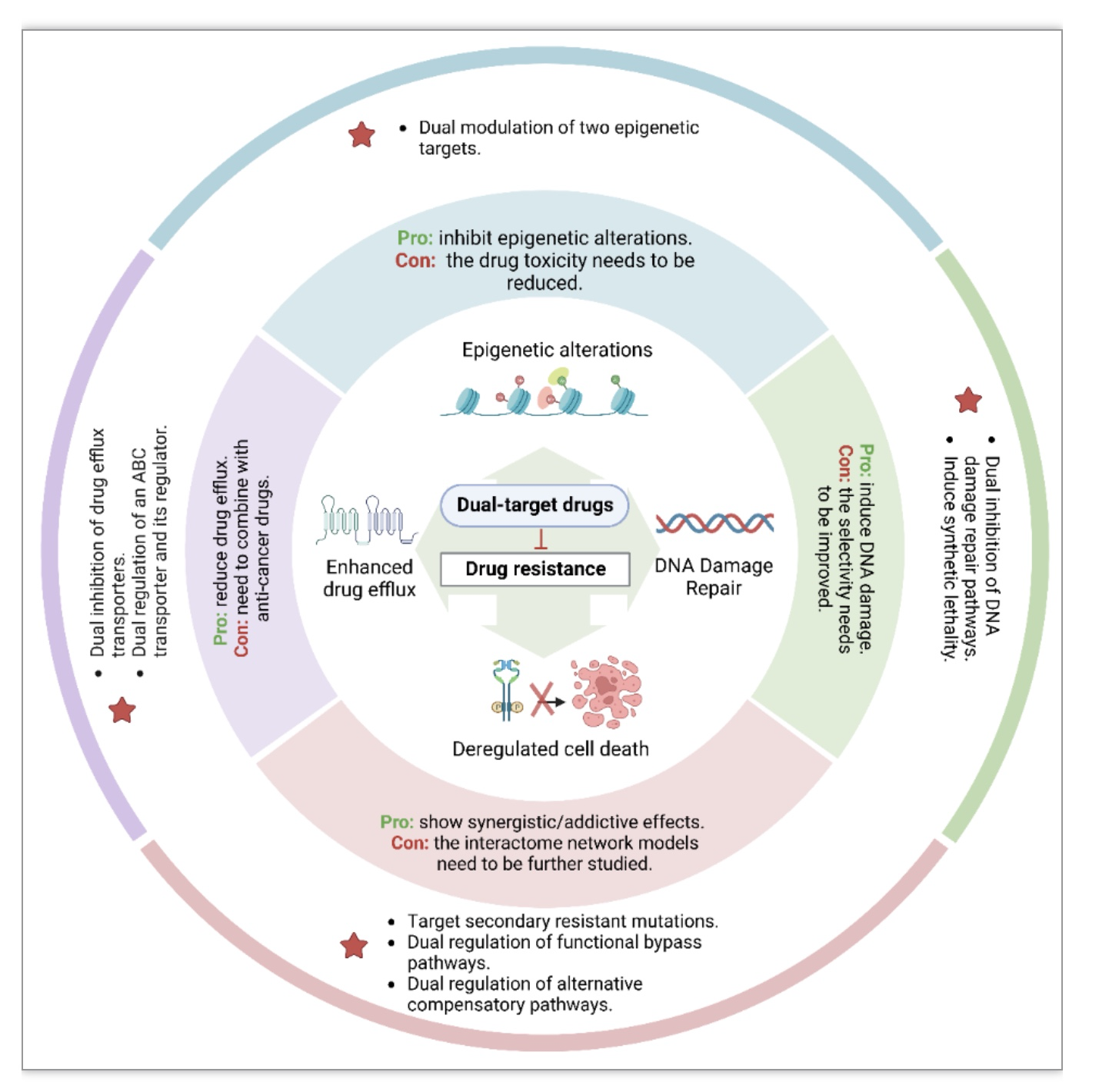
图5 癌症治疗中双靶向小分子治疗策略
(图源:Ye, J., et al., Biochimica et biophysica acta. Reviews on cancer, 2023)
鉴于癌症的多因素性质,临床前研究已经揭示了癌细胞耐药性的丰富分子机制,这些机制为双靶向小分子药物的设计提供了设计依据(图5)。这些双靶向小分子的治疗策略为克服耐药性提供了新的机遇,同时也将推动对用于癌症治疗的双靶向小分子的进一步探索。

