脑胶质瘤(Glioblastoma multiforme, GBM)是中枢神经系统最常见的恶性肿瘤,由于血脑屏障(Blood–brain barrier, BBB)的存在及肿瘤的高浸润性特点,造成了其发病率高和死亡率高的困境。常见的临床治疗方式如手术切除、放疗、化疗等手段侵害性大、安全性低、有效性差,无法实现脑胶质瘤的有效抑制。铁死亡是一种新型的细胞死亡方式,有望为脑胶质瘤的安全高效诊疗提供新的机会,但是现有的铁死亡剂的特异性激活效率低且缺乏高效的体内示踪功能,造成盲目的体内研究及治疗效率低、安全性差,限制了该设想。近红外二区(1000-1700 nm)聚集诱导发光(Aggregation-induced emission, AIE)活体荧光成像技术具有穿透深、聚集增强、信噪比高、实时成像的优势,是一项高效的辅助研究纳米药物体内代谢及分布的先进示踪技术。因此,通过开发脑靶向近红外高特异性铁死亡剂,监测纳米药物的BBB穿透及体内分布,并特异性激活GBM的铁死亡,是极具前景的GBM治疗手段,但由于巨大的设计及合成挑战,目前尚无相关研究报道。该研究工作是基于先进的聚集诱导发光技术,合成首个近红外二区高特异性AIE铁死亡剂,并首次揭示了Au诱导的非典型高特异性铁死亡机制,对深入研究靶向铁死亡及脑疾病安全精准诊疗剂的开发具有重要意义。

研究中的脑靶向近红外AIE铁死亡剂的设计如图1所示,通过巧妙在给体(D)-π-受体(A)-π-A型扭曲结构的近红外分子骨架中引入Au(I)铁死亡活性中心,设计合成了一种近红外二区AIE高特异性铁死亡分子(TBTP-Au),然后利用响应自组装及表面脑靶向多肽(ApoE)修饰技术,构建在肿瘤区响应性释放的脑靶向近红外铁死亡剂,不仅实时、长效监测纳米诊疗剂的BBB穿透及在小鼠GBM部位的富集,同时可控释放后的TBTP-Au可通过特异性结合肿瘤细胞高表达的硫氧还蛋白还原酶(TrxR),特异性地激活脑胶质瘤细胞中的血红素加氧酶(HMOX1)介导的铁死亡通路,最终引发脑胶质瘤的高效铁死亡并有效延长荷瘤小鼠的生存周期。
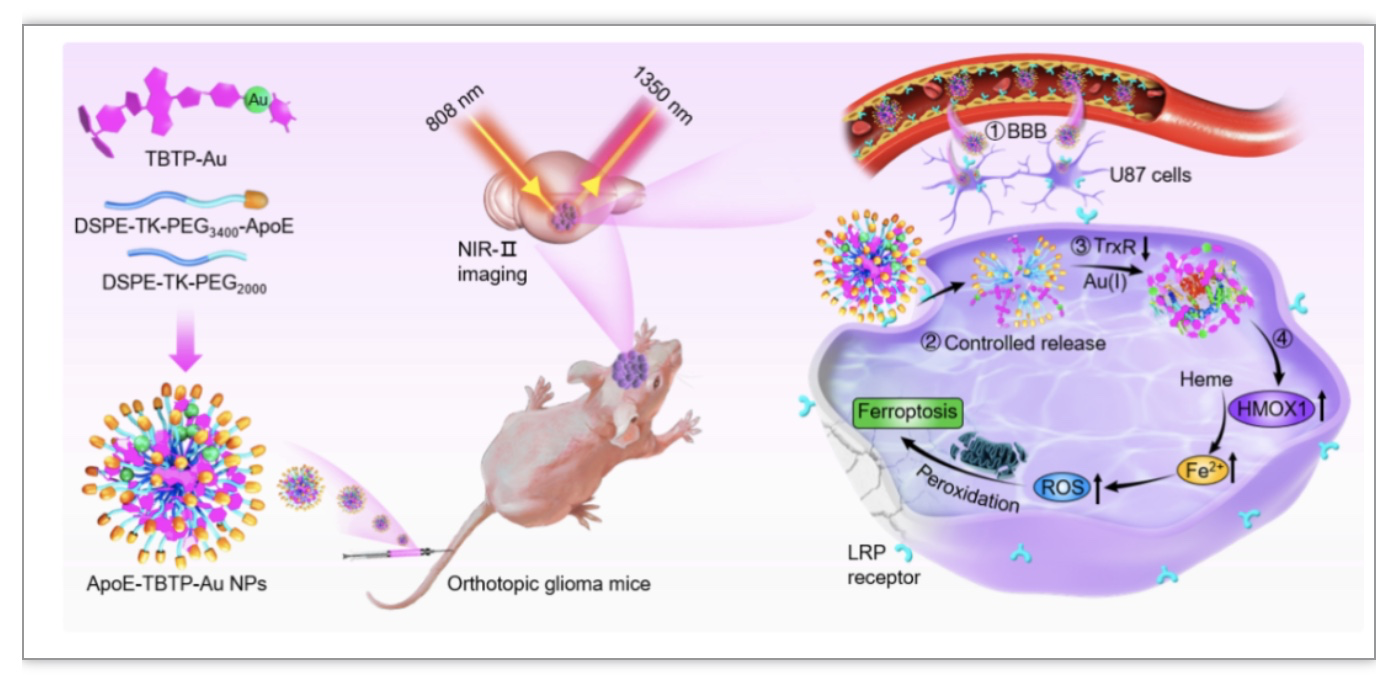
图1. 脑靶向铁死亡剂的构建及对胶质瘤的高特异性铁死亡机制示意图
(图源: Zhang, J., et al., Advanced science, 2023)
基于上述的构建设想,研究人员成功制备脑靶向AIE铁死亡诊疗系统,将其进行脑胶质瘤细胞的诱导处理,然后通过基因测序、蛋白分析等手段观测该纳米系统在胶质瘤细胞中的铁死亡响应。如图2所示,作者首先进行细胞水平的mRNA测序分析(图2A-C),结果表明ApoE-TBTP-Au纳米诊疗剂能高效调控非经典铁死亡中心——HMOX1的上调表达,显著激活下游的铁死亡通路。进一步地通过蛋白分析探索其特异性激活通路来源于Au活性中心与TrxR的特异性结合,通过靶向抑制TrxR的活性,从而特异性激活HMOX1(图2D-F)。细胞毒性实验及细胞周期检测结果显示上述铁死亡通路能有效干扰细胞DNA复制并抑制肿瘤增殖生长(图2G,H)。
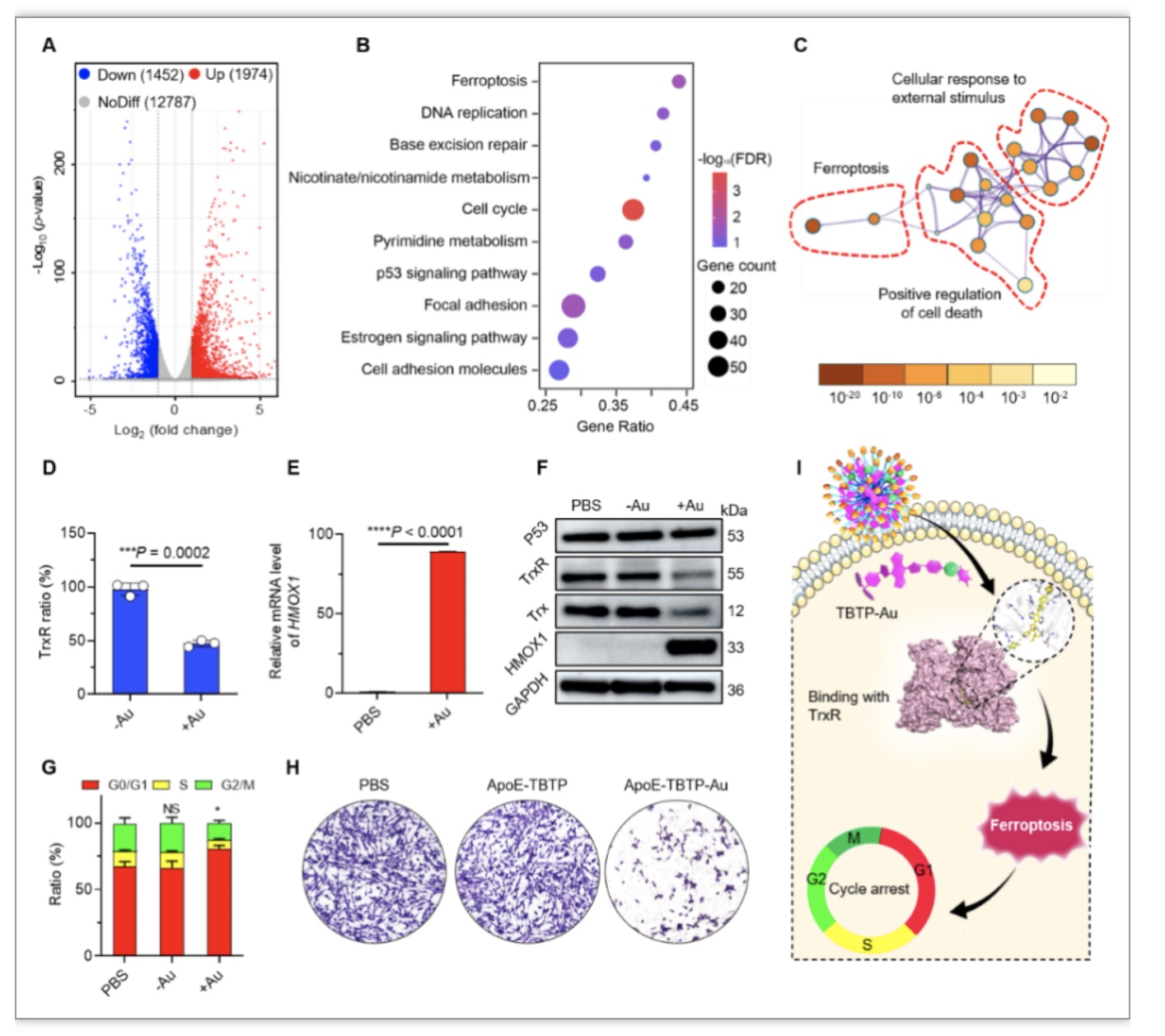
图2. ApoE-TBTP-Au纳米药物诱导铁死亡相关基因、蛋白和细胞周期阻滞
(图源: Zhang, J., et al., Advanced science, 2023)
研究者进一步地通过活体GBM荷瘤小鼠模型验证ApoE-TBTP-Au纳米铁死亡剂对GBM模型小鼠的BBB穿透及肿瘤抑制效果。如图3A所示,经过尾静脉注射,利用1350 nm的近红外荧光监测,显示该脑靶向AIE纳米诊疗剂在靶向多肽作用下,与肿瘤表面高表达的低密度脂蛋白受体特异性结合,实现高效穿透BBB(图3B),相较于非靶向组,靶向组具有更好的靶向肿瘤部位富集的能力。经过一个疗程的给药治疗后,靶向纳米药物显示出更高效的肿瘤抑制效果(图3C),GBM模型小鼠的生存天数有效延长至60天以上(图3D)。该成果充分展示了合理设计构建的可视化AIE高特异铁死亡剂在脑胶质瘤的有效铁死亡治疗和近红外实时追踪方面的巨大潜力和临床转化价值。
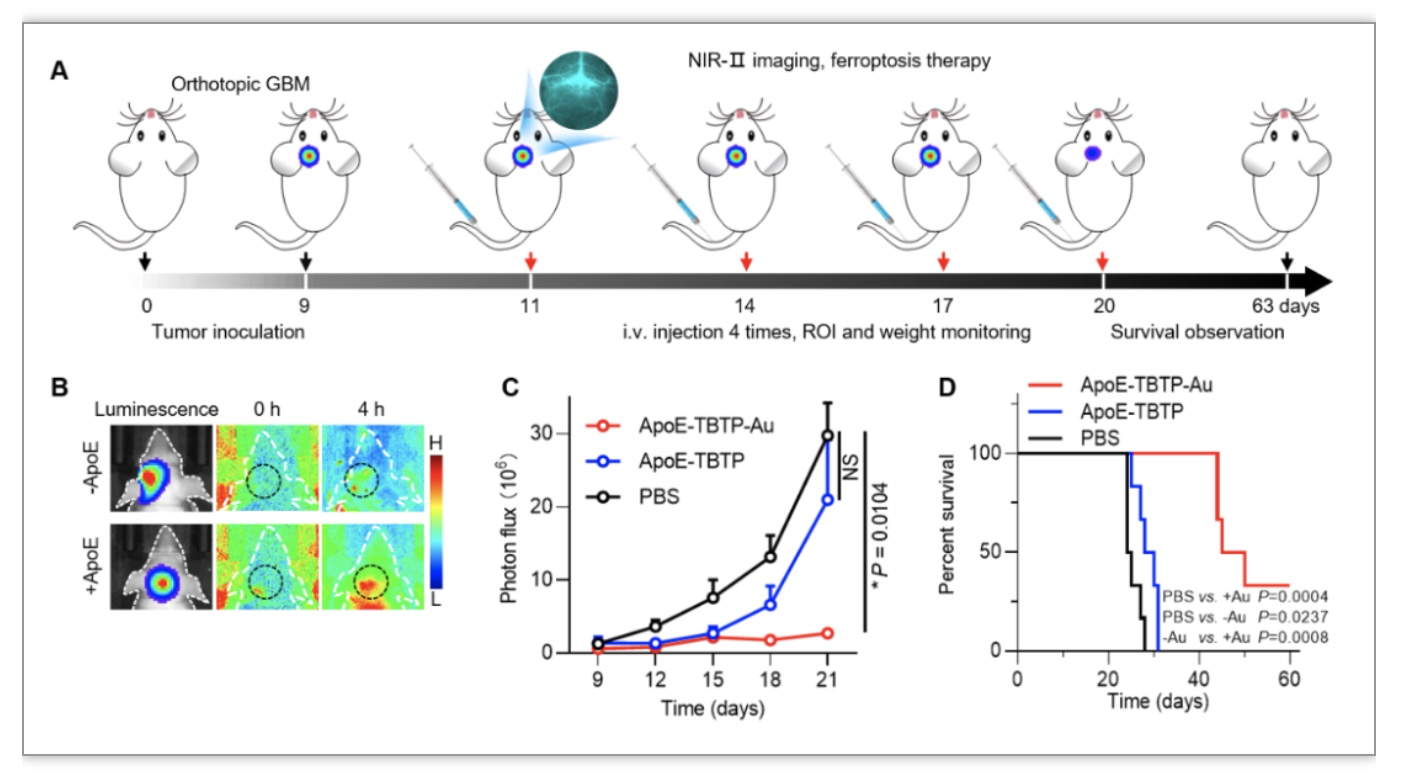
图3. 纳米铁死亡剂对原位胶质瘤荷瘤小鼠的肿瘤抑制及生存监测结果
(图源: Zhang, J., et al., Advanced science, 2023)

