造血干细胞(hematopoietic stem cell,HSC)主要定位于骨髓中,数量极少但却维持着机体的终生造血功能。正常情况下,HSC数量的维持较为稳定,而且可平衡地分化为髓系(单核细胞、粒细胞等)和淋系(T、B细胞)造血细胞。但在应激如衰老、放化疗诱导的骨髓损伤等情况下,HSC维持常会发生异常,并表现为髓系偏向分化[1]。髓系偏向造血会引发固有免疫炎症、适应性免疫缺陷等,致使机体对感染、肿瘤、心脑血管疾病等更加易感。
近年来研究发现,骨髓造血微环境中的营养物分布较血液循环有很大的不同,从而塑造了HSC独特的营养代谢特点[2]。营养代谢与骨髓HSC稳态调控密切相关。值得注意的是,由于当代生活方式的改变,如营养过剩、久坐不动等,人们发生代谢性疾病的风险显著升高。其中,高胆固醇血症由于其致命的心脑血管并发症得到了全世界的广泛关注。有趣的是,骨髓造血对胆固醇代谢异常极其敏感,胆固醇过量会导致骨髓HSC扩增以及髓系偏向造血[3]。然而,骨髓HSC胆固醇代谢特点及其与髓系偏向造血的因果联系至今尚未明确。

本研究中,作者首先基于小鼠骨髓造血干/祖细胞转录组数据库分析,发现造血干/祖细胞胆固醇代谢具有明显异质性(图1A-C)。在胆固醇代谢相关基因中,胆固醇摄取关键分子低密度脂蛋白受体(LDLR)在造血干/祖细胞中表达差异最为显著。流式细胞术进一步发现,在具有长期重建能力的造血干细胞(long-term HSC,LT-HSC)中,LDLR表达水平较高,但其细胞内胆固醇含量却较低(图1D-F),提示高LDLR表达是细胞内低胆固醇含量负反馈的结果。另外,根据流式结果发现,在LT-HSC这群细胞中LDLR表达和细胞内胆固醇含量也有很大的异质性(图1E,F)。在功能上,HSC离体培养发现LDLR低表达、细胞内胆固醇含量高的LT-HSC具有更强的维持和髓系分化能力(图1G-O)。

图1. LT-HSC具有独特的胆固醇代谢特征
(图源:Chaonan Liu et al., Redox Biology,2023)
在体内,通过长期高胆固醇饮食(high cholesterol diet,HCD)处理小鼠,作者发现HCD小鼠骨髓LT-HSC内胆固醇含量显著升高,而LDLR表达显著降低,并伴随LT-HSC维持能力增强和髓系偏向分化(图2)。在体外,作者通过使用LDL和胆固醇直接处理LT-HSC,或者使用环糊精(MCD)耗竭HSC内胆固醇,发现胆固醇可以直接调控LT-HSC维持和髓系分化。随后,作者通过使用电离辐射诱导的骨髓造血抑制模型进一步验证了胆固醇代谢与骨髓HSC维持和分化的关联。结果显示,辐照后小鼠骨髓LT-HSC数量显著减少,并伴随细胞内胆固醇含量显著减少、LDLR表达显著升高,而且LT-HSC数量变化与细胞内胆固醇含量变化较为一致。相反,辐照前使用HCD升高LT-HSC内胆固醇可显著减轻辐照诱导的骨髓LT-HSC数量减少,并促进其髓系偏向分化。以上结果证实了胆固醇代谢与HSC维持和分化的直接联系,而LDLR表达可以作为HSC胆固醇含量和功能的标志物。
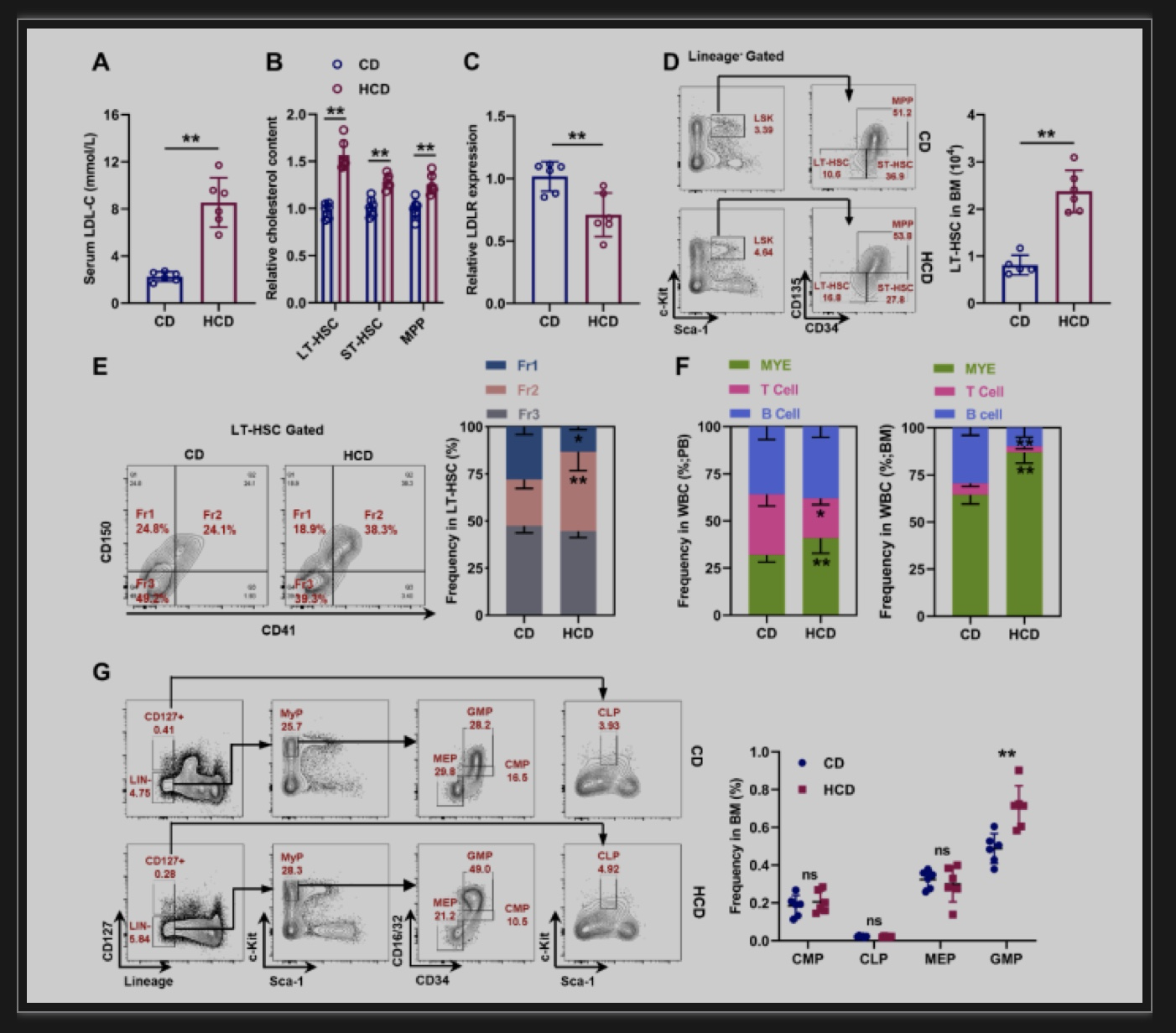
图2. 胆固醇直接调控LT-HSC维持和分化
(图源:Chaonan Liu et al., Redox Biology,2023)
在分子机制上,通过骨髓LT-HSC转录组测序,作者注意到HCD小鼠骨髓HSC内mTOR活化最为显著(图3A)。同时,作者还发现骨髓LT-HSC高表达胆固醇感知分子SLC38A9,而SLC38A9是mTOR的上游活化分子之一[4]。通过慢病毒感染以敲低SLC38A9或使用mTOR抑制剂雷帕霉素(Rapa)均可显著抑制高胆固醇诱导的LT-HSC维持能力增强和髓系偏向分化(图3B-F,H-K)。因此,SLC38A9-mTOR信号轴是介导HSC内胆固醇感知和信号转导的重要分子通路。
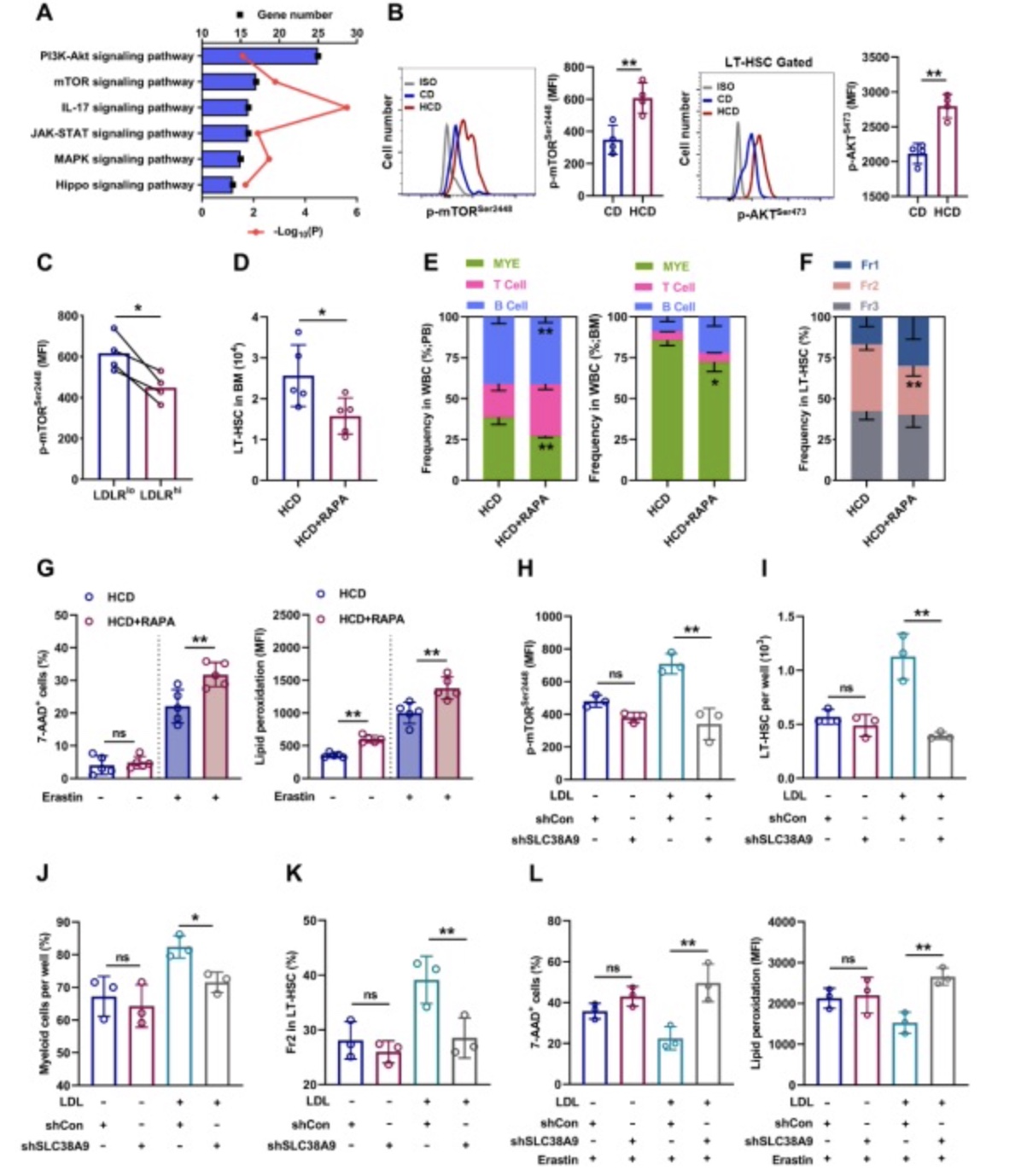
图3. SLC38A9–mTOR轴介导LT-HSC内胆固醇感知和信号转导
(图源:Chaonan Liu et al., Redox Biology,2023)
此外,通过IPA分析细胞和分子功能改变,作者还注意到HCD小鼠骨髓LT-HSC内细胞死亡和存活信号通路改变最为显著(图4B),其中又以铁死亡信号通路抑制最为显著(图4E)。进一步研究发现,细胞内高胆固醇诱导的SLC38A9-mTOR信号轴激活可直接增强骨髓LT-HSC铁死亡耐性,表现为谷胱甘肽(GSH)含量升高、Fe2+含量降低、脂质过氧化减少(图4F-L)。已知,mTOR激活可促进HSC髓系偏向分化[5]。综上说明,高胆固醇通过激活SLC38A9-mTOR信号轴增强髓系偏向LT-HSC铁死亡耐性。
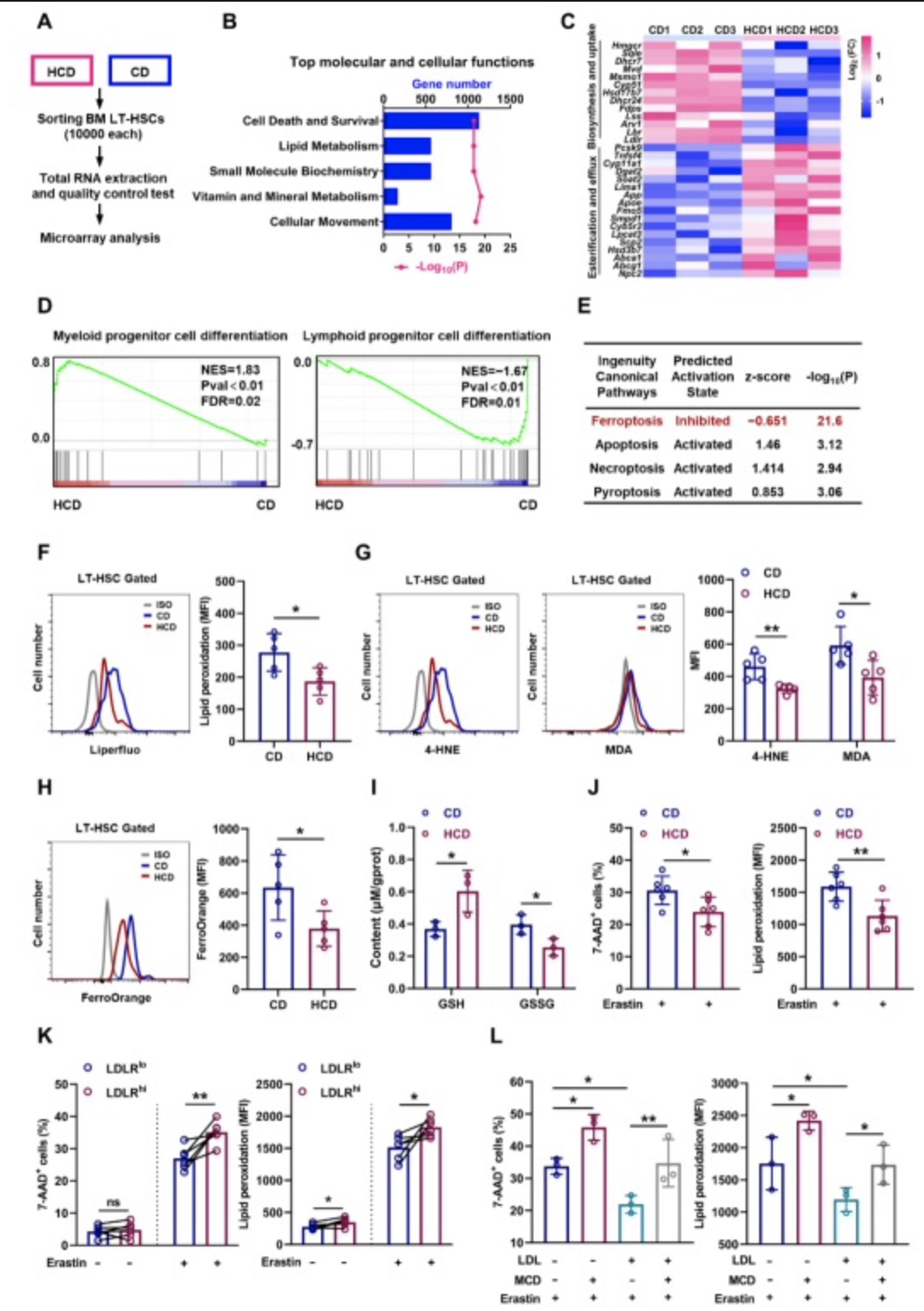
图4. 胆固醇增强LT-HSC铁死亡耐性
(图源:Chaonan Liu et al., Redox Biology,2023)
事实上,mTOR与细胞铁死亡敏感性调控密切相关[6]。作者通过系统分析mTOR下游铁死亡调控分子通路改变发现,高胆固醇诱导的mTOR激活可特异性地上调骨髓LT-HSC内SLC7A11/GPX4表达和抑制铁自噬(图5A-J),从而导致骨髓LT-HSC内谷胱甘肽(GSH)含量升高、Fe2+含量降低、脂质过氧化减少。最后,作者使用铁死亡诱导剂IKE处理HCD小鼠,发现IKE处理可显著降低HCD小鼠骨髓LT-HSC铁死亡耐性,并最终显著恢复HCD小鼠骨髓LT-HSC维持和平衡分化能力。

图5. 高胆固醇通过激活mTOR上调SLC7A11/GPX4表达和抑制铁自噬
(图源:Chaonan Liu et al., Redox Biology,2023)
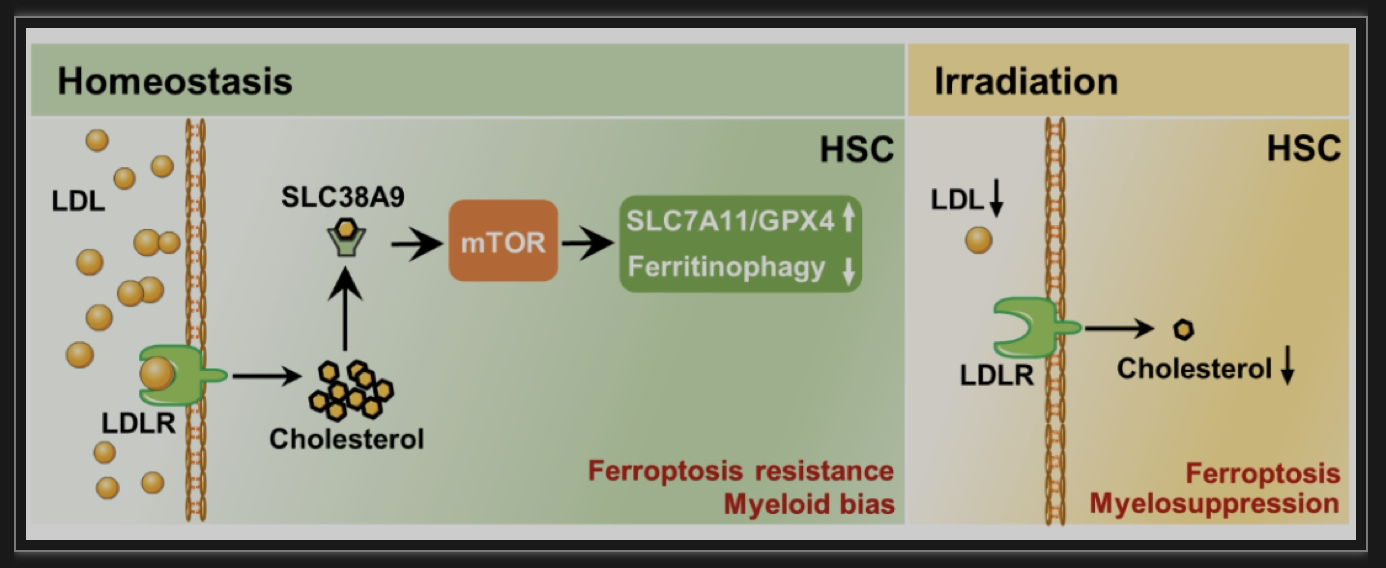
图6. 文章总结图
文章结论与讨论,启发与展望
综上所述,这项研究首次揭示了HSC独特的胆固醇代谢特征,发现胆固醇可以直接调节HSC分化和铁死亡耐性。在分子机制上,高胆固醇通过激活SLC38A9–mTOR信号轴不但可促进HSC髓系偏向分化,而且可通过上调SLC7A11/GPX4表达和抑制铁自噬以增强HSC铁死亡耐性,最终导致髓系偏向HSC的扩增。这项研究结果不仅为胆固醇代谢在干细胞命运决定中的调控作用提供了新见解,而且拓展了人们对血脂异常健康危害的认识,并为其防治提供了新思路。另外,该研究结果还提示,靶向胆固醇代谢可以防治临床放化疗导致的骨髓造血功能抑制。然而,靶向骨髓HSC铁死亡耐性对高胆固醇血症诱导心脑血管疾病的防治作用以及LT-HSC胆固醇异质性形成的原因仍需进一步研究。

