G蛋白偶联受体(G Protein-Coupled Receptors,GPCRs)是目前最大的一类跨膜蛋白质受体家族[1,2],其经常被用作临床药物开发的重要靶点[3,4]。GPR116受体是第二大类GPCRs(粘附性GPCRs,aGPCRs)中的一种,广泛表达于各个器官和免疫系统中[5]。自然杀伤细胞(Natural killer,NK)是先天免疫的效应细胞之一,能够通过杀死病毒感染的细胞或肿瘤细胞而发挥免疫保护作用,其功能受到多种因素的调控[6,7]。但是,GPR116受体是否也能调控NK细胞的功能还尚不清楚。因此,研究人员深入探讨GPR116受体对NK细胞功能的调控作用对于利用NK细胞开展肿瘤免疫治疗的研究有着十分重要的意义。该研究通过体外和体内实验证明GPR116受体能够通过Gαq/HIF1α/NF-κB途径负调控NK细胞的生物学功能,下调GPR116受体能够提高NKG2D-CAR-NK92细胞的抗肿瘤效果。该研究结果对阐明GPR116受体作为潜在的免疫检查点分子对NK细胞的调控作用及利用NK细胞或CAR-NK细胞开展肿瘤免疫治疗的研究提供了实验依据。

为了探究GPR116受体在抗肿瘤中的作用,研究人员分别在野生型和GPR116受体敲除的小鼠背部注射胰腺癌细胞。结果发现GPR116受体敲除的小鼠肿瘤生长速度明显慢于野生小鼠(图1A-C),进一步的研究发现GPR116受体缺失增加肿瘤内部功能性NK细胞的数目而非功能性T细胞的数目(图1D-I),这说明GPR116受体缺失可以增强NK细胞的功能从而起到抑制肿瘤生长的作用。研究人员进一步在体外利用小鼠来源的NK细胞和NK92细胞株对GPR116对NK细胞生物学功能的影响作用进行了验证,结果表明GPR116受体可以抑制NK细胞的激活和杀伤功能。
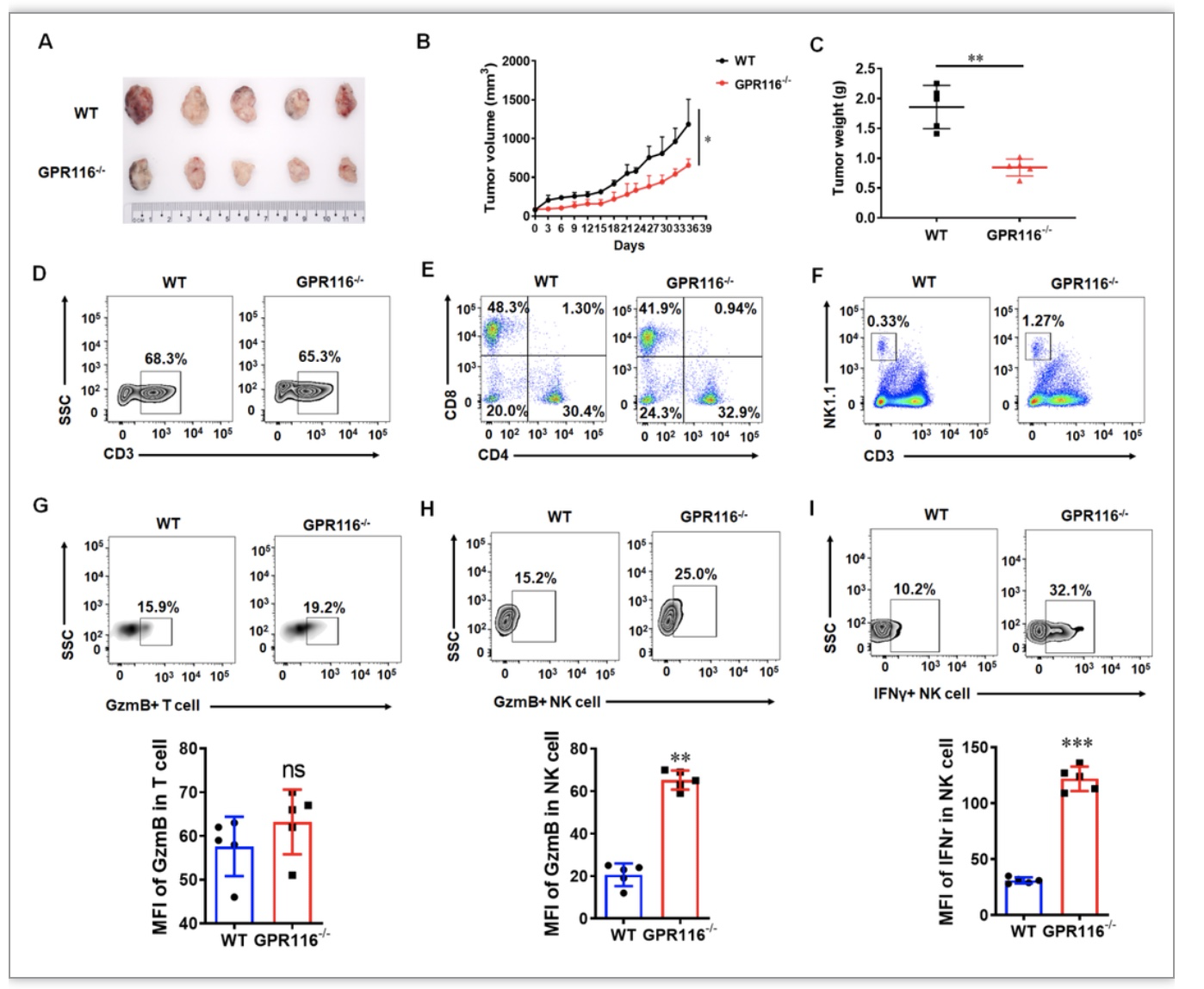
图1 GPR116受体基因通过调控NK细胞的功能影响小鼠体内肿瘤的生长。
(图源:Guo et al., Cell & Bioscience, 2023)
为了探究GPR116受体调控NK细胞功能的机制,研究人员通过shRNA下调NK92细胞中GPR116受体的表达,然后检测NF-κB 和HIF1α的表达。结果发现下调GPR116受体能够上调p-P65的表达,降低HIF1α的表达(图2A)。随后,研究人员分别加入NF-κB 的抑制剂(QNZ)和HIF1α(CoCl2)激活剂检测相关因子的表达。结果发现加入QNZ能够抑制p-P65的表达但不影响HIF1α的表达水平,而加入CoCl2能够同时影响NF-κB 和HIF1α的表达(图2B-D)。加入QNZ后NK细胞的杀伤功能和细胞因子的释放也被抑制(图2E-H)。另外,GPR116受体的表达下调和下游Gαq的表达下调均能抑制HIF1α的表达以及上调P65的磷酸化,同时促进NK细胞的杀伤功能及细胞因子释放(图3A-F)。这说明GPR116受体通过Gαq/HIF1α/NF-κB轴影响NK细胞的功能。
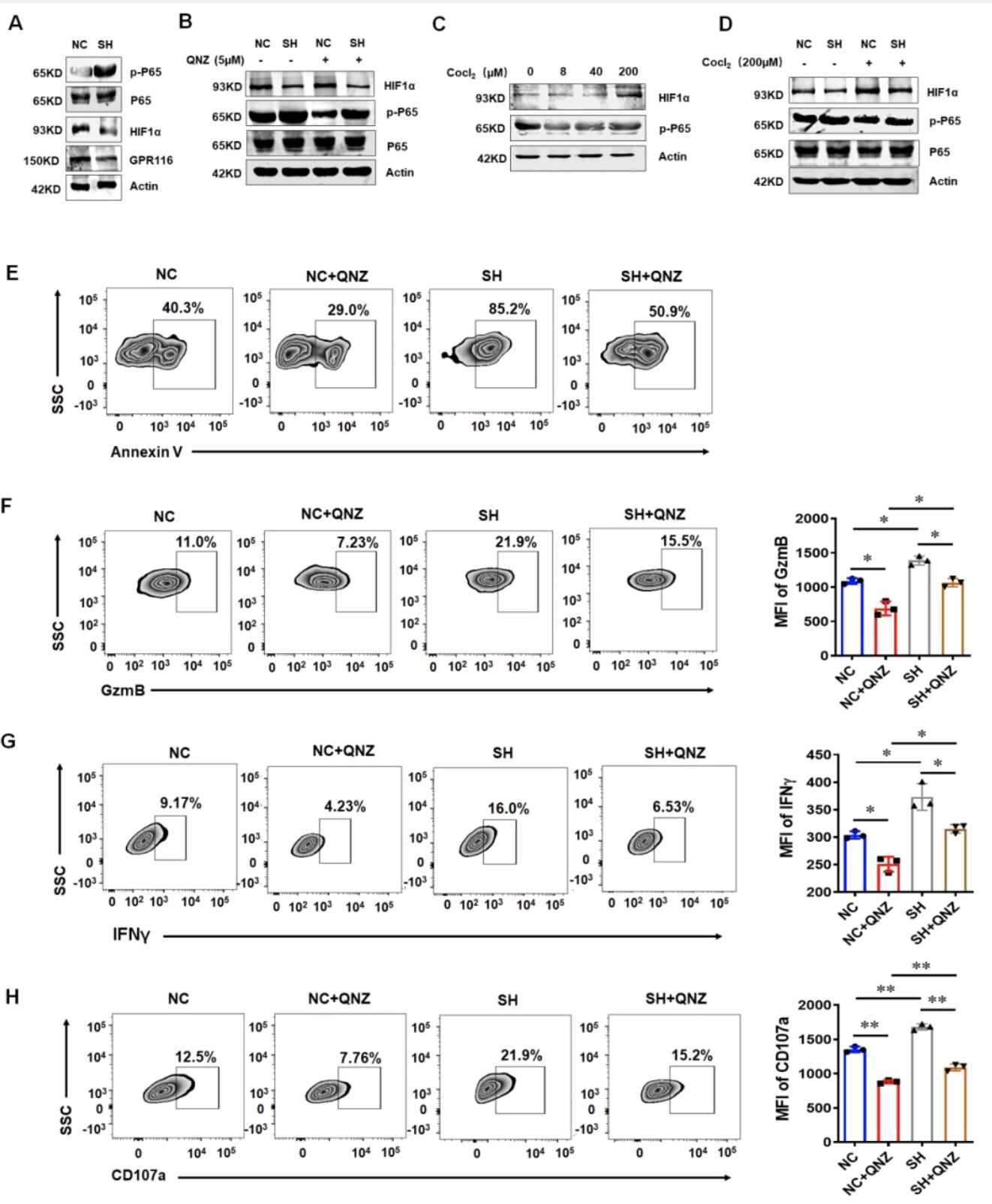
图2 GPR116受体通过Gαq/HIF1α/NF-κB轴调控NK细胞的抗肿瘤功能。
(图源:Guo et al., Cell & Bioscience, 2023)
为了将基础研究成果应用于临床细胞治疗产品的研发,研究人员通过shRNA下调NKG2D-CAR-NK92细胞中GPR116受体的表达,结果发现以NKG2D为靶向的CAR-NK92细胞能够有效抑制肿瘤的生长,而下调GPR116受体以后,抑制肿瘤效果更加明显(图3A-D)。通过检测肿瘤内部NK92细胞数目和功能后发现,敲低GPR116可以增加CAR-NK92细胞在肿瘤内部的数量和功能(图3E-G),这说明下调GPR116受体的表达可以有效增强NKG2D-CAR-NK92细胞的抗肿瘤作用。
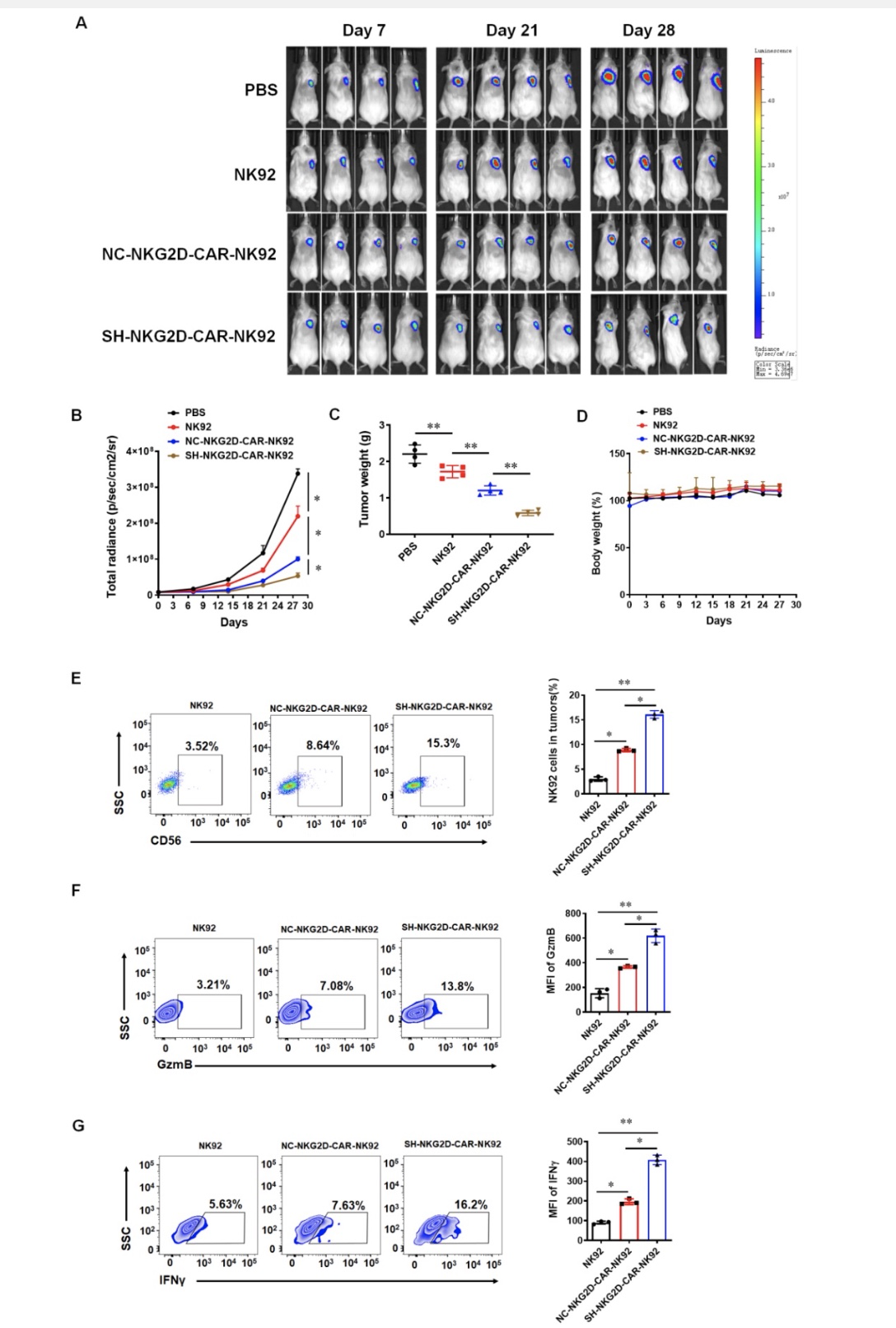
图3 下调GPR116受体增强NKG2D-CAR-NK92细胞的抗肿瘤作用。
(图源:Guo et al., Cell & Bioscience, 2023)
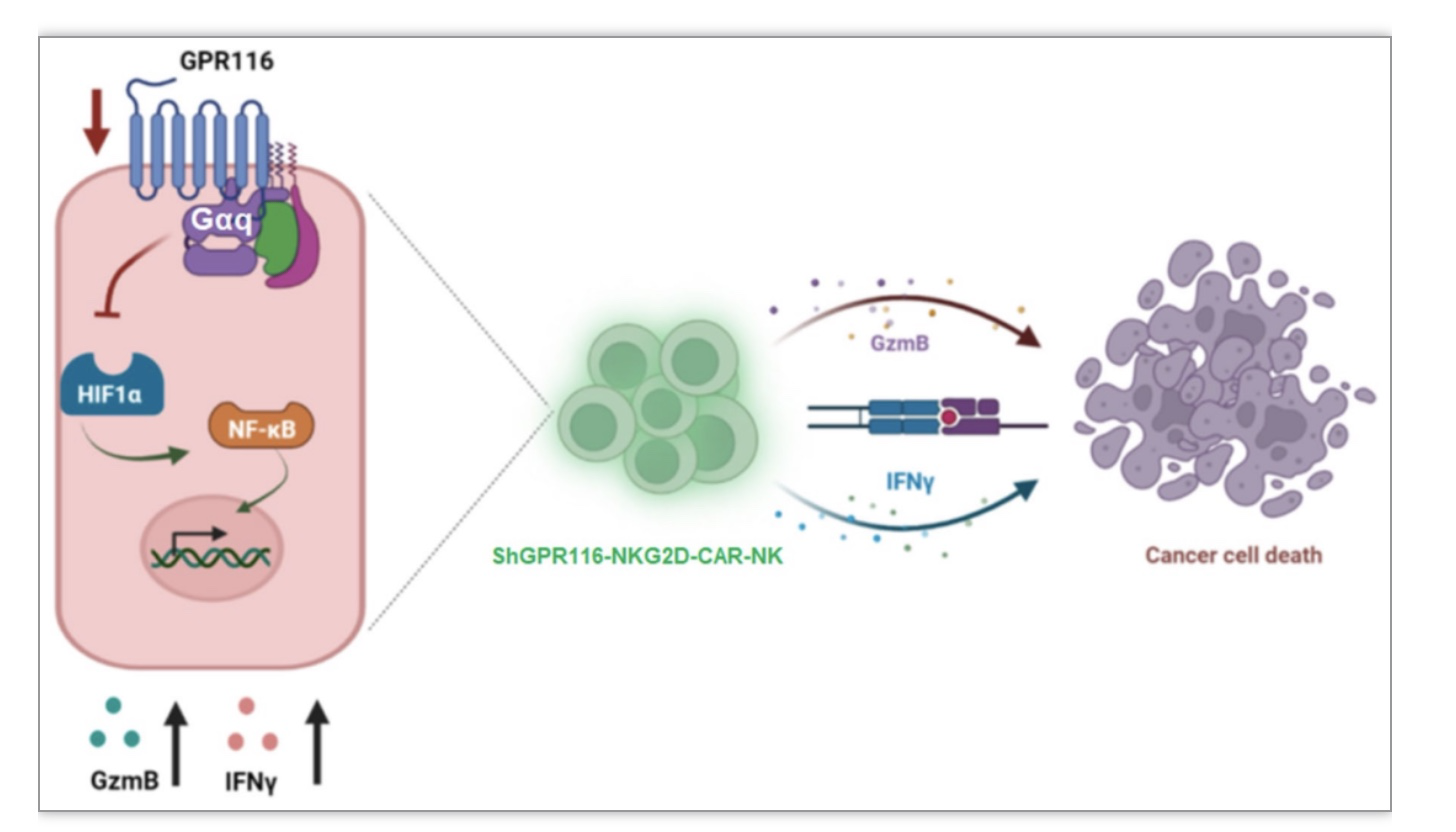
图4 GPR116受体调控CAR-NK细胞治疗效果的机制图。
(图源:Guo et al., Cell & Bioscience, 2023)

