免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)的出现,为肝细胞癌(hepatocellular carcinoma, HCC)患者带来了新的治疗模式。程序性细胞死亡蛋白1(programmed cell death protein 1, PD-1)靶向免疫治疗在进展期HCC的II/III期研究中显示出良好的效果和较好的安全性[1-5]。然而,肝功能Child-Pugh B进展期HCC患者往往被排除在临床试验之外,该人群预后差尚无有效且安全的治疗方案,亟待为该人群提供新的治疗方案。该研究旨在评估卡瑞利珠单抗联合分子靶向药物治疗肝功能Child-Pugh B级进展期HCC患者疗效和安全性。

研究纳入2019年1月至2021年3月期间西安交通大学第二附属医院、北京地坛医院、空军军医大学唐都医院、陕西省人民医院、山东省立医院和西安交通大学第一附属医院99例进展期HCC患者(58例Child-Pugh A和41例Child-Pugh B),其中84例(48例Child-Pugh A和36例Child-Pugh B)接受了卡瑞利珠单抗(200 mg静脉注射,每3周)联合分子靶向治疗,15例接受了卡瑞利珠单抗单药治疗。主要终点为安全性和12个月总体存活(overall survival, OS)率。次要终点为客观缓解率(objective response rate, ORR)、疾病控制率(disease control rate, DCR)和无进展生存期(progression-free survival, PFS)。
99例患者中,乙型肝炎病毒(hepatitis B virus, HBV)感染是最主要病因(80例,80%), 43例(43.4%)AFP>400 ng/mL,40例患者(40.4%)发生大血管浸润(macrovascular infiltration, MVI), 40例(40.4%)合并肝外转移,包括肺转移(21例)、骨转移(11例)、淋巴转移(13例)和肾上腺转移(3例)。中位随访时间为12.1个月(95% CI: 9.9-14.0)。随访期间死亡42例(42.4%),其中Child-Pugh A组21例(36.2%),Child-Pugh B组21例(51.2%)。平均接受卡瑞利珠单抗6(95% CI: 5-7)个周期治疗。肿瘤应答情况和总体存活详见表1和图1。Child-Pugh B和Child-Pugh A两组患者在肿瘤应答,OS,PFS无明显差别,尽管Child-Pugh B患者中位OS时间较短(20.5 vs.13.4 月)。在多因素分析中,MVI与12个月OS(HR: 2.970, 95% CI: 1.276-6.917;P = 0.012)和ORR(HR: 2.906, 95% CI: 1.18-7.16;P = 0.020)相关。但12个月OS和ORR与性别、年龄、HBV病因、远处转移、Child-Pugh B和基线AFP水平没有关系(图2)。
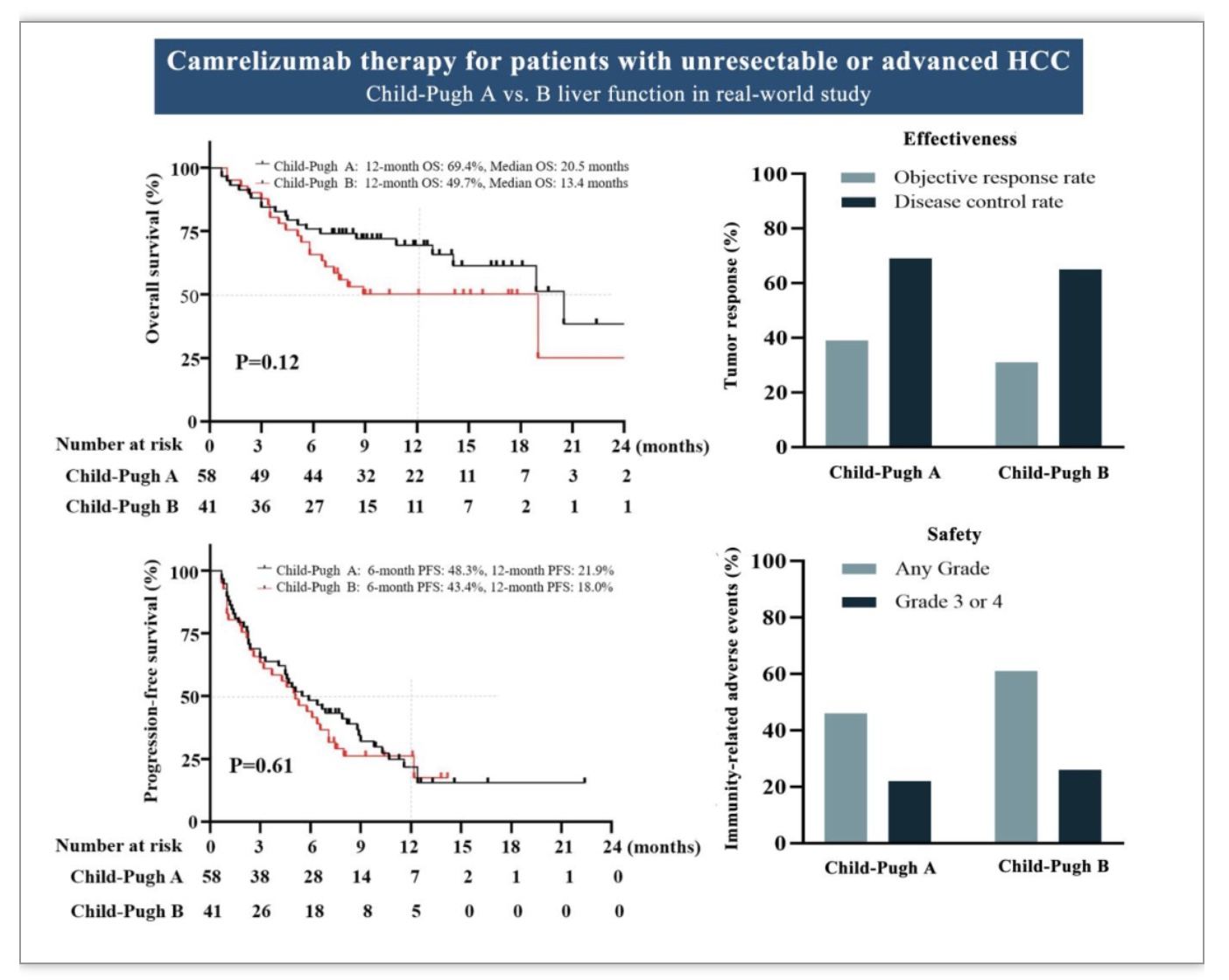
图1. 整体队列按Child-Pugh分期亚组的OS、PFS和不良反应
(图源:Li et al., Cancer Immunol Immunother, 2023)
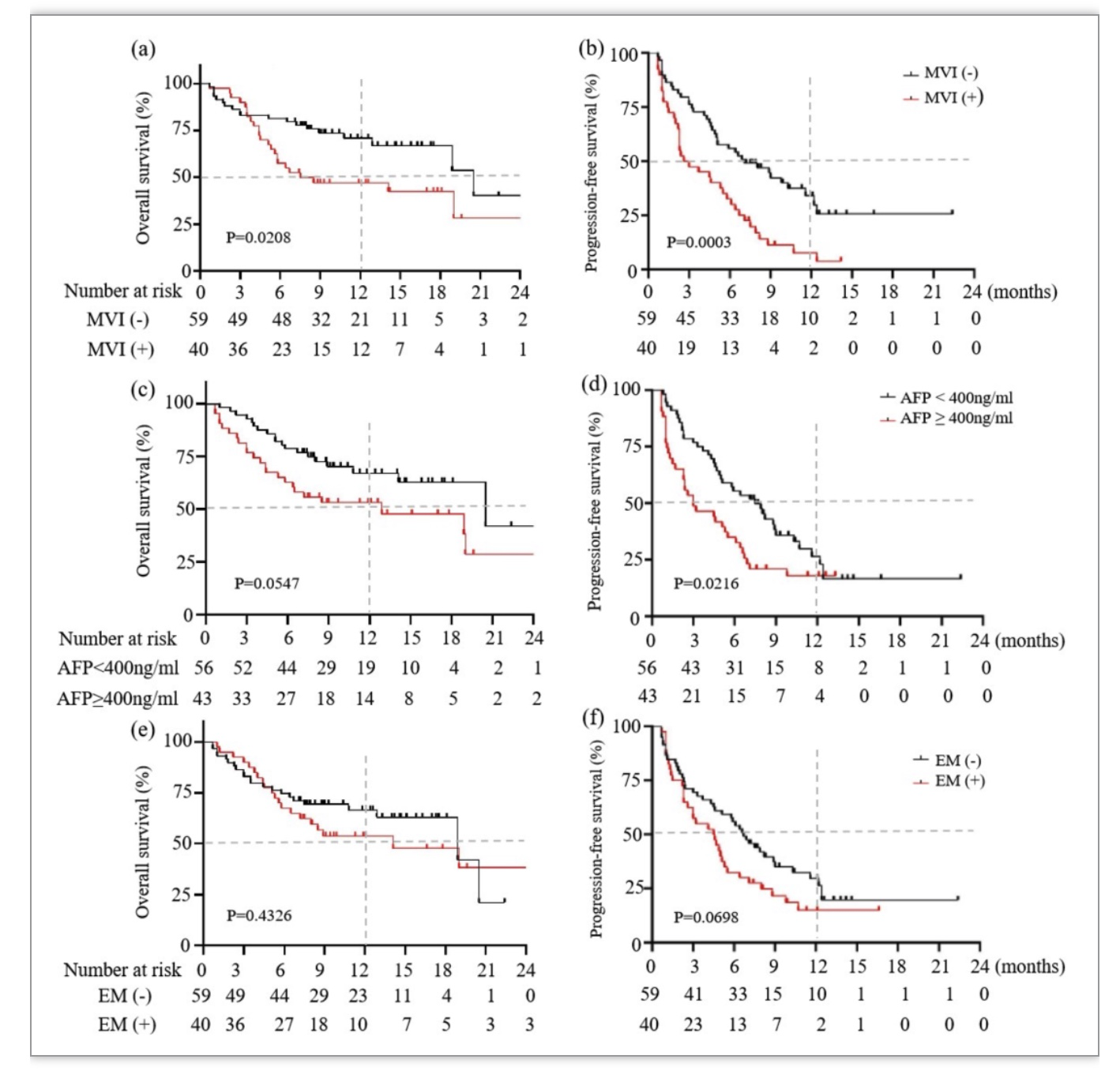
图2. 整体队列按大血管浸润(MVI)、AFP水平、肝外转移分组的OS和PFS
(图源:Li et al., Cancer Immunol Immunother, 2023)
52例(52.5%)患者至少出现一个免疫相关不良事件(immune-related adverse events, irAEs)。最常见irAEs是免疫血小板减少症(n = 28,28.3%),肝毒性(n = 16,16.2%),瘙痒(n = 15, 15.2%),腹泻(n = 15,15.2%),甲状腺功能减退(n = 15,15.2%),斑丘疹(n = 13,13.1%),皮肤毛细血管内皮增生(n = 11,11.1%),高血糖(n = 7,7.1%)和心脏毒性(n = 7,7.1%)。24.2%患者出现3/4级不良事件,肝毒性(n = 13,13.1%)和免疫性血小板减少(n = 9,9.1%)最常见,其次为垂体炎(n = 4,4.0%)和原发性肾上腺功能减退(n = 4,4.0%)。严重的AEs导致24例患者中断卡瑞利珠单抗治疗,其中6例患者经临床医生确定可能获益于继续治疗后重新开始治疗。在安全性方面,Child-Pugh B级患者任何AEs和3/4级AEs的发生率分别为61%和26.8%,与Child-Pugh A级患者无差异。

