急性早幼粒细胞白血病(APL)是急性髓系白血病(AML)的特殊亚型,约占所有AML 的5-10%[1]。APL 曾是一种极其凶险的疾病,患者常因严重出血导致早期死亡[2]。随着全反式维甲酸(ATRA)和砷剂(As2O3)的临床应用,APL 治疗疗效得到明显改善,治愈率显著提高,成为预后良好的白血病亚型[1, 3, 4]。虽然目前ATRA 与砷剂使用改善了APL 预后,但仍有少部分患者复发,并产生维甲酸和砷剂耐药患者[5, 6]。针对这部分难治耐药患者,亟需新的治疗方法改善疾病预后。
该工作发现在APL中,靶向组蛋白去乙酰化酶3(HDAC3)可以促进融合蛋白PML-RARα第394位赖氨酸发生乙酰化,促进PIAS1介导PML-RARα发生SUMO化,以及后续RNF4介导的泛素化,最终使PML-RARα通过泛素-蛋白酶体途径降解。尤为重要的是,靶向HDAC3在ATRA/ As2O3 耐药APL中具有降解PML-RARα,并促进白血病细胞分化和凋亡作用。该研究成果为治疗难治耐药APL提供了新靶点,为未来难治耐药APL的治疗新策略提供重要理论依据。

在APL 中,PML-RARα 招募N-CoR/SMRT 复合物和HDAC 抑制细胞分化[1, 7, 8]。有报道HDAC3 是与NCOR/SMRT/Sin3A/B 形成转录抑制复合物进而被PML-RARα 募集的最主要HDAC[9, 10]。目前针对APL 的治疗及机制研究都是围绕PML-RARα 开展,但是否能将HDAC3 作为一个治疗APL 的新靶点尚不清楚。目前针对PML-RARα 修饰调控的报道主要围绕在泛素化修饰上,HDAC3 作为调控乙酰化修饰的酶,是否可以通过调节PML-RARα 的乙酰化修饰影响APL 细胞的生物学功能仍不清楚。
研究人员通过数据库分析发现,APL病人中HDAC3与PML- RARα融合蛋白的表达存在相关性,体内外实验发现药理学抑制或者基因敲除HDAC3可以促进APL细胞分化和凋亡,缓解APL。分子生物学研究发现,靶向HDAC3可以促进PML-RARα融合蛋白的降解,从而达到缓解APL的效果。
作者对分子机制的进一步研究发现,PML-RARα融合蛋白的降解是通过泛素-蛋白酶体途径发生的,靶向HDAC3导致其对PML-RARα的去乙酰化作用减弱,PML-RARα在第394位赖氨酸发生乙酰化,促进PML-RARα与PIAS1的结合并产生SUMO化,进而与RNF4结合发生泛素化,最终通过泛素-蛋白酶体途径降解PML-RARα融合蛋白。
由于靶向HDAC3降解PML-RARα融合蛋白缓解APL的分子机制不同于ATRA和As2O3,作者猜想HDAC3可以成为治疗难治耐药APL的潜在靶点,于是在ATRA和As2O3耐药临床病例的原代细胞以及细胞系中验证发现靶向HDAC3确实可以促进耐药细胞的分化和凋亡。同时在多种动物模型中包括PDX模型中验证了靶向HDAC3对难治耐药APL的治疗作用。
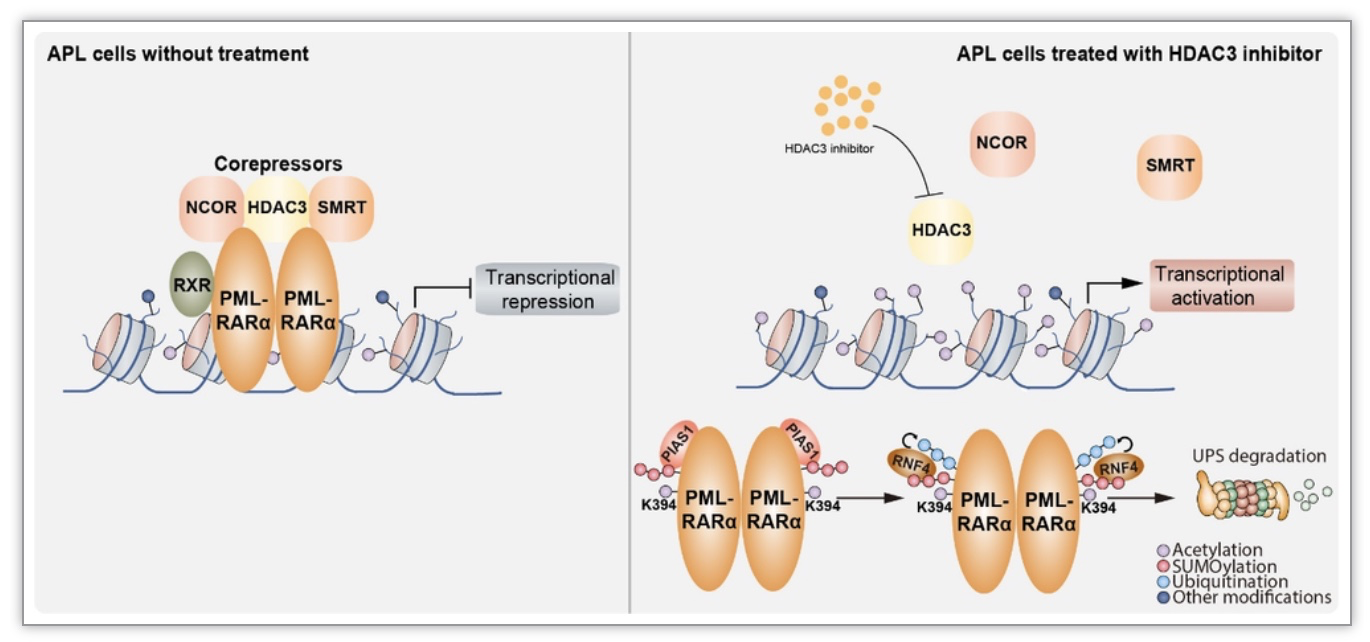
图1. 靶向HDAC3治疗难治耐药APL的分子机制
(图源:Bo Dai, et al. Cell Death Differ, 2023 )

