CRISPR-Cas13是一类新型靶向RNA编辑的基因编辑系统。目前该系统已经广泛应用于RNA敲除、修饰、单碱基编辑及RNA病毒检测等研究领域[1]。相较于DNA编辑,RNA编辑不会永久改变基因组遗传信息,对RNA进行精准编辑,在疾病治疗的安全性和临床转化方面有更强的优势。2017年,张锋团队利用dPspCas13b蛋白融合脱氨酶ADAR2,开发出第一代RNA碱基编辑器,REPAIR (RNA Editing for Programmable A to I Replacement)[2],可实现高效的A > I RNA单碱基编辑。2019年,为了解除脱氨酶ADAR2的底物偏好性,张锋团队基于REPAIR系统进行优化,构建了RESCUE(RNA Editing for Specific C to U Exchange) 系统[3]。该系统在保留原有的A > I编辑能力外,还增加了C > U的RNA单碱基编辑方式。
RESCUE显著地扩展了CRISPR工具能够靶向的范围,除了致病位点修复外,磷酸化、糖基化和甲基化等翻译后修饰调节许多蛋白的活性和功能的位点都可作为编辑的靶标。但作为一种潜在的基因疗法,ADAR2酶过表达产生的脱靶风险值得关注。首次揭示了RESCUE碱基编辑器在转录组水的具象化脱靶效应。研究发现在RESCUE系统表达的细胞中,存在大量的A > I与C > U RNA脱靶SNVs (Single nucleotide Variants),这些SNVs造成了mRNA, circRNA与miRNA的差异表达,同时还会引起mRNA, circRNA 与miRNA 互作网络的变化, 存在潜在的安全风险, 提示仍然需要对RESCUE系统进行降低RNA脱靶事件的优化,同时也为RNA碱基编辑器的脱靶优化研究提供了理论基础。

本研究发现RESCUE RNA编辑器表达的细胞中,circRNA的表达出现了差异性变化(图1I, J)。circRNA是一类重要的调控RNA,可直接调控mRNA与miRNA的表达[4]。为了进一步探究RESCUE介导的RNA编辑细胞中转录组水平的变化,本研究选择了两个内源靶点CTNNB1与KRAS作为编辑位点,同时设置非靶向编辑实验组 (图1A)。分别对靶向编辑组与非靶向编辑组的细胞,进行了circRNA, miRNA与mRNA的测序分析。首先,本研究对两种RNA脱靶SNVs进行了统计,结果显示, 在CTNNB1编辑细胞中出现了2075个A > I与1424个C > U脱靶SNVs; 在KRAS编辑细胞中出现了2256个A > I与1549个C > U脱靶SNVs; 在非编辑细胞中出现了1747个A > I与1202个C > U脱靶SNVs (图1B)。RESCUE介导的RNA编辑产生了大量的A > I与C > U脱靶SNVs。
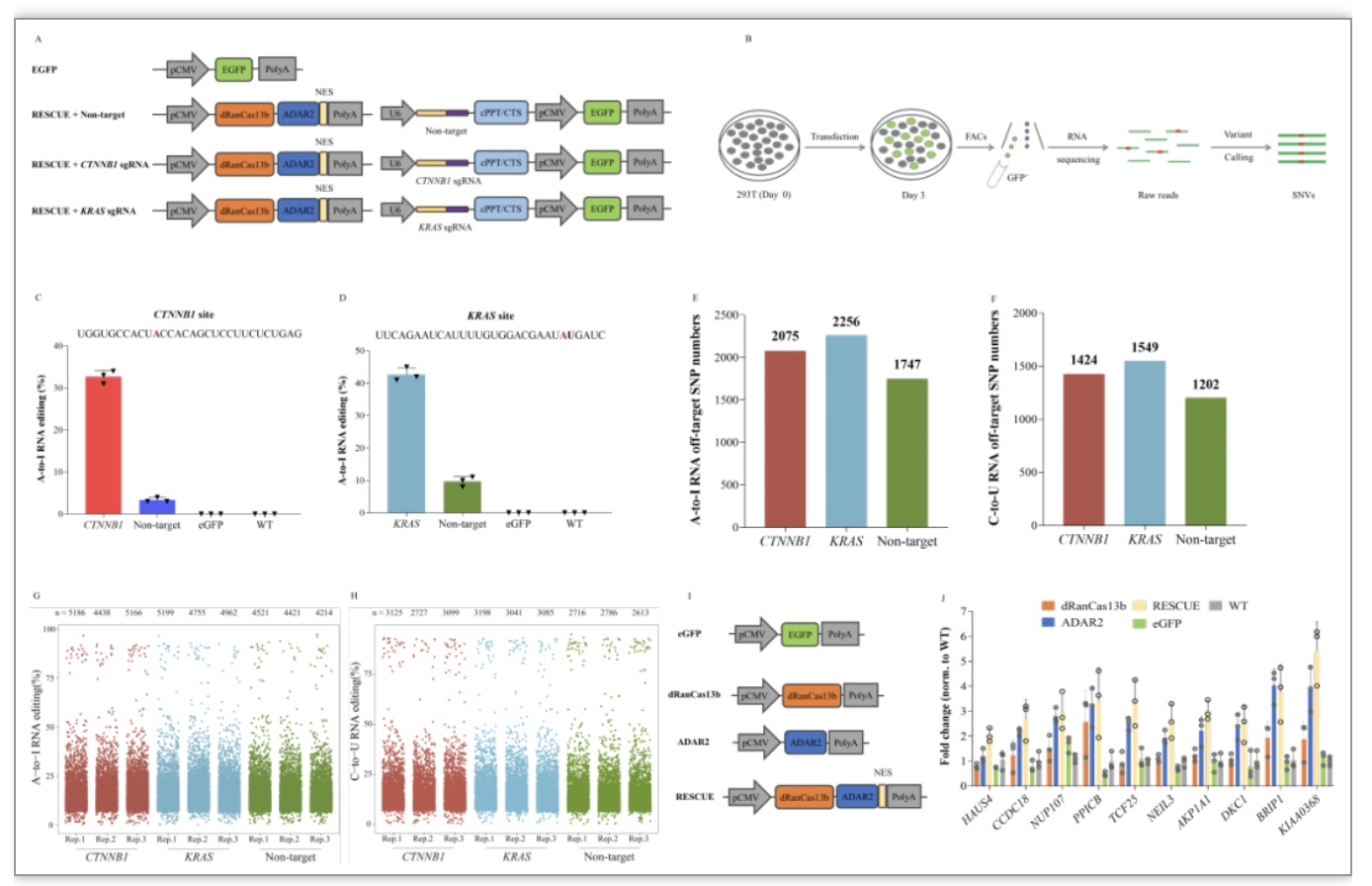
图1 RESCUE编辑细胞中产生的RNA脱靶SNVs
(图源:Li G, et al., J Mol Cell Biol, 2023)
然后,本研究对mRNA,cirRNA与miRNA的表达量进行了差异分析,并将差异表达的mRNA,cirRNA与miRNA与脱靶SNVs进行了关联分析。分析结果显示,RESCUE介导的RNA编辑细胞中出现了大量差异表达的mRNA (DEGs, Differential Expressed Genes),cirRNA (DECs, Differential Expressed CircRNAs)与lncRNA (DELs, Differential Expressed lncRNAs),并且部分差异表达的RNA与脱靶SNVs相关。以mRNA为例,本研究发现在CTNNB1、KRAS与非靶向编辑细胞中分别出现了878, 665, 790个DEGs, 其中有730个DEGs与A > I脱靶SNVs相关,1934个DEGs与C > U脱靶SNVs相关(图2)。本研究分别对脱靶SNVs与DEGs, DECs与DELs做了关联分析统计。RESCUE编辑器产生的脱靶SNVs影响了mRNA, cirRNA与lncRNA的差异表达。
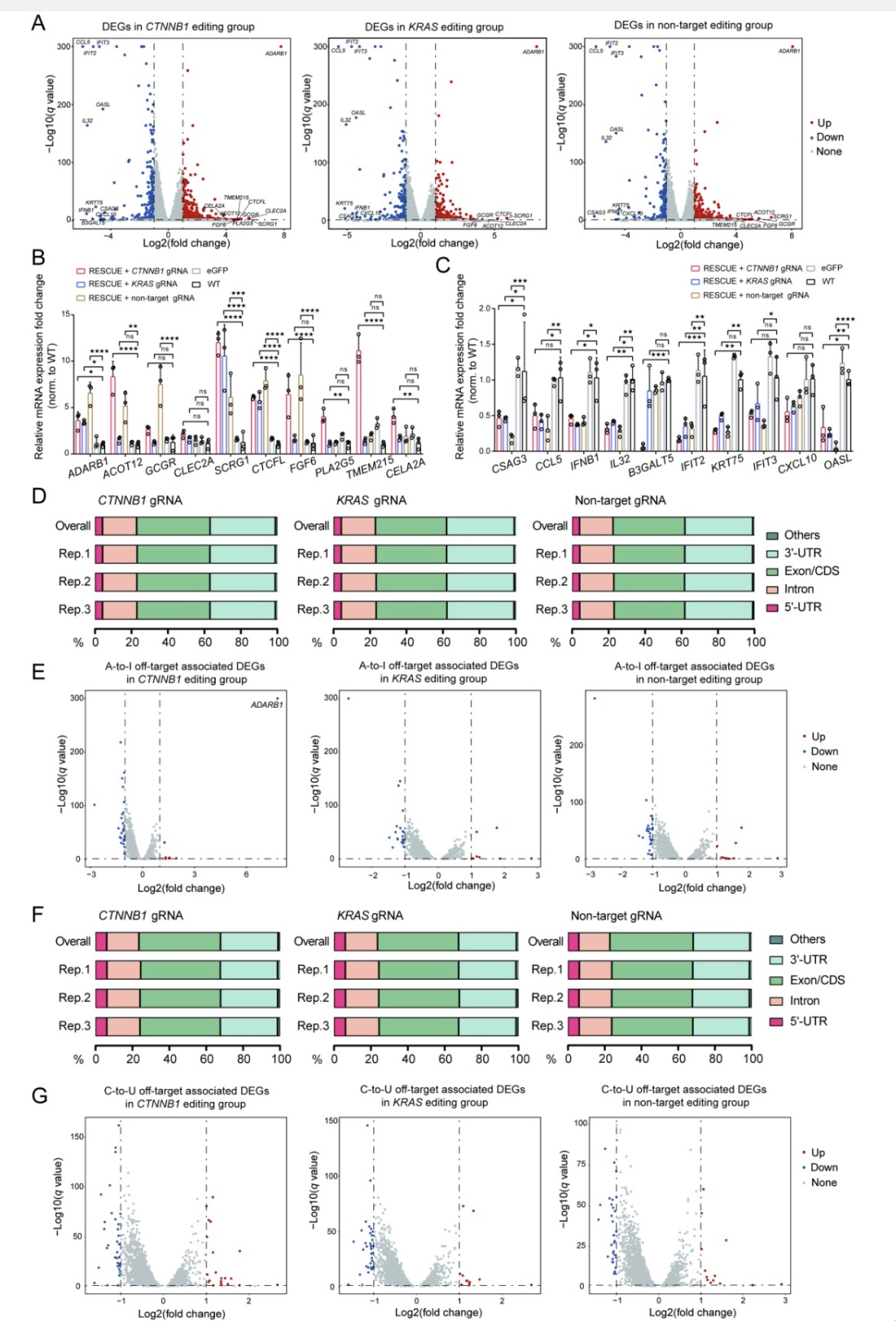
图2 RESCUE编辑细胞中脱靶SNVs与mRNA的差异表达变化
(图源:Li G, et al., J Mol Cell Biol, 2023)
最后,本研究对差异SNVs影响的DEGs, DECs与DELs进行了关联分析。结果显示,以CTNNB1编辑细胞的统计结果为例,在CTNNB1编辑细胞中存在38个A > I脱靶SNVs关联的DECs-DEGs变化,14个DELs-DEGs变化,1个DEL-DEC变化与1个DEL-DEC-DEG变化;50个C > U脱靶SNVs关联的DECs-DEGs变化,22个DELs-DEGs变化,1个DEL-DEC变化与1个DEL-DEC-DEG变化(图3)。RESCUE编辑器产生的脱靶SNVs影响了mRNA, cirRNA与lncRNA的互作网络。
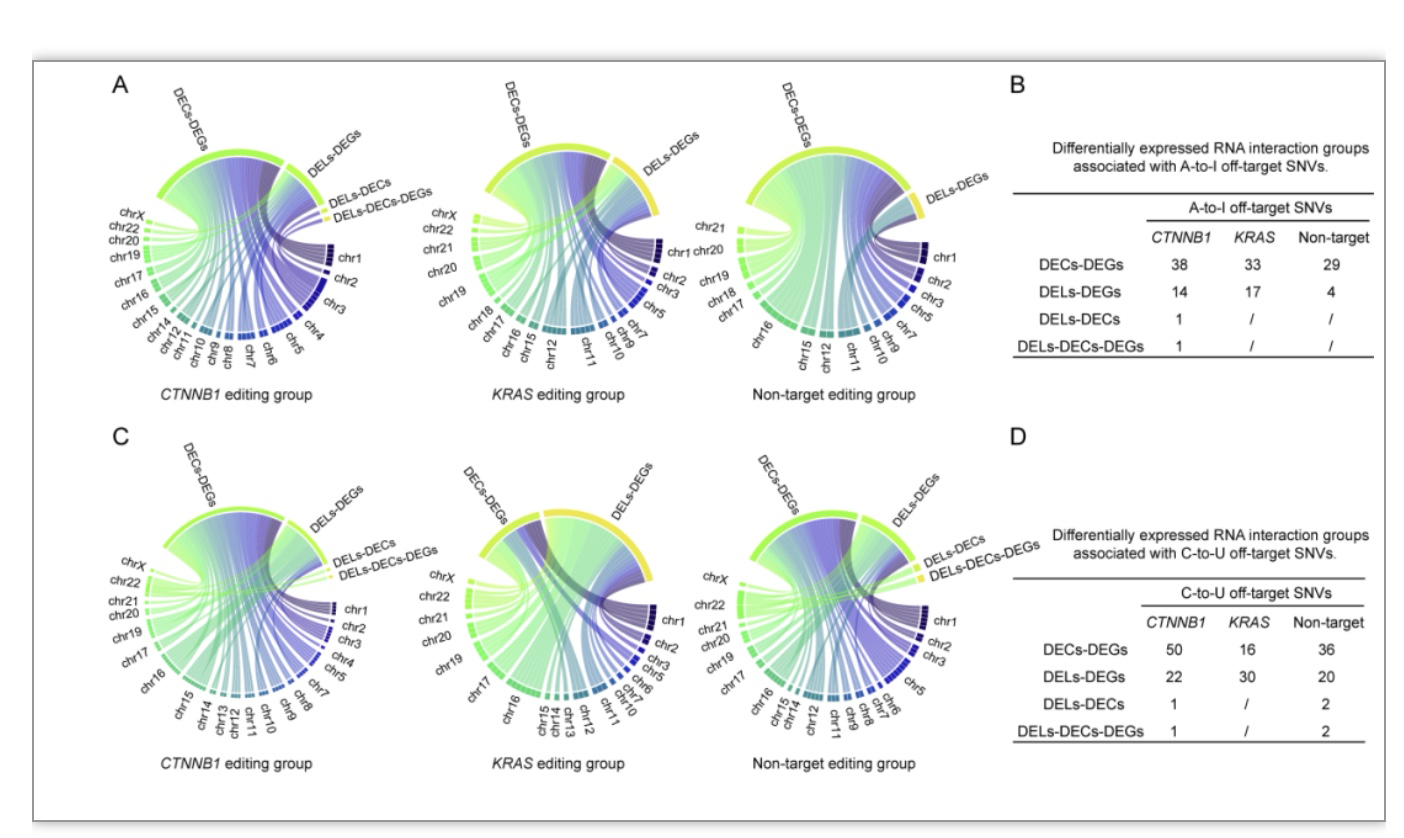
图3 RESCUE编辑细胞中脱靶SNVs与差异表达RNA的互作变化
(图源:Li G, et al., J Mol Cell Biol, 2023)

