
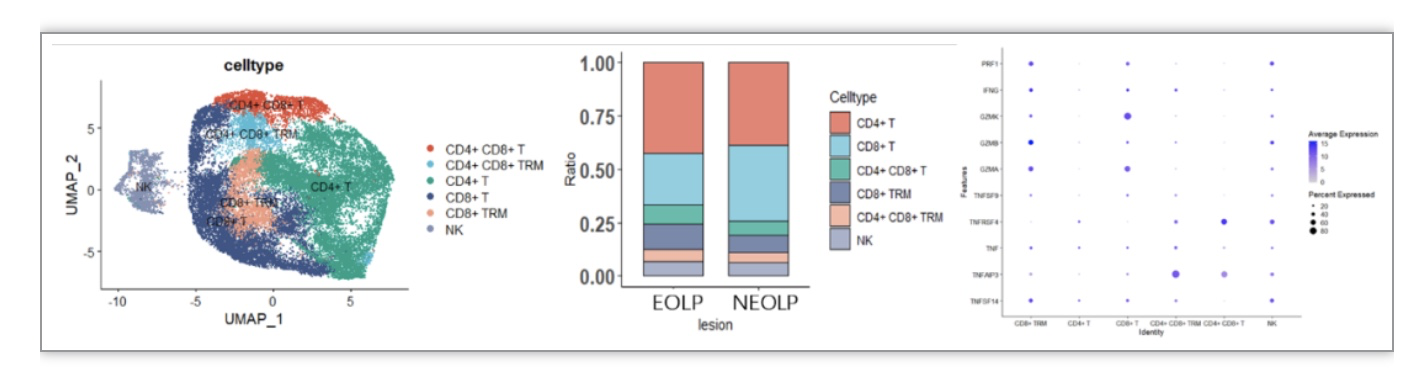
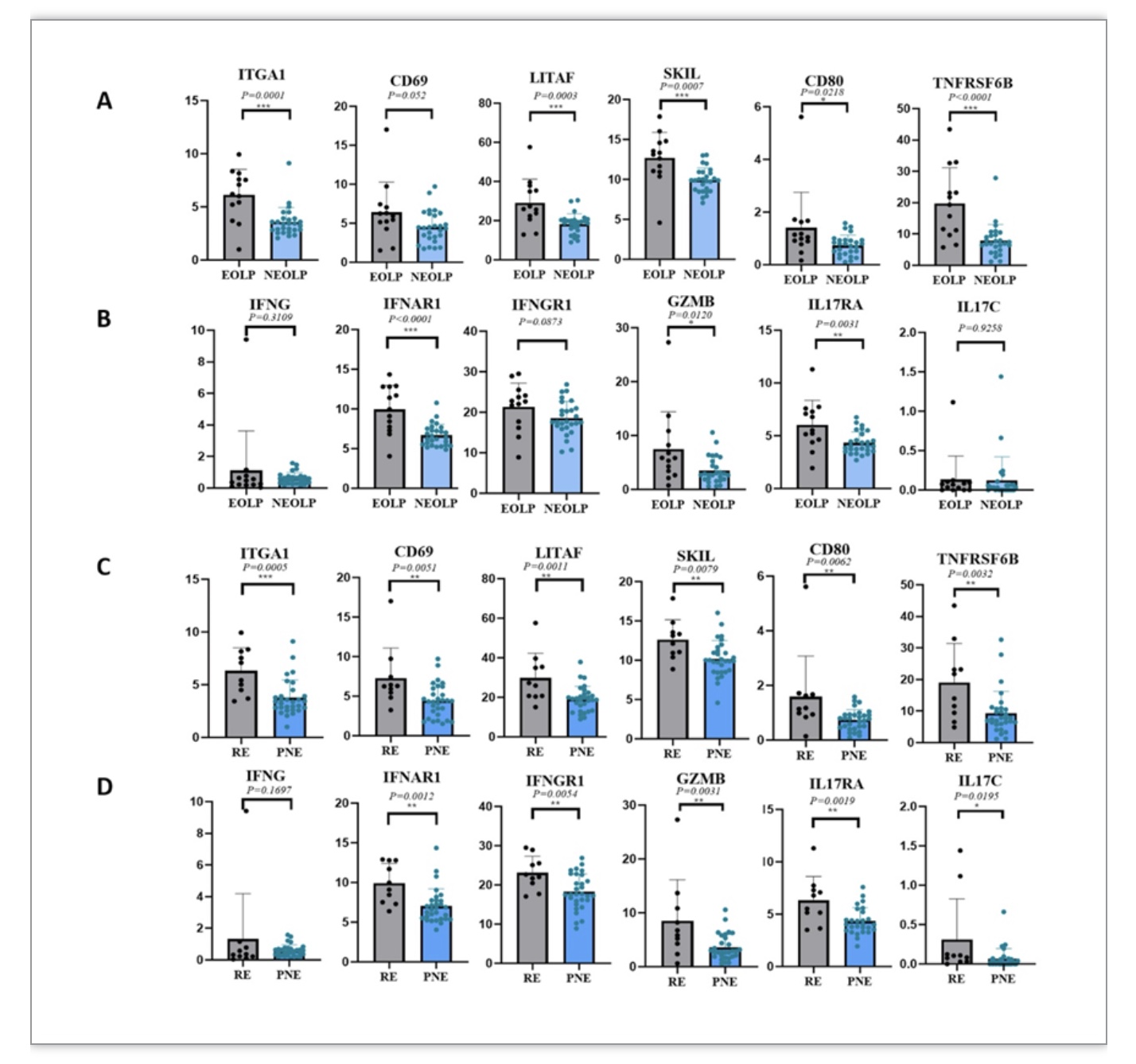
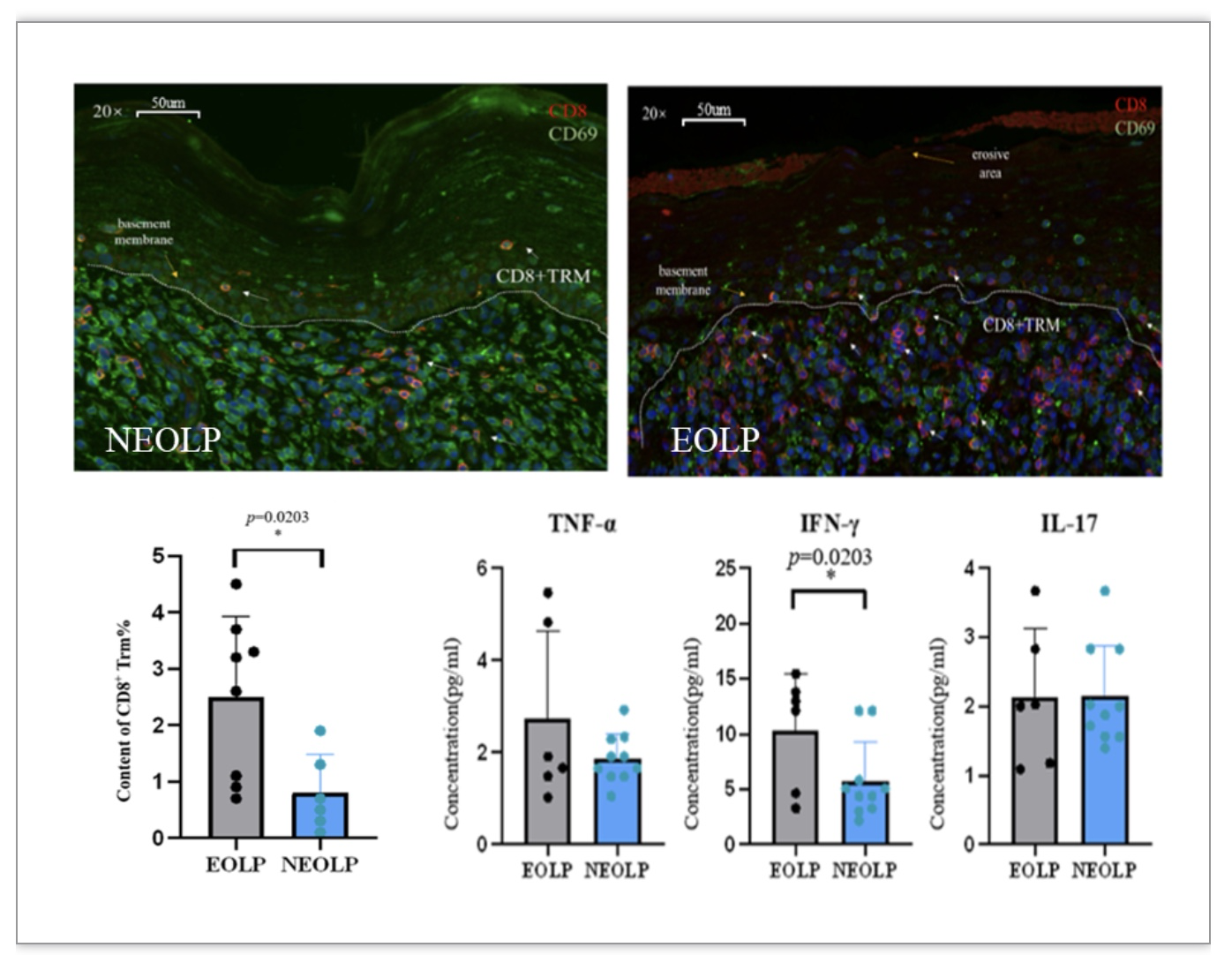
本研究深入探究了CD8+ 组织驻留性记忆T细胞(CD8+ Trm)在口腔扁平苔藓(OLP)疾病发展中的作用机制。研究发现,在糜烂型OLP患者口腔黏膜组织中,CD8+ Trm细胞表现出糜烂部位积累、增多并表现出活化状态,与炎症相关的细胞因子表达显著增加。这些结果揭示了CD8+Trm细胞在OLP疾病发展中的重要作用,为理解疾病演变机制提供了新的线索。
本研究为进一步研究口腔黏膜炎症性疾病提供了重要线索。未来可以继续探究CD8+ Trm细胞与其他免疫细胞之间的相互作用网络,以及它们在炎症调控中的协同效应。最终,基于这些研究成果,有望制定OLP患者的精准诊疗策略,提供更好的临床管理。

