传统药物开发面临诸多问题,如无法开发“不可成药”靶点、容易引起药物脱靶效应和不良反应、容易导致药物耐药等[1,2]。为了解决上述问题,靶向蛋白降解技术(TPD)应运而生,目前较为成熟的TPD是PROTAC和LYTAC技术[3]。其中,PROTAC技术主要是降解胞内蛋白,无法降解膜蛋白或胞外蛋白[4]。LYTACs分子是将靶蛋白的抗体等通过化学键与细胞表面的溶酶体穿梭受体(LTR)结合,经网格蛋白介导内吞进入细胞内,利用溶酶体实现细胞膜或胞外靶蛋白降解[1,5]。肿瘤细胞表面的CD24与巨噬细胞表面的Siglec-10结合可以帮助肿瘤细胞逃逸巨噬细胞的吞噬[6]。目前针对CD24的治疗方法无法改变CD24的表达,只能在短时间内实现信号抑制。葡萄糖氧化酶(GOx)能够通过催化葡萄糖生成H2O2“饥饿”细胞来实现肿瘤治疗[7]。因此,将靶向CD24的LYTACs负载GOx不仅可以提高GOx体内靶向性促进“饥饿”治疗效果,还可以通过降解CD24激活巨噬细胞对肿瘤细胞的吞噬杀伤。该研究利用细胞内固有的溶酶体降解方式,开发了一种基于纳米球的溶酶体靶向嵌合体(LYTACs)降解系统,该技术为肝癌的靶向治疗提供了有效的药物加载平台和模块化降解策略,可以在降解肝癌细胞膜或胞外靶蛋白的同时负载肿瘤治疗药物实现协同增强抗肿瘤效果。

在这项研究中,研究人员以两亲性多肽为载体,通过对多肽修饰N乙酰半乳糖胺(GalNAc)实现多肽与肝细胞膜表面去唾液酸糖蛋白受体(ASGPR)的结合,同时两亲性多肽的自组装产生了纳米球结构。利用该纳米颗粒与EGFR抗体的交联成功实现了EGFR靶向LYTAC分子的合成,并通过实验证实了GalNAc修饰的纳米球作为溶酶体靶向嵌合体的一部分,可以成功内吞细胞膜表面的EGFR蛋白并转运到溶酶体中降解。

图1 ASGPR驱动的LYTACs纳米分子介导膜蛋白通过溶酶体实现胞内降解
(图源:Kun Wang, et al., Advanced Science, 2023)
以此平台为基础,研究人员进一步将CD24单链抗体与纳米球交联,成功完成了CD24蛋白降解体系的开发。通过该体系不仅实现了肝癌细胞表面CD24蛋白的降解,而且通过抑制CD24/Siglec-10信号通路解除了巨噬细胞与肝癌细胞之间的免疫抑制,增强了巨噬细胞对肝癌细胞的吞噬杀伤能力。
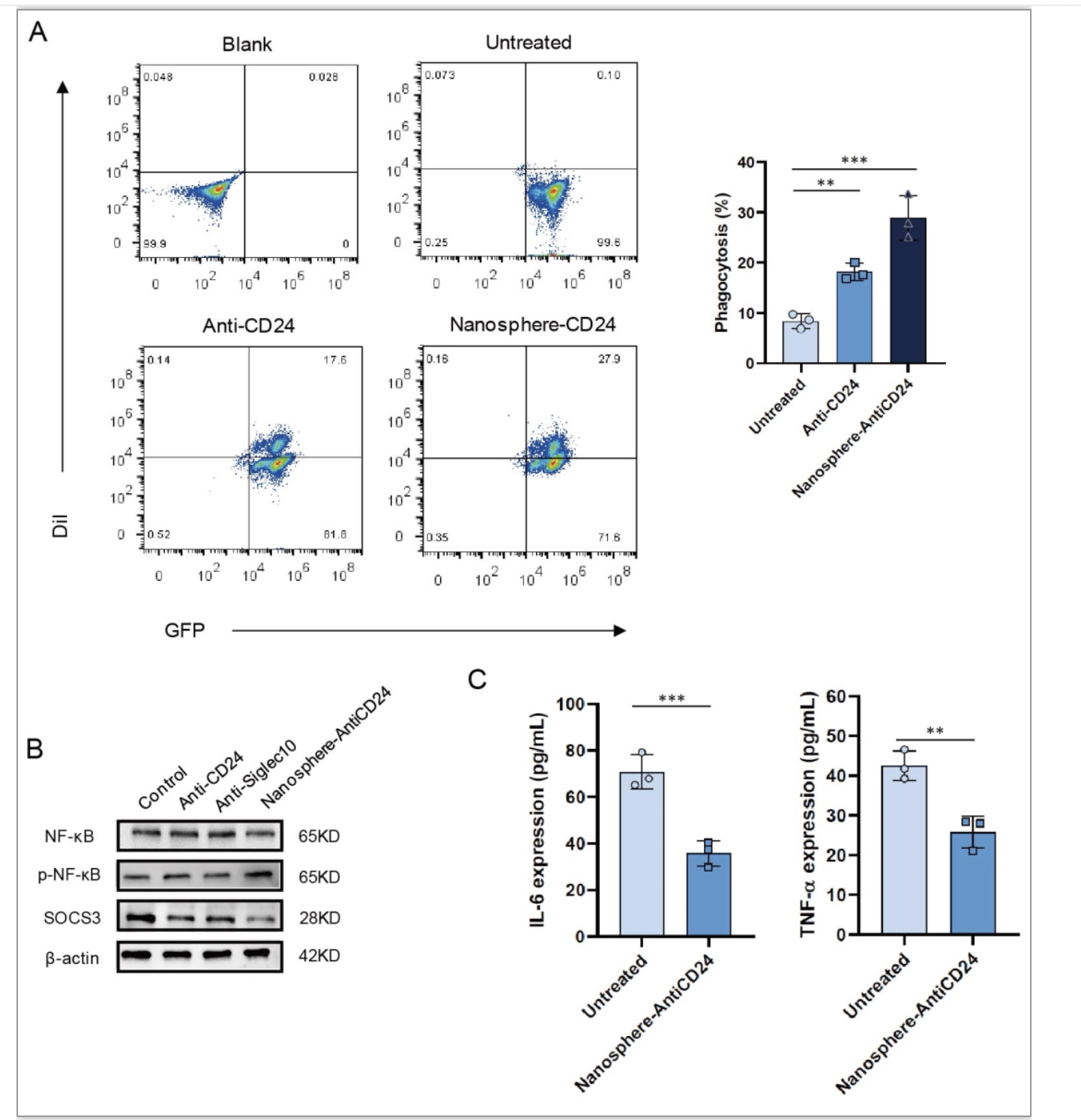
图2靶向CD24 的LYTACs纳米分子通过降解CD24蛋白阻断CD24/Siglec-10信号通路,增强巨噬细胞对肝癌细胞的吞噬杀伤能力
(图源:Kun Wang, et al., Advanced Science, 2023)
最后,研究人员通过该平台实现了葡萄糖氧化酶GOx的搭载,成功制备了靶向CD24的GOx-LYTACs纳米分子。该纳米分子不仅能抑制肝癌细胞在体外的生长,而且能在体内促进CD24蛋白降解,激活肿瘤微环境中的肿瘤相关巨噬细胞(TAMs)向“M1”型极化,显著抑制肝癌细胞在小鼠体内的生长。
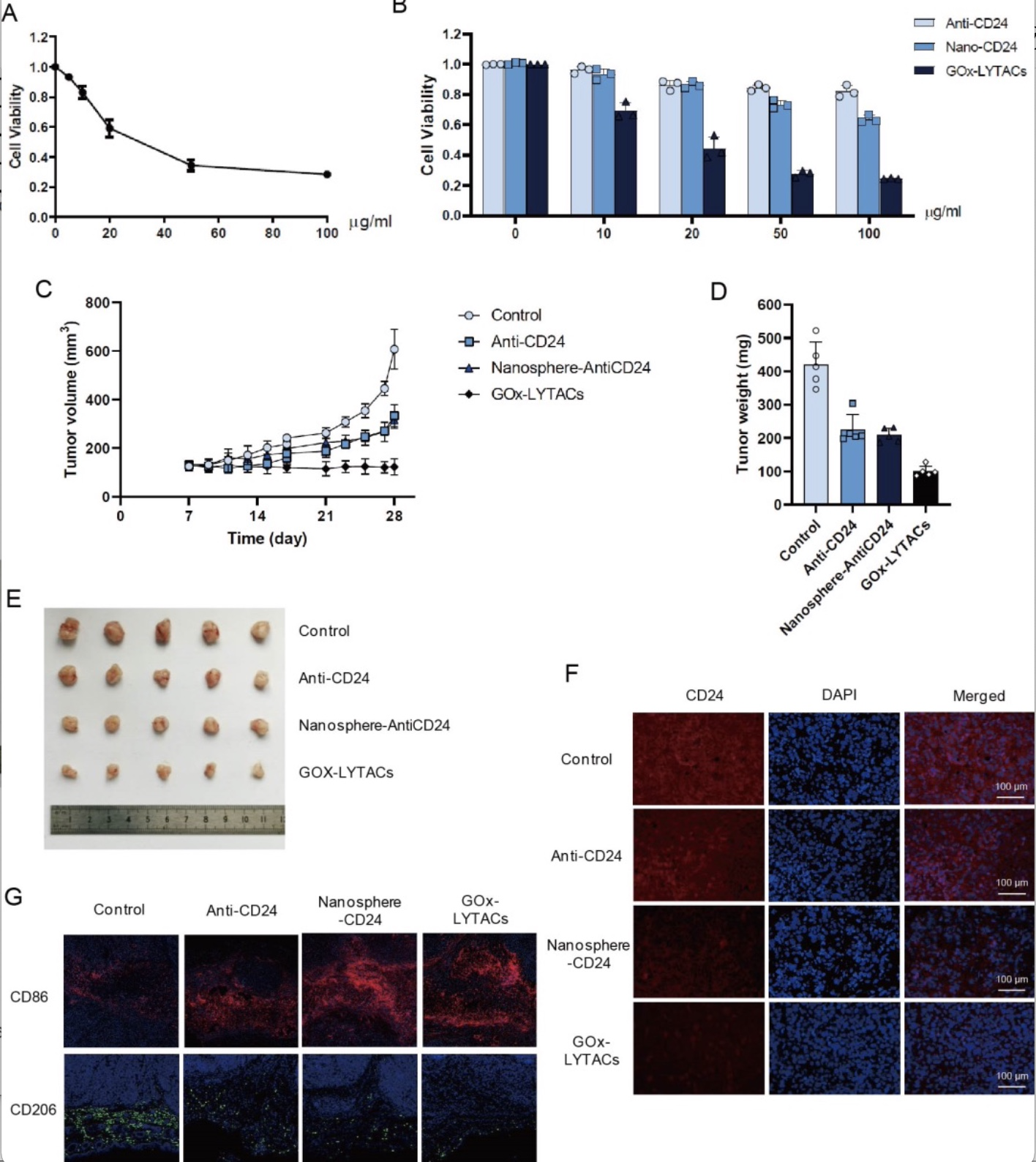
图3 ASGPR介导的靶向CD24 的LYTACs纳米分子联合GOx抑制肝癌细胞在体内生长
(图源:Kun Wang, et al., Advanced Science, 2023)

