黑色素瘤来源于表皮黑素细胞的恶性转化,增殖迅速、易侵袭转移,是最致死的恶性肿瘤。临床上首诊患者过半数已发生转移,导致治疗十分棘手。尽管现有的靶向治疗和免疫治疗等新治疗方法可分别通过干预关键突变癌基因BRAF和激活抗肿瘤免疫发挥显著的治疗效果,并在改善患者预后方面较传统化疗方法取得了突破性进展,但由于免疫治疗反应率低和两种治疗方法均在一段时间后不可避免发生耐药等问题,严重限制药物治疗效果和患者预后的提高[1]。因此,进一步阐明黑色素瘤发展的分子机制,并寻找可抑制肿瘤生长和免疫治疗抵抗的药物靶点,对于黑色素瘤患者预后的改善具有重要意义。该研究揭示了长寿基因家族成员SIRT7 通过特异性激活未折叠蛋白反应兼顾维持肿瘤细胞存活和增强免疫逃逸、促进黑色素瘤进展的重要作用和机制,提出SIRT7是抑制黑色素瘤生长和增敏PD-1单抗免疫治疗的潜在关键靶点。

实体瘤在生长和转移过程中会面临营养缺乏、缺氧和酸性环境等多种外源性应激[2];同时由于癌基因突变驱动下肿瘤细胞不可控增殖,细胞内错误折叠蛋白过度堆积也会诱发内源性应激[3]。肿瘤细胞内保护性信号的适应性激活会帮助肿瘤细胞抵御各种内外源性应激压力、促进肿瘤的发生发展。长寿基因SIRTs家族是一组依赖NAD+发挥调控功能的蛋白,对于营养缺乏和能量水平降低高度敏感,在维持细胞稳态和调控细胞命运中扮演重要角色[4]。
在本研究中,研究人员聚焦应激状态下肿瘤细胞内SIRTs家族的表达和功能变化,首先发现在SIRTs家族7个成员中,位于细胞核内的SIRT7在能量缺乏等应激下表达水平和活性的升高最为显著,TCGA SKCM等数据库的生物信息学分析显示与SIRT7表达显著相关的分子主要富集在应激反应和未折叠蛋白反应通路(图1),这表明SIRT7可能是黑色素瘤内重要的应激保护信号分子。为了进一步回答这个问题,研究者分别在体外和体内水平构建沉默SIRT7的细胞和荷瘤动物模型,证实抑制SIRT7表达不仅加剧应激状态下黑色素瘤细胞的死亡,还能够显著抑制黑色素瘤在体内水平的生长(图2)。值得注意的是,SIRT7的保护性作用在营养剥夺、缺氧和内质网应激诱导等多种不同应激条件下均具有显著表现,表明SIRT7在抵御内外源性应激压力方面具有一定普适性意义。
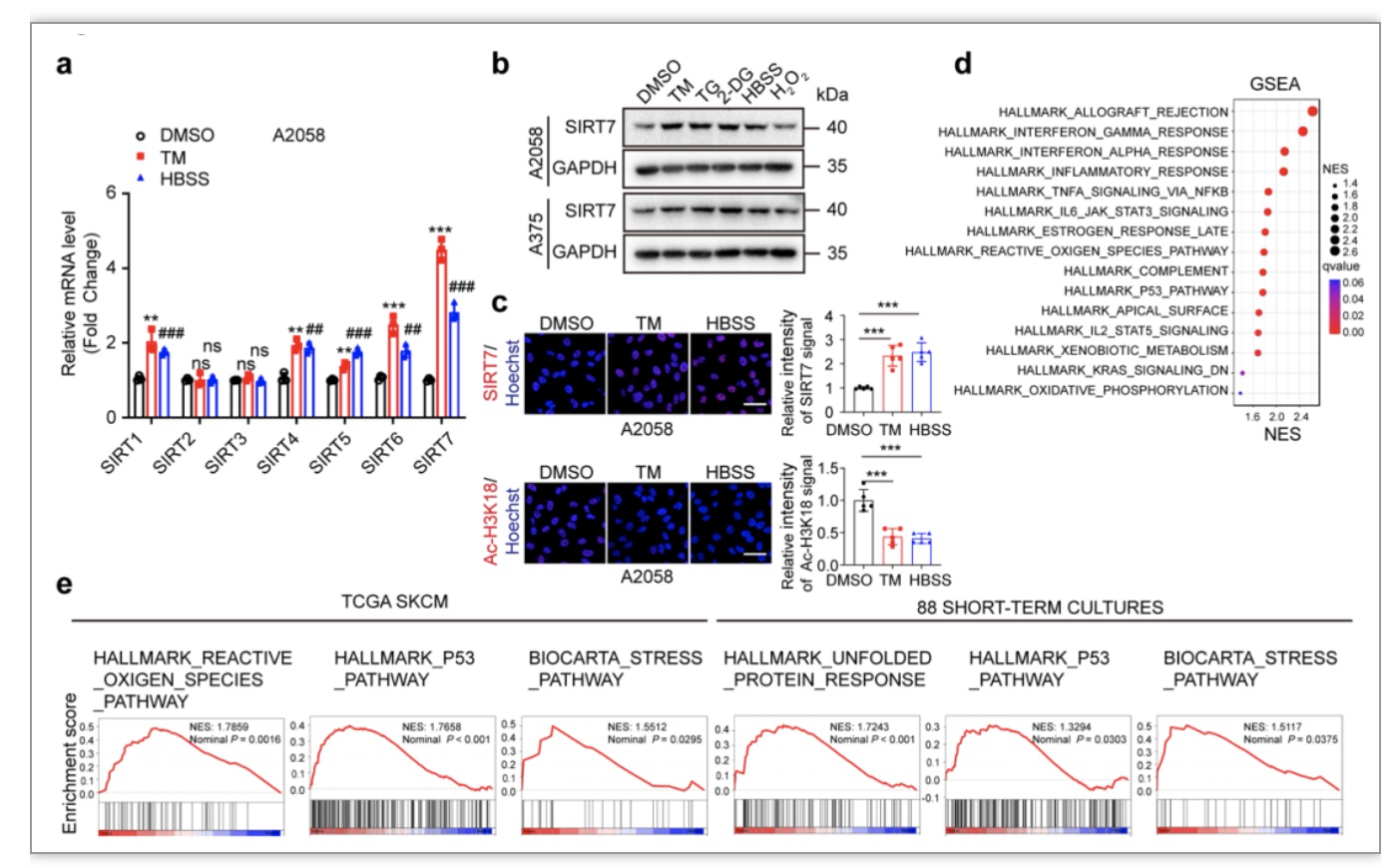
图1. SIRT7在能量缺乏等应激下表达水平和活性的升高最为显著
(图源:Yi et al., STTT. 2023)
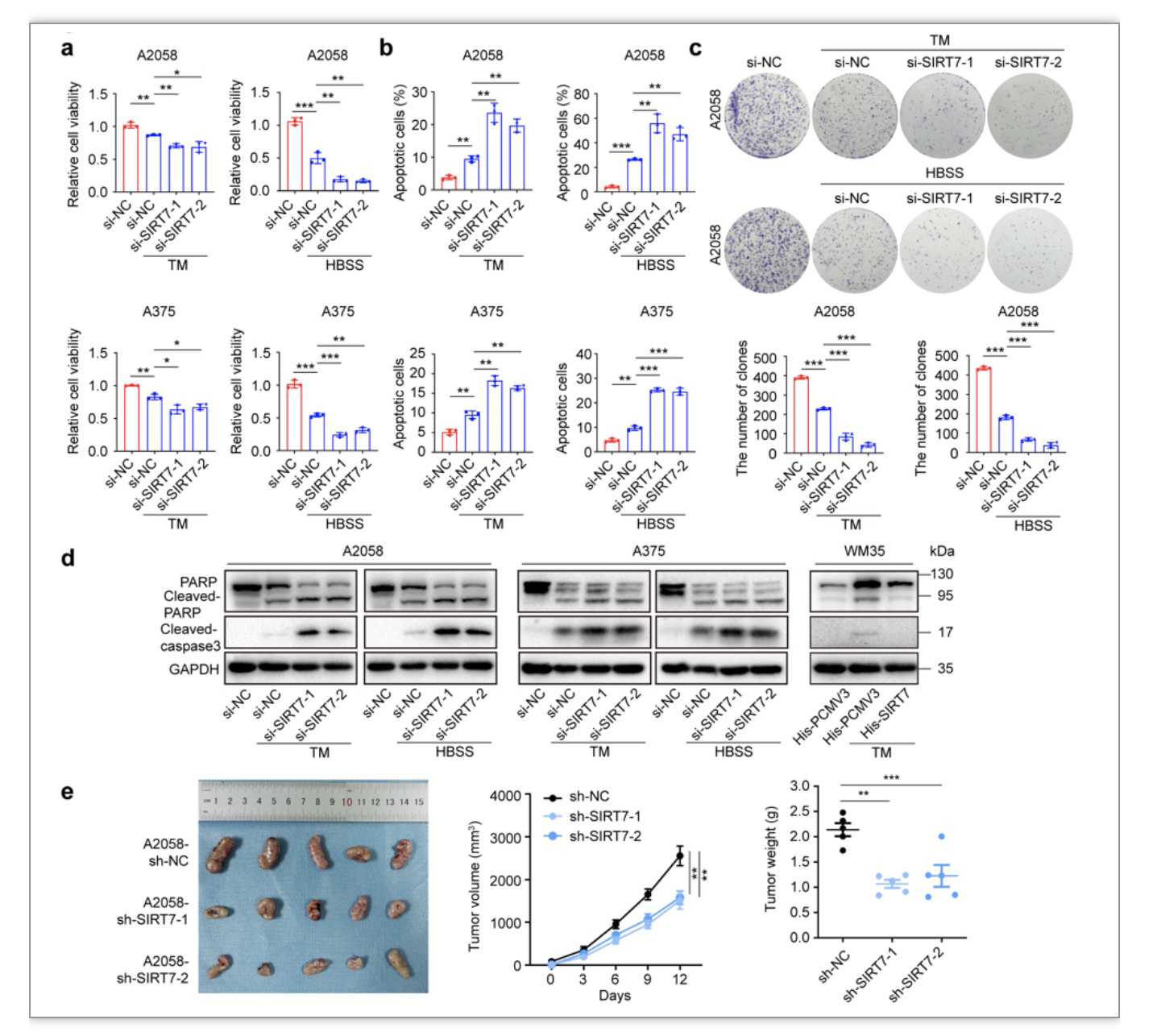
图2. 抑制SIRT7 表达显著削弱黑色素瘤细胞抵御应激压力的能力
(图源:Yi et al., STTT. 2023)
了进一步明确SIRT7作为应激保护分子的具体机制,研究者通过细致研究和筛选,发现SIRT7可以选择性激活未折叠蛋白反应三条分支中的IRE1α-XBP1轴,在肿瘤微阵列芯片(TMA)中进行免疫组织化学染色方法也发现SIRT7与XBP1s具有显著正相关性(图3a-d)。更为重要的是,SIRT7对XBP1下游ERK信号通路(图3e-f)和促增殖炎性因子TNFα、IL-8和VEGFα均有显著促进作用(图4)。研究者进一步挖掘SIRT7特异性活化IRE1α-XBP1轴的分子机制,发现SIRT7和重要转录因子SMAD4在细胞内存在直接相互作用,通过去乙酰化修饰促进其泛素化修饰和蛋白质降解,进一步解除对于IRE1α的转录抑制(图5)。基于上述实验证据,提出SIRT7通过其去乙酰化酶活性调控SMAD4-IRE1α-XBP1转录信号轴特异性激活未折叠蛋白反应,赋予黑色素瘤细胞抵御应激压力的能力,维持细胞存活。
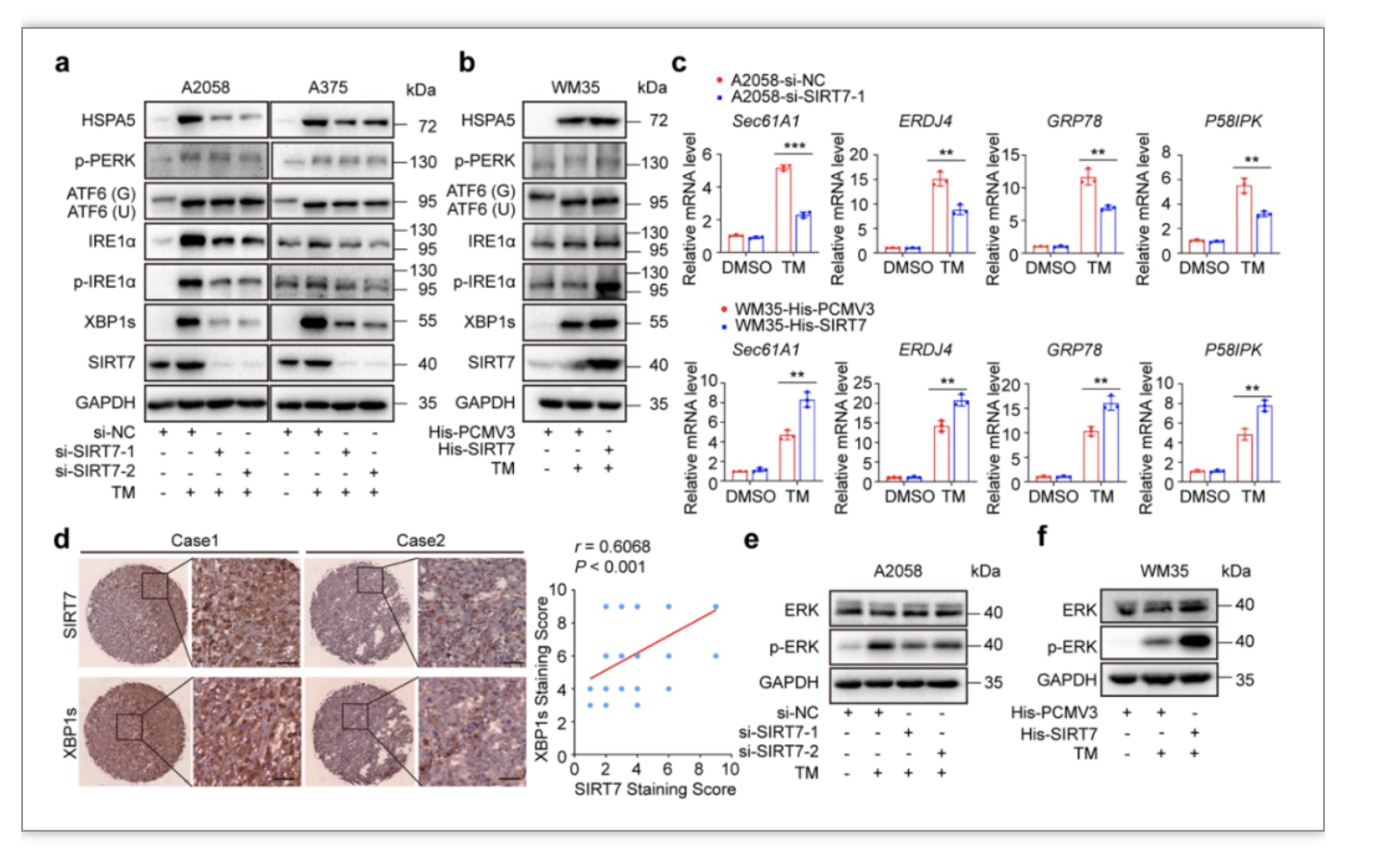
图3. SIRT7特异性活化未折叠蛋白反应中的IRE1α-XBP1轴
(图源:Yi et al., STTT. 2023)
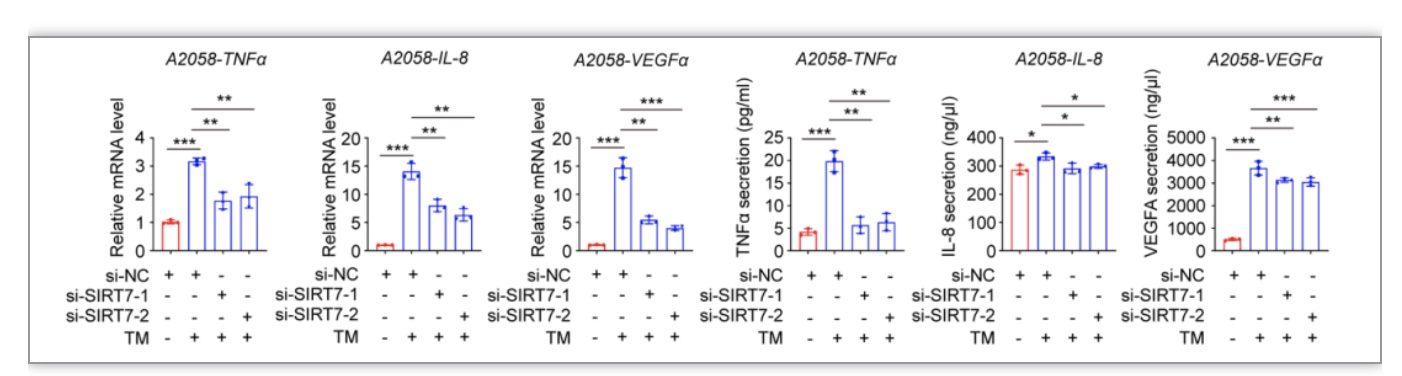
图4. SIRT7促进IRE1α-XBP1轴下游促增殖炎症因子的表达和分泌
(图源:Yi et al., STTT. 2023)
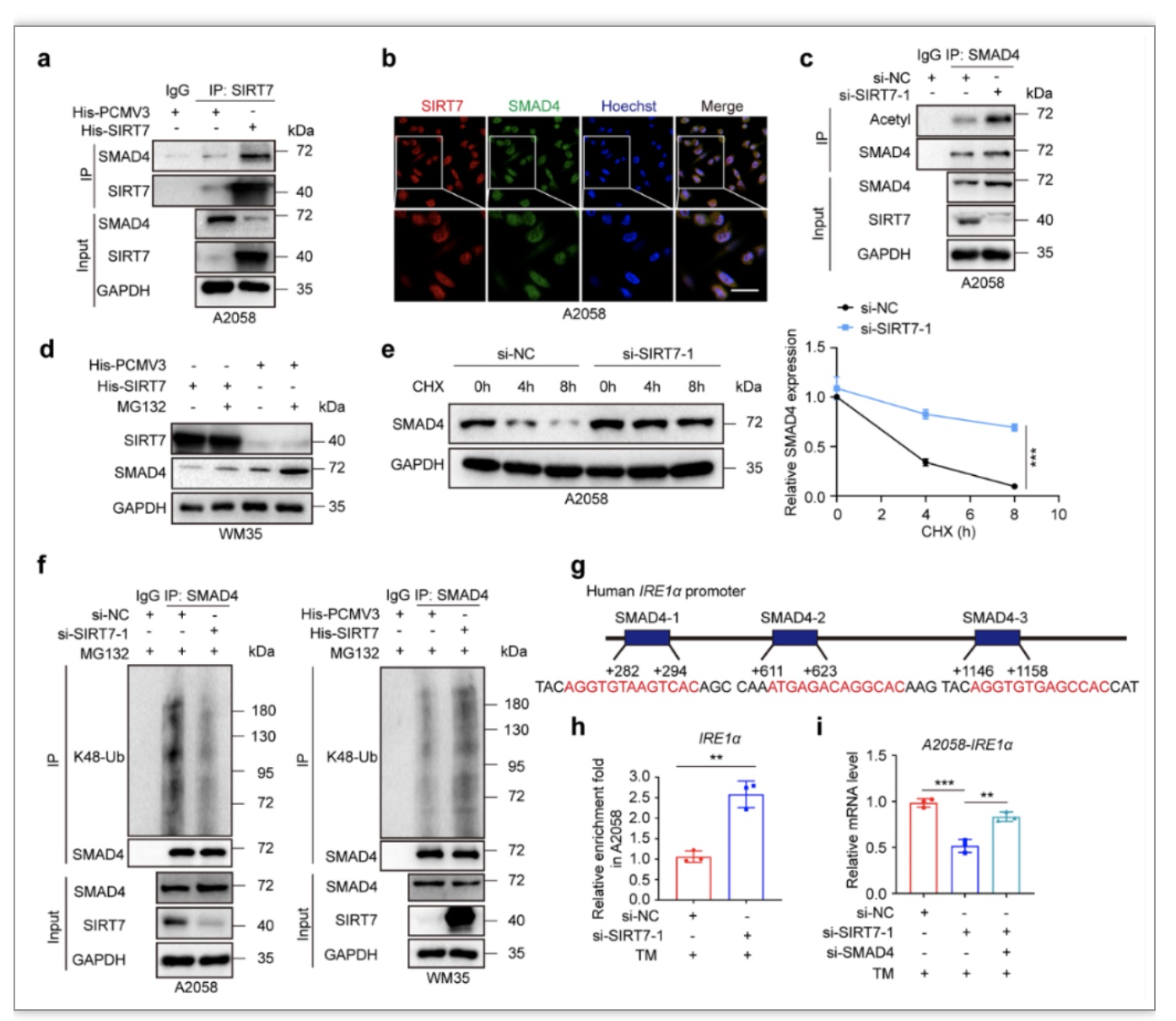
图5. SIRT7通过去乙酰化修饰SMAD4促进其降解并激活IRE1α转录
(图源:Yi et al., STTT. 2023)
此外,研究者在具有完全免疫系统的小鼠荷瘤模型中意外发现抑制肿瘤内SIRT7表达可以促进瘤团内CD8+T细胞浸润,流式细胞术也证实可以促进CD8+T细胞的杀伤性功能,通过抗体注射系统清除CD8+T细胞可显著回复沉默SIRT7对黑色素瘤生长的抑制性作用(图6),表明SIRT7还兼具调控肿瘤免疫微环境的重要功能。PD-L1是表达在肿瘤细胞膜表面重要的免疫检查点分子,可以和CD8+T细胞膜表面PD-1等配体结合抑制其免疫功能,其持续性表达是介导肿瘤免疫逃逸和免疫治疗抵抗的重要机理。研究者发现SIRT7可以在应激条件下调控PD-L1的转录水平,且该调控作用依赖于XBP1s结合到PD-L1启动子区域发挥的转录激活作用。SIRT7表达水平升高通过选择性激活IRE1α-XBP1轴促进膜表面PD-L1持续性表达,介导免疫逃逸。最后证实,联合抑制SIRT7表达和使用PD-1单抗治疗可以协同抑制黑色素瘤生长,且伴随瘤团内CD8+T细胞等免疫细胞浸润增多和功能活化(图7),表明靶向SIRT7是增加PD-1治疗敏感性的有效策略。
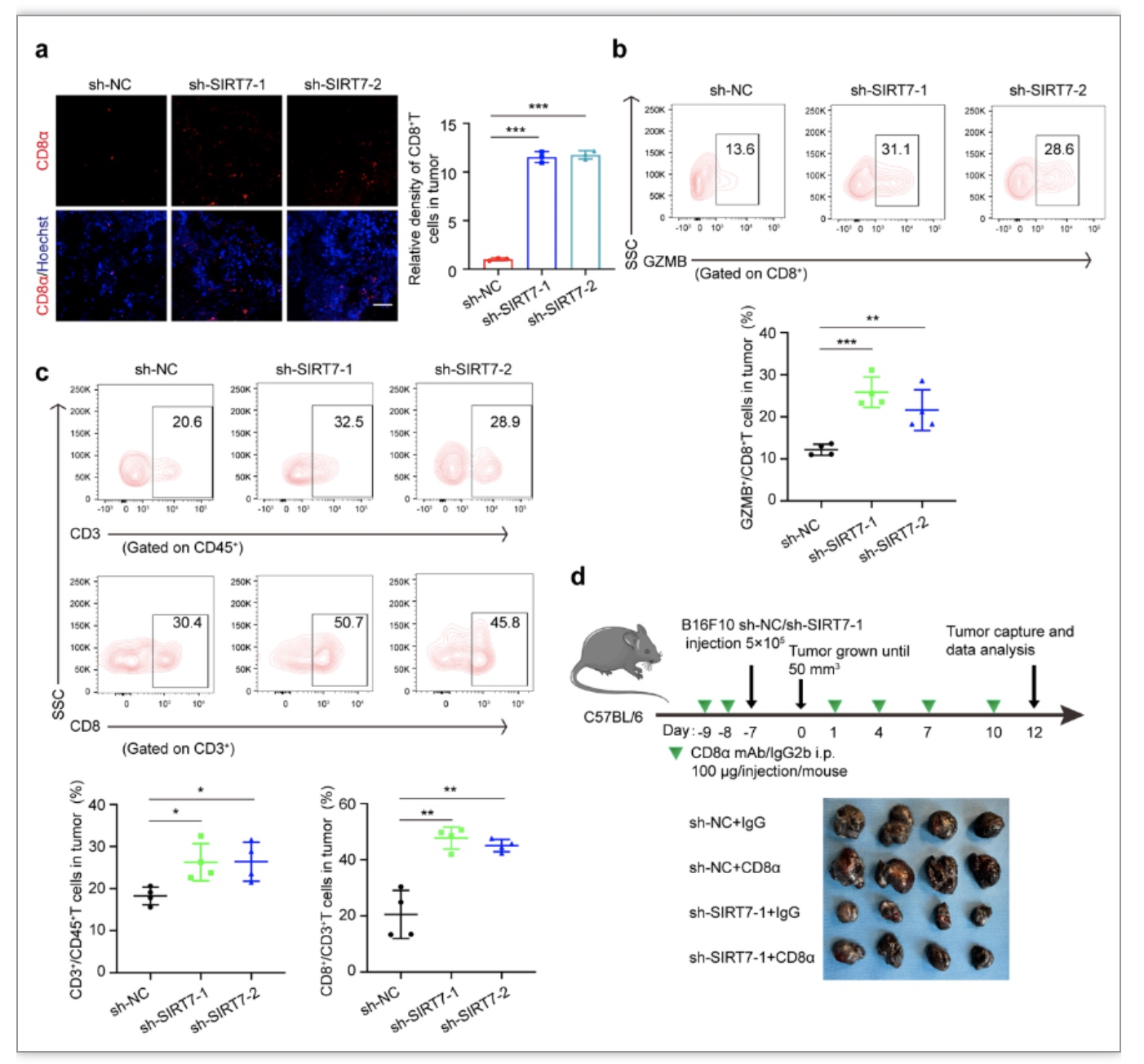
图6. SIRT7抑制CD8+T浸润和活化介导黑色素瘤生长
(图源:Yi et al., STTT. 2023)
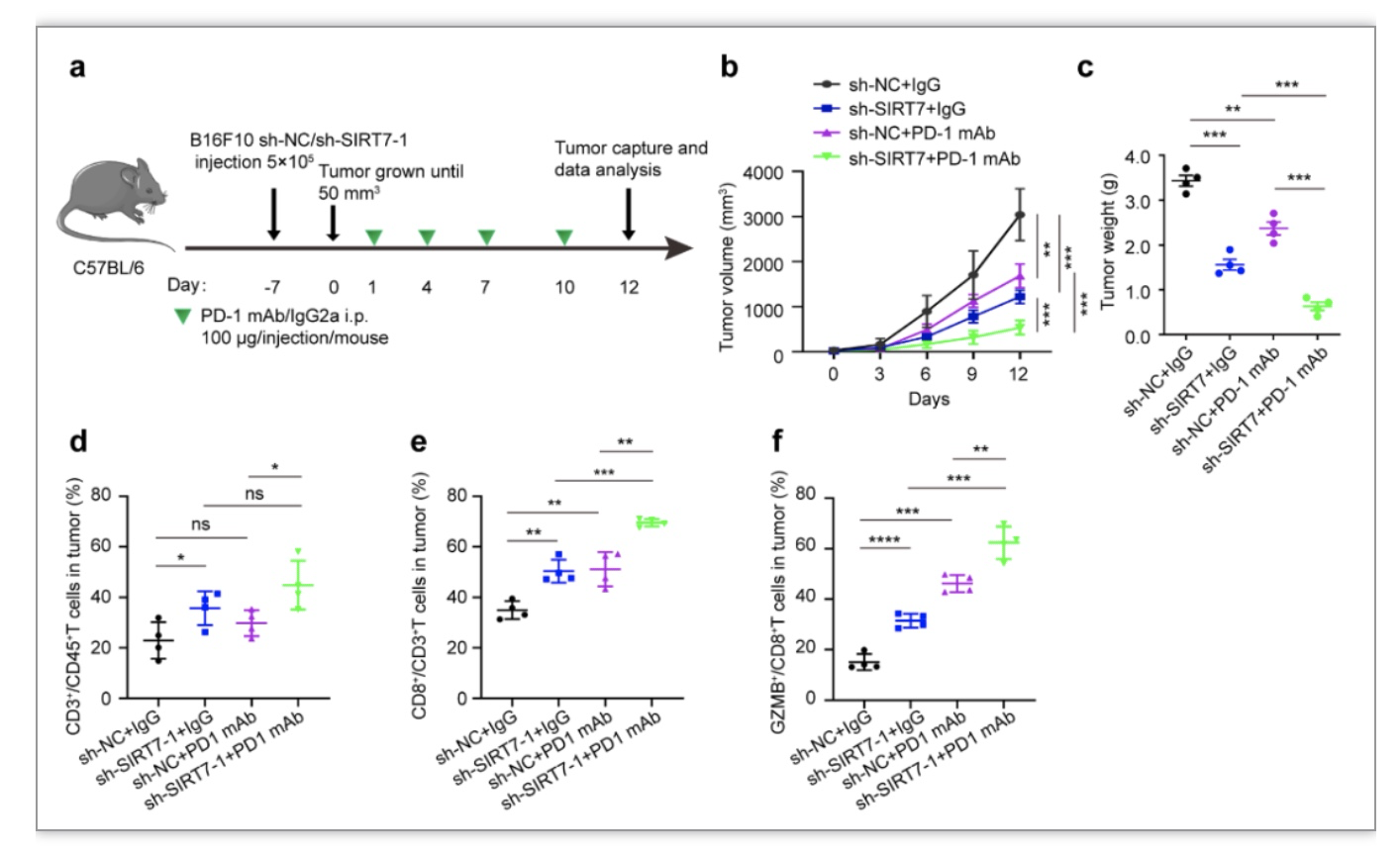
图7. 联合抑制SIRT7表达和使用PD-1单抗治疗可以协同抑制黑色素瘤生长
(图源:Yi et al., STTT. 2023)

图8. SIRT7在黑色素瘤发展和免疫逃逸中的作用机制模式图
(图源:Yi et al., STTT. 2023)

