肝纤维化(Liver fibrosis)可由多种慢性肝脏疾病如病毒性肝炎、非酒精性脂肪性肝炎、酒精性肝病等造成,并可进一步引发肝硬化甚至肝癌[1, 2]。目前,肝纤维化过程中引起肝损伤的机制尚不明确,临床上也缺乏针对性的预防及治疗手段。因此,探索并明确肝纤维化发病进展及对肝细胞造成损伤的机制,是寻找肝纤维化新防治靶点的重要途径,也是为临床提供肝纤维化新防治手段的重要基础。该研究报道了在肝纤维化过程中肝细胞线粒体自噬调控铁死亡的新机制,并揭示了线粒体膜蛋白FUNDC1通过与GPx4互作从而促进该过程发生的新的调控作用,为肝纤维化过程中肝损伤的防治提供了新的理论依据。

肝细胞死亡是肝纤维化过程中造成肝损伤的关键过程,而最新研究表明,肝细胞铁死亡是肝纤维化过程中导致肝损伤的重要机制[3]。铁死亡是一种铁依赖的、脂质过氧化导致的细胞程序性死亡方式[4]。此外,铁死亡也被报道与线粒体自噬密切相关,但具体机制不清[5]。研究人员通过对GEO数据库中的相关数据(GSE55747)进行分析发现,与对照组相比,肝纤维化患者肝脏组织中与自噬(Autophagy)、铁死亡(Ferroptosis)、线粒体自噬(Mitophagy)及氧化磷酸化相关的基因具有显著性差异,且GSVA分析提示线粒体自噬与铁死亡之间具有相关性。
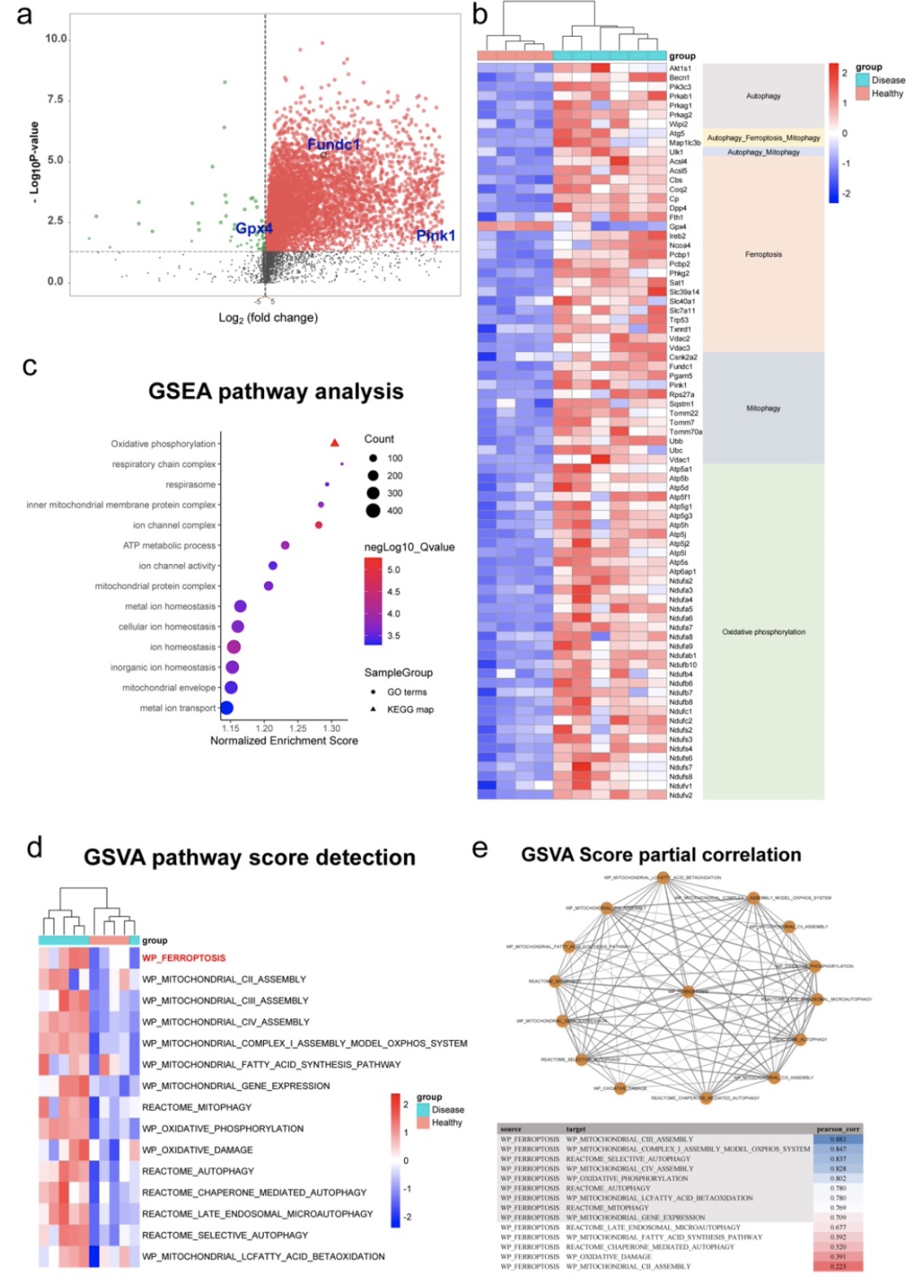
图1 GEO数据库挖掘提示肝纤维化过程中线粒体自噬及铁死亡过程具有显著改变,且两者具有相关性
(图源:Bi, et al., J Adv Res, 2023)
接着,通过检测发现肝纤维化患者及小鼠模型的肝脏组织中线粒体自噬相关蛋白FUNDC1的表达均呈显著上调。课题组进一步通过进一步利用FUNDC1全身敲除小鼠构建肝纤维化模型验证发现,FUNDC1敲除可降低小鼠死亡率、改善肝脏纤维化并减轻肝功能损伤。而FUNDC1过表达则可加重线粒体损伤及肝细胞损伤,提示FUNDC1对肝细胞损伤具有一定保护作用。
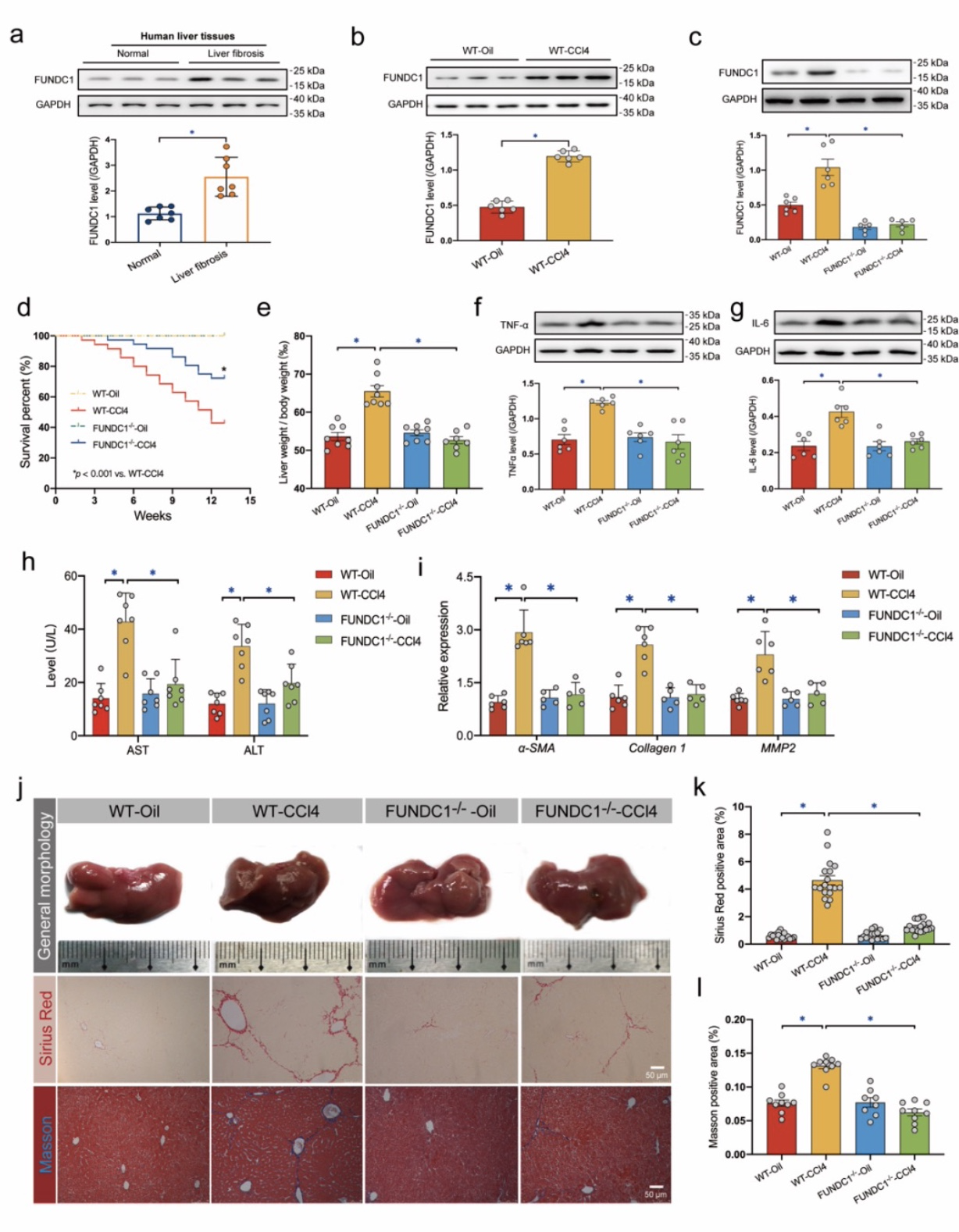
图2 肝纤维化中FUNDC1表达增高,而FUNDC1敲除可保护肝脏损伤
(图源:Bi, et al., J Adv Res, 2023)
然后,通过进一步检测铁死亡相关蛋白的表达、脂质过氧化情况及脂质沉积等指标,我们发现FUNDC1可显著促进铁死亡的发生。并且铁死亡诱导剂Erastin可逆转FUNDC1低表达对肝细胞的保护作用,提示FUNDC1对肝纤维化的调控作用与铁死亡过程相关。通过质谱筛选我们发现FUNDC1主要影响铁死亡的抑制蛋白GPx4的表达(FUNDC1可导致GPx4表达降低),并且GPx4的抑制剂RSL3可显著逆转FUNDC1敲低对铁死亡的抑制作用及对线粒体及肝细胞的保护作用,进一步说明FUNDC1对铁死亡的调控作用可能由GPx4介导。
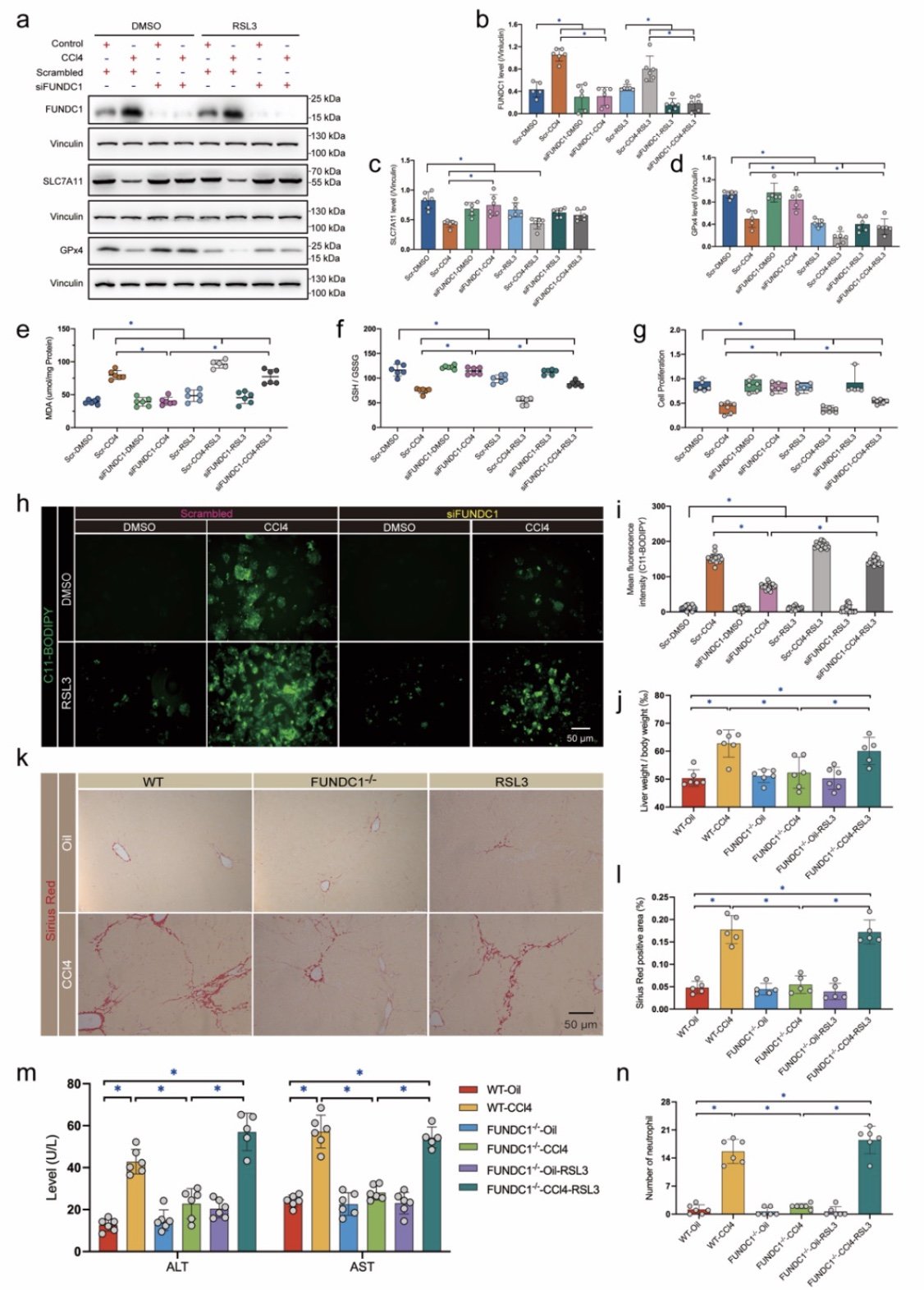
图3 FUNDC1通过降低GPx4含量引发肝细胞铁死亡及肝脏损伤
(图源:Bi, et al., J Adv Res, 2023)
作为线粒体自噬受体蛋白,FUNDC1引起GPx4的表达降低是否与线粒体自噬相关?于是研究人员通过进一步通过检测肝纤维化中线粒体自噬相关蛋白的表达变化(Parkin、BNIP3的表达也呈显著升高趋势),并将Parkin、BNIP3及FUNDC1分别敲低后检测GPx4的含量发现,在Parkin敲低时GPx4的含量恢复最为显著。接着,通过在细胞中加入线粒体自噬抑制剂千层纸素A(oroxylin A,OA,主要抑制Parkin及BNIP3介导的线粒体自噬),我们发现OA可显著抑制线粒体自噬的升高,并也可抑制铁死亡的发生并保护肝细胞损伤。该部分结果提示,肝纤维化过程中铁死亡的发生依赖于线粒体自噬的激活(主要由Parkin介导)。
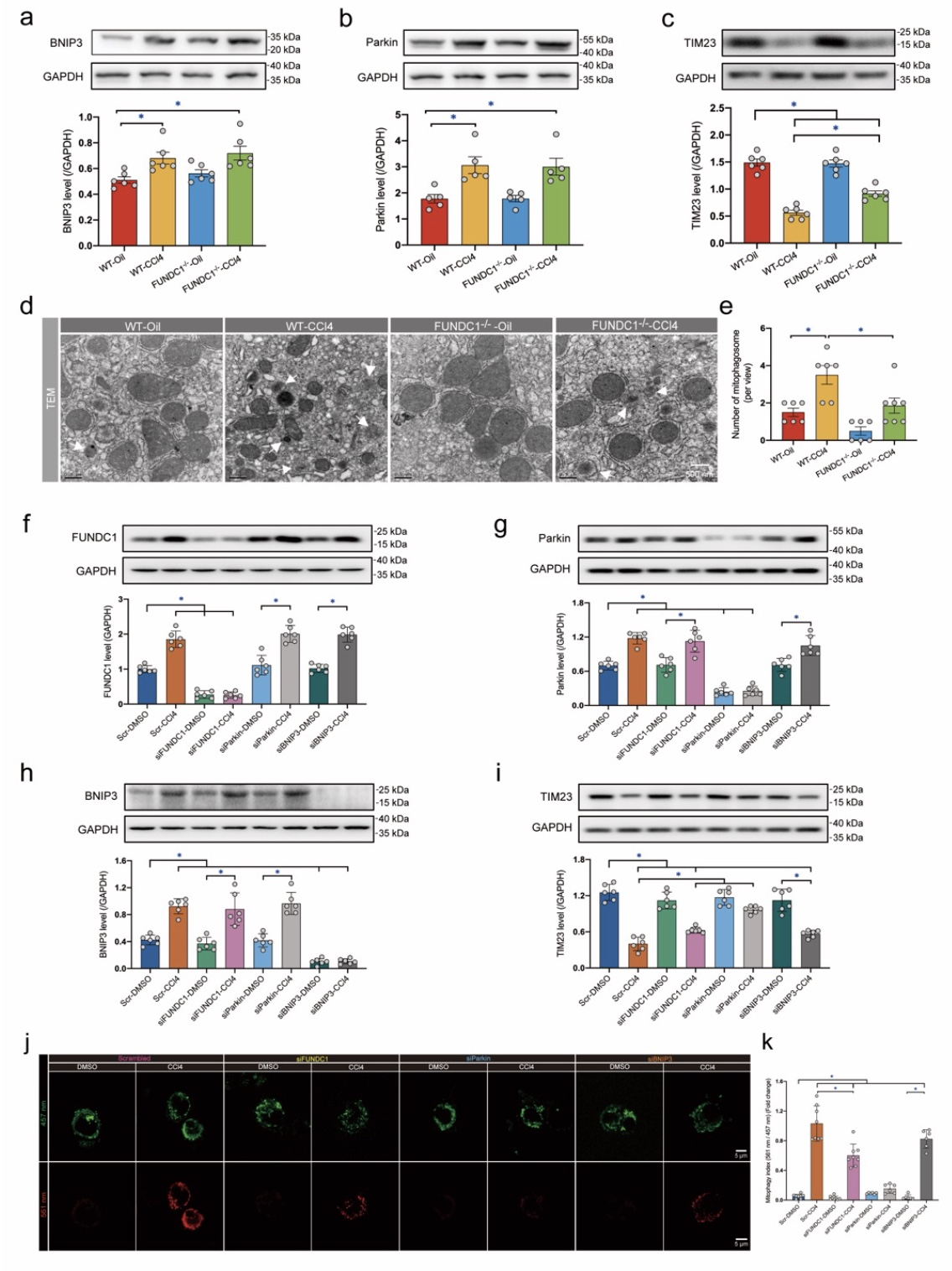
图4 主要由Parkin而非FUNDC1介导的线粒体自噬可引起GPx4含量下降并促进铁死亡
(图源:Bi, et al., J Adv Res, 2023)
那么FUNDC1对GPx4的调控作用又是通过何种机制呢?这与线粒体自噬又有何种关系呢?研究人员通过构建FUNDC1不同片段突变的质粒,并利用CO-IP验证发现FUNDC1(FUNDC1的线粒体外膜部分)可与GPx4结合。接着,利用免疫荧光进一步观察发现,FUNDC1可使GPx4在线粒体的含量增加。
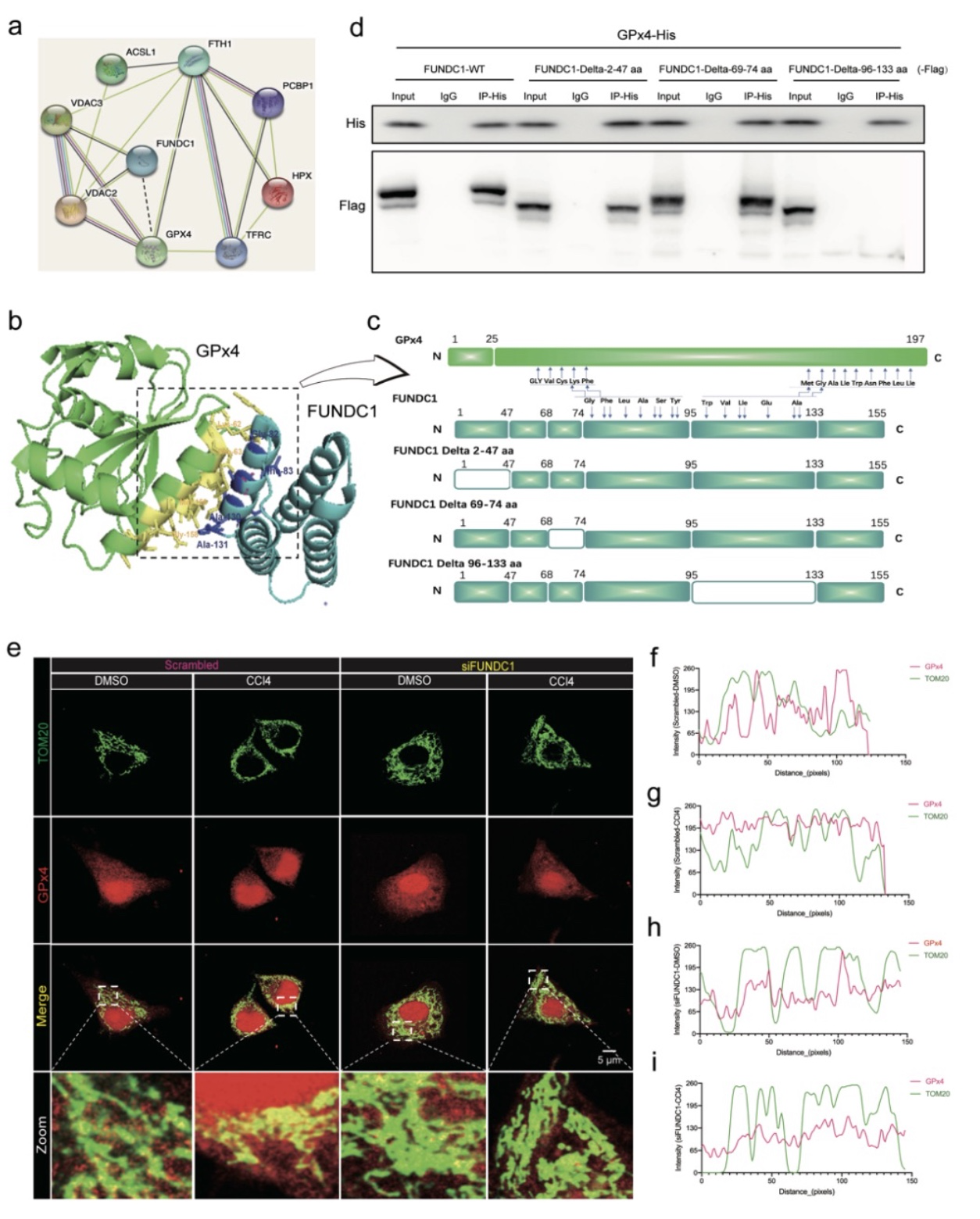
图5 FUNDC1可与GPx4结合并促进其线粒体聚积
(图源:Bi, et al., J Adv Res, 2023)
上述结果提示FUNDC1很可能招募GPx4并促进其线粒体转位,为了进一步验证该猜想,研究人员通过分别干预介导线粒体蛋白质转位的孔道TOM/TIM复合物的组成蛋白TOM20,TOM22及TOM70后发现,TOM20,TOM22或TOM70干预后GPx4与线粒体的共定位及其在线粒体内的含量均显著减少,表明GPx4可被FUNDC1招募至线粒体表面并通过线粒体孔道TOM/TIM复合物进入线粒体,而当线粒体损伤严重时,线粒体自噬被激活,进入线粒体内的GPx4随损伤线粒体一同被线粒体自噬所降解,导致铁死亡发生。
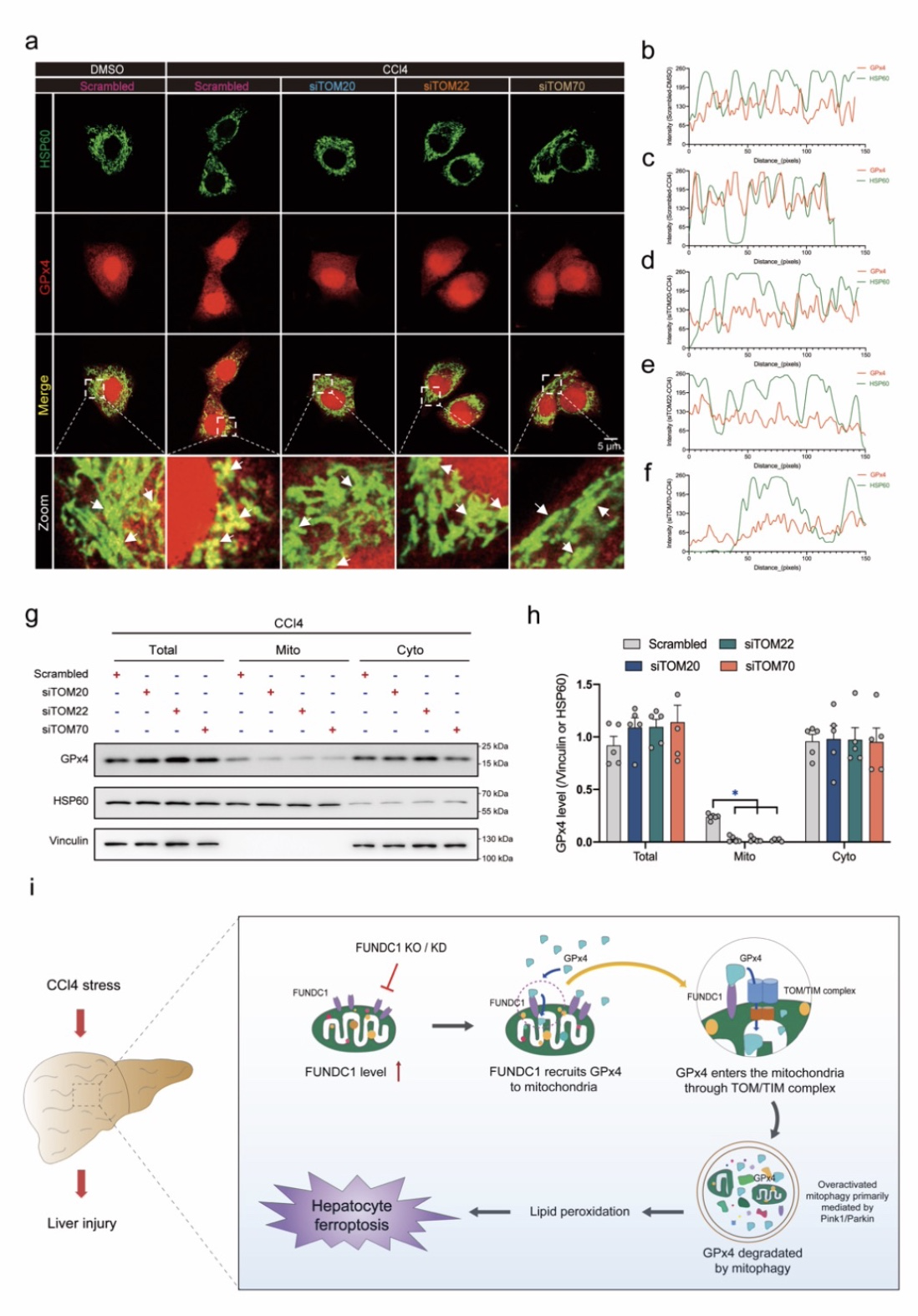
图6 FUNDC1招募GPx4并促进其通过TOM/TIM复合物的线粒体转位
(图源:Bi, et al., J Adv Res, 2023)

