支气管哮喘(bronchial asthma)是一种气道慢性炎症性疾病。近年来,全球哮喘患病率以每10年20%~50%的比例增长,给个人和社会带来了沉重的经济负担[1]。哮喘的特征是慢性气道炎症和气道高反应性(AHR)。哮喘反复发作后,由于气道反复损伤修复,最终导致气道重塑和肺功能进一步下降。
胎盘生长因子(placental growth factor,PlGF)是一种糖基化二聚体蛋白,与血管内皮生长因子(VEGF)同源。既往研究显示,PlGF在哮喘患者中表达上调,且PlGF水平与肺功能呈负相关[2]。PlGF分别通过直接或间接结合并激活血管内皮生长因子受体-1和血管内皮生长因子受体-2(VEGFR-1和VEGFR-2),影响炎症反应、血管生成、血管渗漏和其他与哮喘发病相关的病理变化。因此,深入认识阐明PlGF在哮喘发病机制中的作用具有重要的临床意义。
“The multifaceted role of placental growth factor in the pathogenesis and progression of bronchial asthma and pulmonary fibrosis: TherapeuticQ1 implications”的综述,回顾了PlGF在支气管哮喘慢性气道炎症、AHR、气道重塑和支气管上皮纤维化中的作用,提示PlGF可能是支气管哮喘的潜在治疗靶点。

过敏原暴露、吸烟、缺氧以及炎症介质如白介素(IL)-1β、肿瘤坏死因子(TNF)-α、转化生长因子(TGF)β和表皮生长因子(EGF)等可以刺激支气管上皮细胞、肺泡巨噬细胞、嗜酸性粒细胞和成纤维细胞等产生和分泌PlGF[3-7](图1)。哮喘患者的血清、诱导痰以及肺组织中的PlGF水平明显高于健康对照组[2,8]。作为PlGF受体,VEGFR-1在哮喘患者的CD34+细胞、巨噬细胞和T细胞中的表达也上调[9]。此外,Th2细胞因子/STAT6通路的激活能够诱导PlGF在气道上皮细胞、肺泡巨噬细胞和嗜酸性粒细胞中的表达[3]。提示PlGF的表达在哮喘中被激活,PlGF可能成为一种新的哮喘生物标志物。
作者团队先前的临床数据显示,哮喘吸烟者的PlGF水平与支气管扩张剂后1 s用力呼气量(FEV1)和FEV1/用力肺活量(FVC)呈负相关。血清和诱导痰中的PlGF水平与后基底段支气管壁厚度(指定为RB10)和严重呼气流量限制的发展呈正相关[2]。通过进一步体外研究发现,PlGF还促进成纤维细胞增殖,诱导支气管上皮-间充质转化(EMT) [10,11];持续的EMT可导致哮喘患者气道重塑,最终导致肺功能进行性下降[12]。这些数据表明,PlGF的表达水平与肺功能呈负相关。

图1 上调PlGF表达或抑制PlGF作用的因素
(图源:Huang D et al., Genes & Diseases,2022)
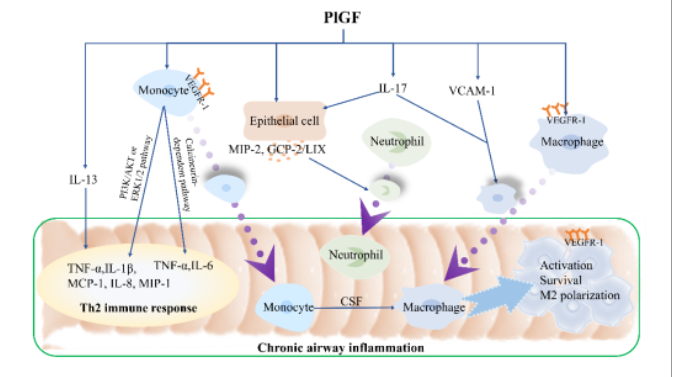
图2 PlGF与慢性气道炎症
(图源:Huang D et al., Genes & Diseases,2022)
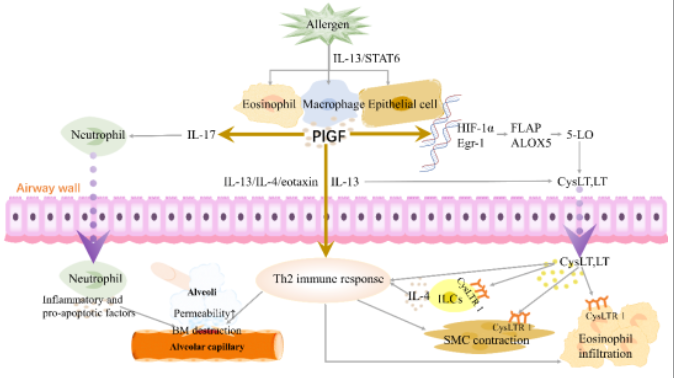
图3 PlGF和AHR
(图源:Huang D et al., Genes & Diseases,2022)
哮喘患者的气道重塑包括上皮完整性损伤、支气管上皮纤维化、新生血管生成、气道平滑肌层增厚和粘液腺增生,进而导致气道壁的增厚和硬化。PlGF通过PKC或JNK通路诱导II型肺泡上皮细胞(AECs)凋亡,导致上皮完整性的丧失[6],还可以诱导促纤维化因子的表达,并促进成纤维细胞增殖和支气管上皮EMT,从而参与肺上皮纤维化[21]。此外,重组人PlGF显著刺激了人肺微血管内皮细胞(HLMECs)的增殖和迁移,并显著增加应力纤维和毛细血管样网络的形成[2]。因此,PlGF可能通过促进支气管上皮细胞凋亡和上皮纤维化,以及血管生成,从而加重哮喘患者气道重塑的病理改变(图4)。
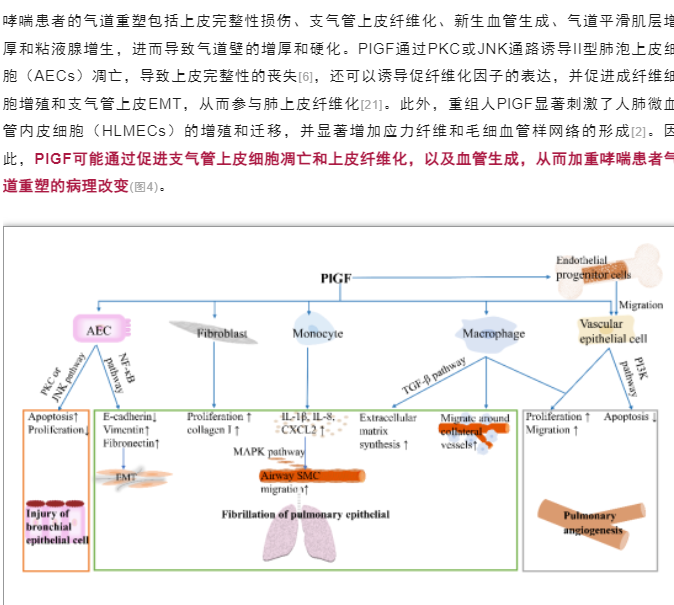
图4 PlGF和气道重塑
(图源:Huang D et al., Genes & Diseases,2022)

