肠道内组成物理屏障的肠上皮细胞(IEC)不仅执行着吸收营养物质的功能,而且还通过分泌各种蛋白与免疫系统一起抵抗病原体的入侵。分泌蛋白在成熟和分泌过程中需要在内质网中完成折叠和修饰,因此,维持内质网中蛋白质的稳态对于上皮细胞发挥正常的功能非常重要。当内质网中错误折叠蛋白或者未折叠蛋白增多时,便会引起内质网应激(ER stress), 激活包括未折叠蛋白反应(unfolded protein response, UPR)在内的一系列信号,从而促进细胞恢复蛋白质稳态。前期的研究已经发现,上皮细胞内质网应激不仅影响上皮细胞自身功能,而且影响免疫系统中B细胞的功能,从而促进或阻止肠炎[1, 2]。然而,IEC ER stress对T细胞的影响却依然不是很清楚。
Th17 细胞是2005年董晨实验室和Casey Weaver实验室发现是一种独立于Th1和Th2细胞的CD4+细胞亚群[3, 4],也是存在于肠道内,维护其功能的重要的T细胞亚群。著名免疫学家Dan Littman实验室的工作发现,肠道内Th17细胞发育依赖于肠道菌群[5]。随后, Kenya Honda实验室的研究进一步发现,肠道菌群必须具有接触肠道上皮细胞的能力才能诱导Th17细胞的产生[6]。然而,肠道上皮细胞是如何将菌群的信号传递给免疫细胞,从而促进Th17细胞发育的,仍然是一个未解之谜。阐明了肠道上皮细胞通过上调内质网应激(ER stress),进而促进活性氧(ROS)产生和激活嘌呤代谢增加黄嘌呤的产生,从而促进Th17细胞分化的机理。

首先,研究人员检查特异性肠上皮细胞上调ER stress的小鼠(Xbp1ΔIEC)肠道内的CD4细胞亚型的含量时,发现Th17细胞的数量明和比例显增加(Figure 1A-D)。随后研究者们在新构建的肠上皮细胞上调ER stress小鼠(SubAA272IEC)的小肠内观察到了同样的现象(Figure 1H)。另人惊讶的是,即使在去除大部分共生菌或无菌环境下,这些小鼠肠道内的Th17细胞数量仍然增加(Figure 2A-2B)。这些结果表明肠道上皮细胞ER stress参与更广泛的Th17细胞分化。
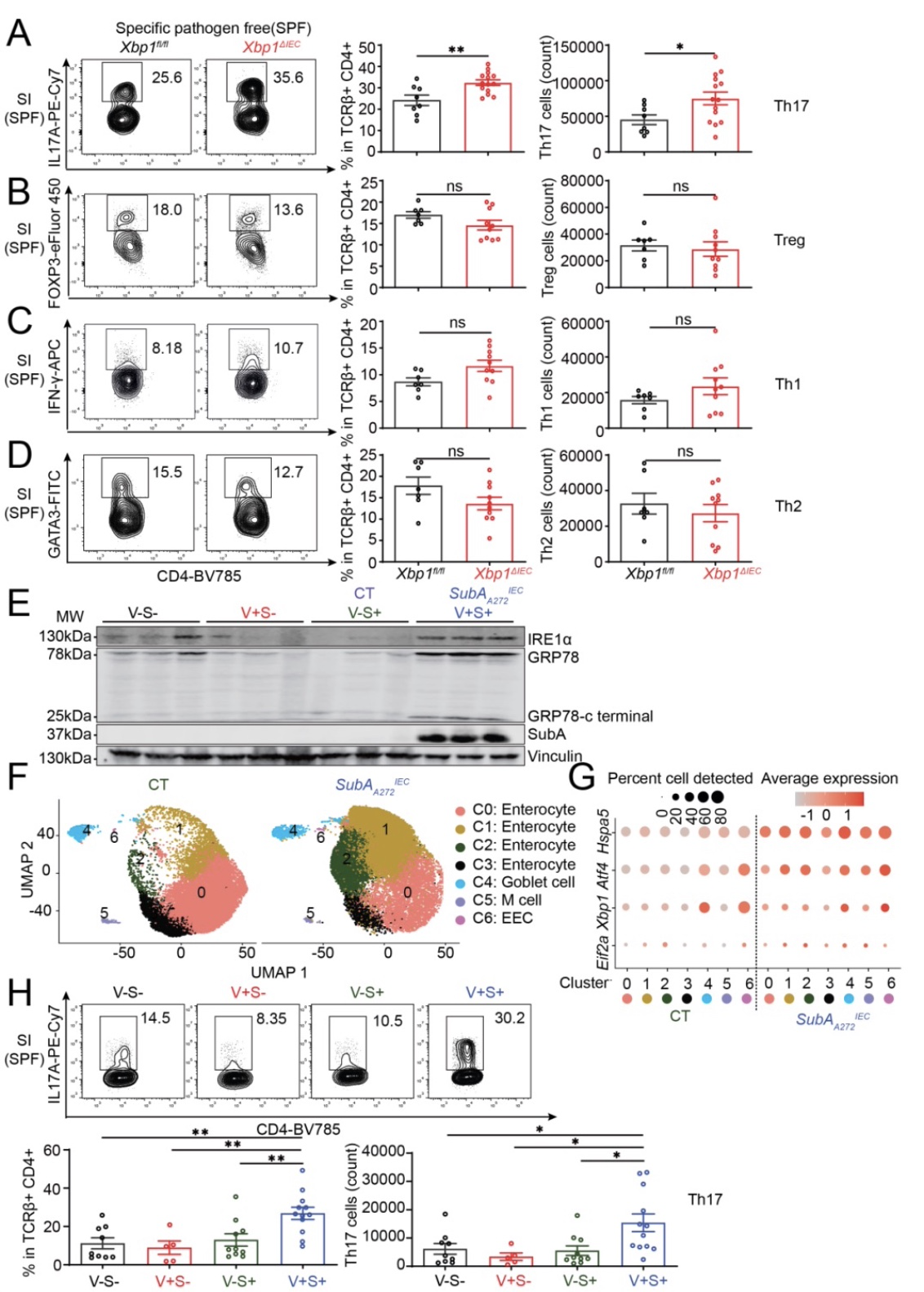
Figure 1 在SPF环境下,多个小鼠模型中IEC ER stress 促进Th17细胞的分化。
(图源:Duan et al., Immunity, 2023)
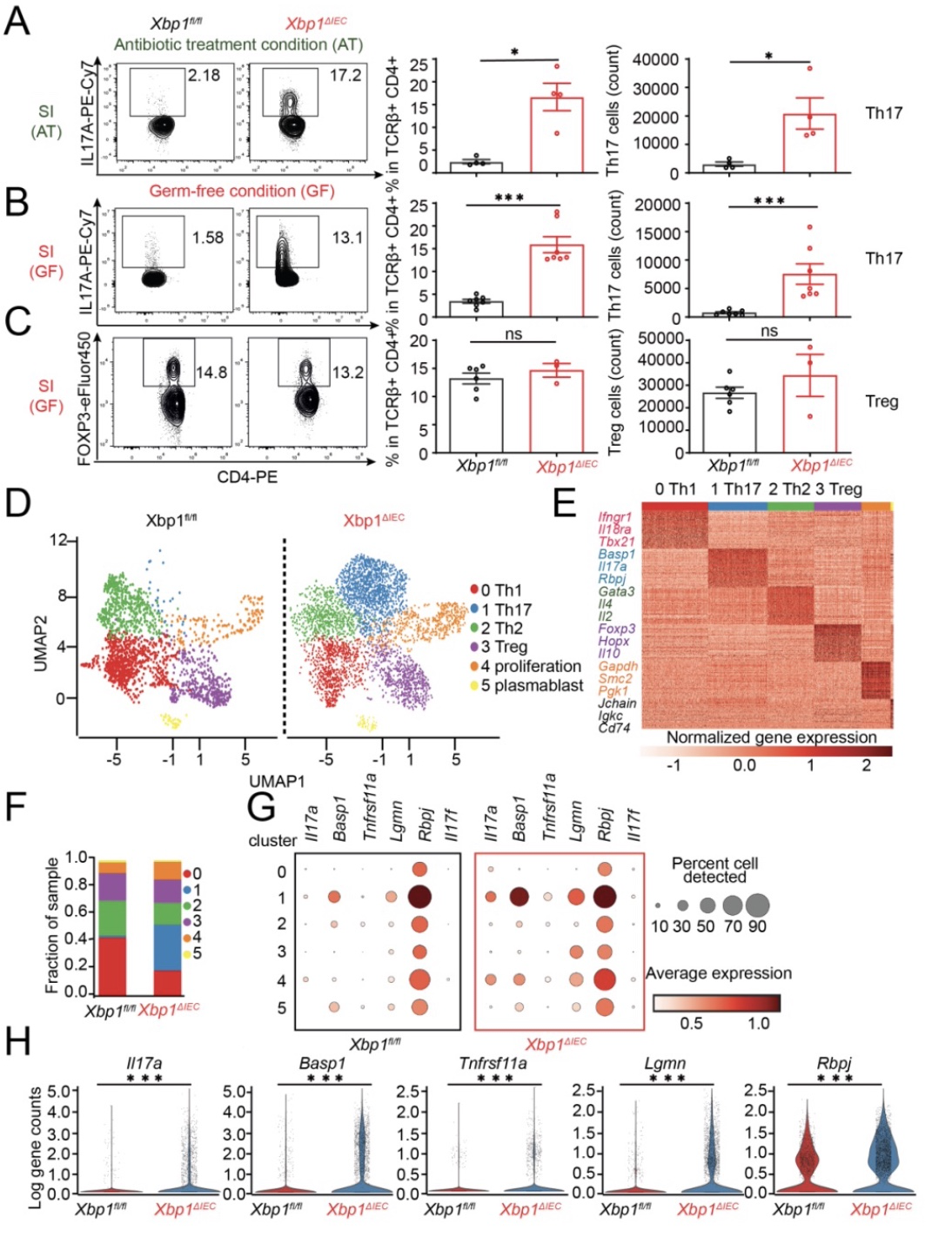
Figure 2 在抗生素处理和无菌环境下,小鼠模型中IEC ER stress 促进Th17细胞的分化
(图源:Duan et al., Immunity, 2023)
在机制方面,研究者在检测所有已知的能够促进Th17细胞分化的基因后,发现IEC ER stress上调Duoxa2和Duox2基因的表达,增加活性氧(ROS)的含量(Figure 3A-D)。并且敲除Duoxa 或Duox2基因的小鼠Duoxa-/-Xbp1ΔIEC 或Duox2ΔIECXbp1ΔIEC 肠道内Th17细胞比Xbp1ΔIEC小鼠减少了。从而证明肠上皮细胞内质网应激通过上调 Duoxa2和Duox2基因表达促进Th17细胞的分化(Figure 4G-H)。
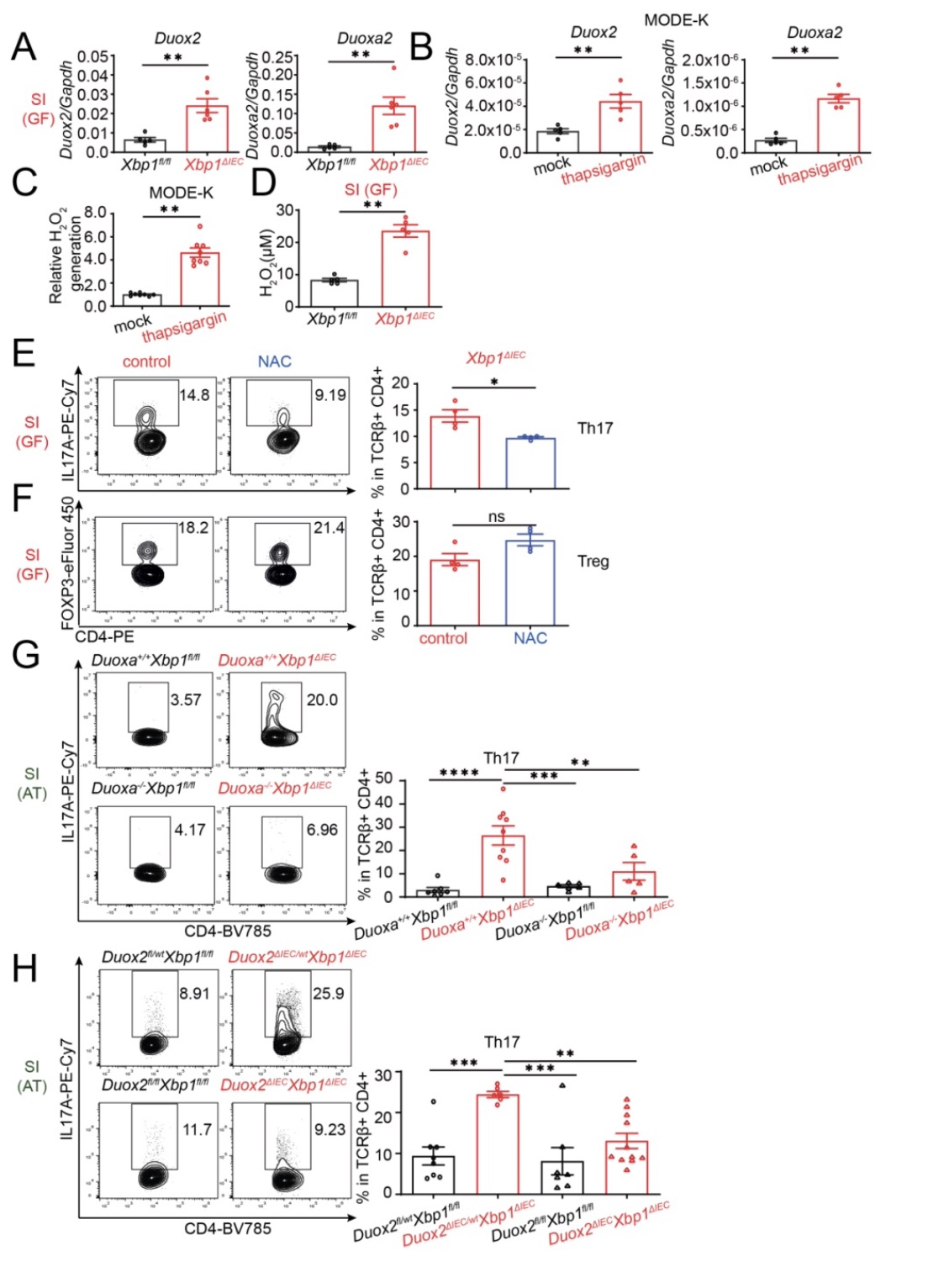
Figure 3 IEC ER stress 促进Th17细胞的分化依赖于Duox2/Duoxa2产生的ROS
(图源:Duan et al., Immunity, 2023)
随后,通过质谱分析代谢物的变化,研究者发现在Xbp1ΔIEC小鼠的血清和肠道中,嘌呤代谢物的含量明显增加(Figure 4A and 4C)。研究者通过利用allopurinol处理Xbp1ΔIEC小鼠,抑制肠道内黄嘌呤的产生,发现同样减少了Xbp1ΔIEC小鼠肠道内Th17细胞的产生(Figure 4E and 4F)。研究者们进一步发现,和Xbp1ΔIEC 相比,Duox2ΔIECXbp1ΔIEC 小鼠没有产生更多的黄嘌呤(Figure 4 J)。这些结果表明IEC ER stress,能够促进活性氧(ROS)产生和增加黄嘌呤的产生,从而产生更多Th17细胞。
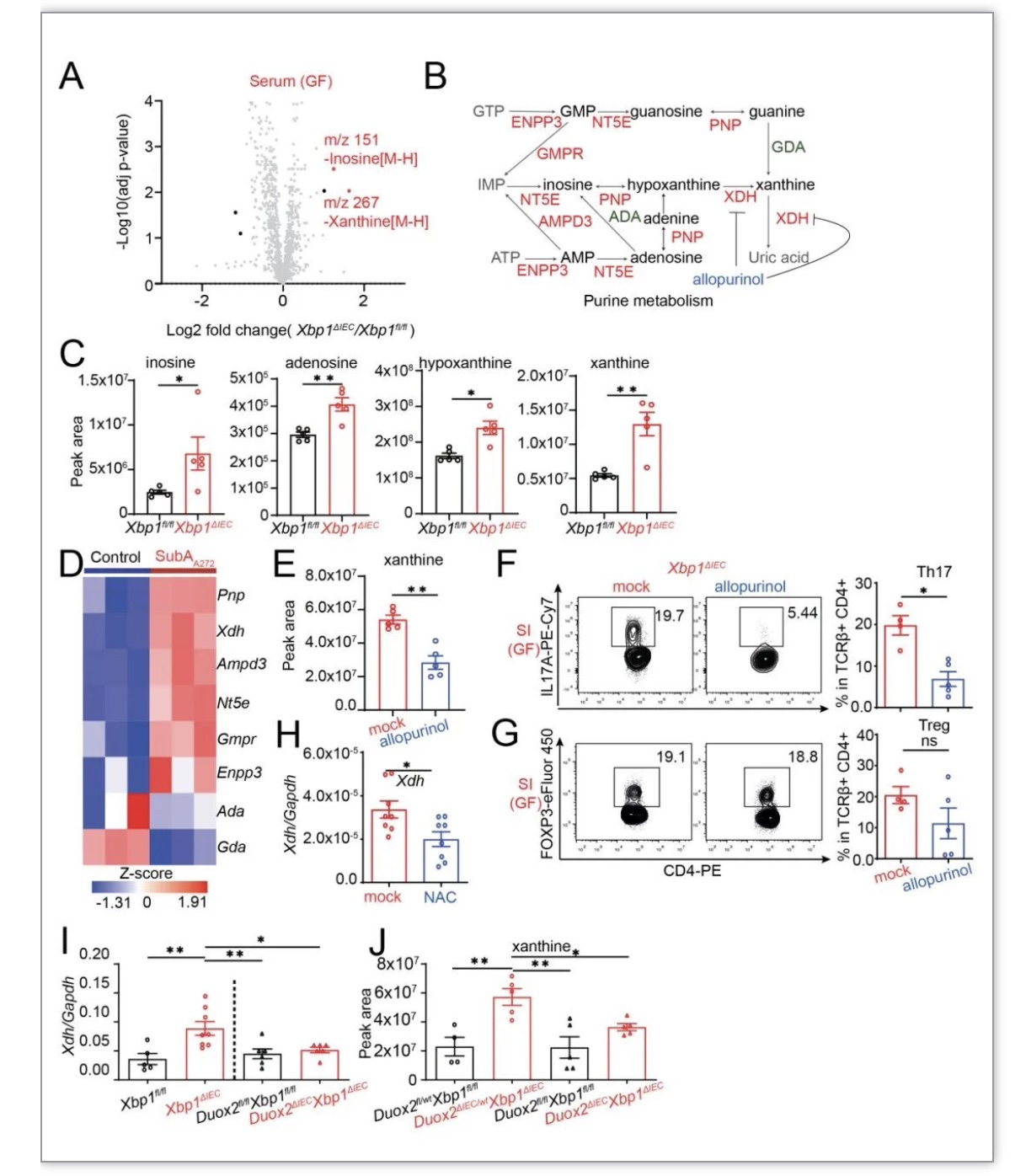
Figure 4 IEC ER stress 促进Th17细胞的分化依赖于嘌呤代谢
(图源:Duan et al., Immunity, 2023)
此外,研究者通过将含有促进Th17细胞的共生菌或致病菌的小鼠与不含这些菌的小鼠(无菌小鼠或Jackson lab小鼠)进行比较,发现前者肠道内ER stress增加,并且ER stress抑制剂4-苯基丁酸(4-PBA)处理小鼠可以抑制其肠道内的Th17细胞产生(Figure 5)。
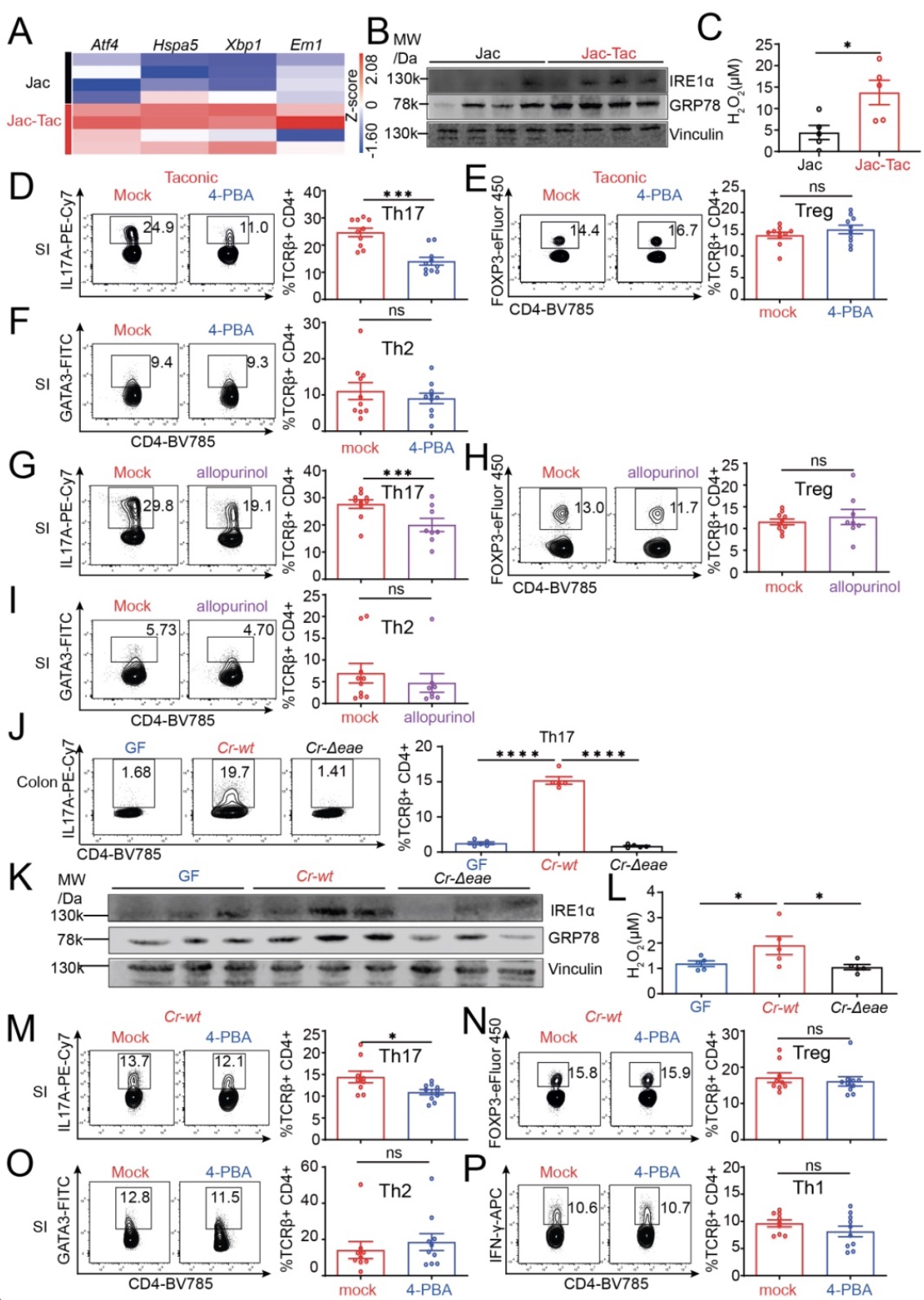
Figure 5 IEC ER stress 参与共生菌和病原菌诱导Th17细胞分化的过程
(图源:Duan et al., Immunity, 2023)
Figure 6 文章总结图:肠道上皮细胞通过上调内质网应激,进而促进活性氧(ROS)产生和激活嘌呤代谢增加黄嘌呤的产生,从而促进Th17细胞分化
(图源:Duan et al., Immunity, 2023)

