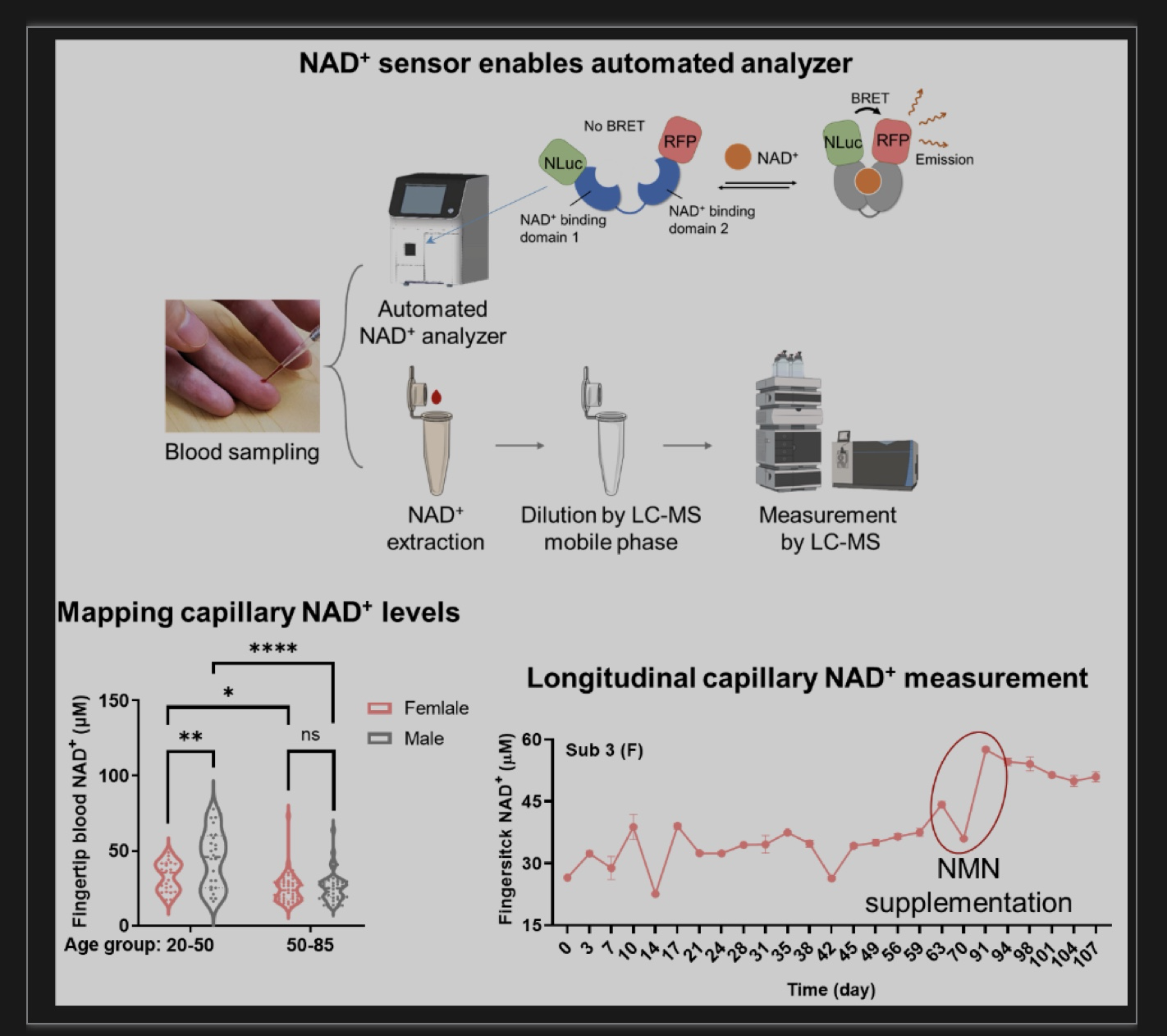
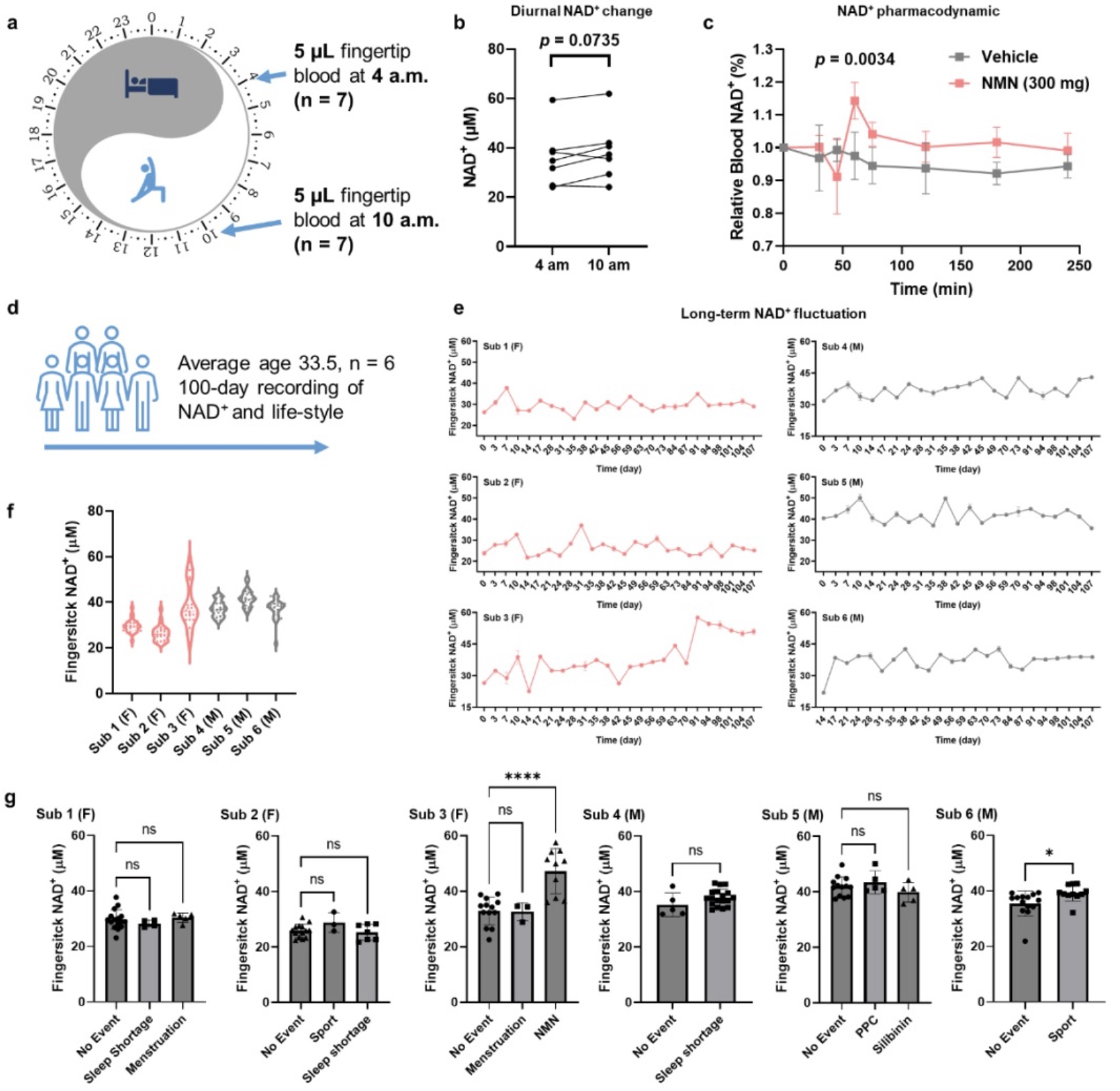
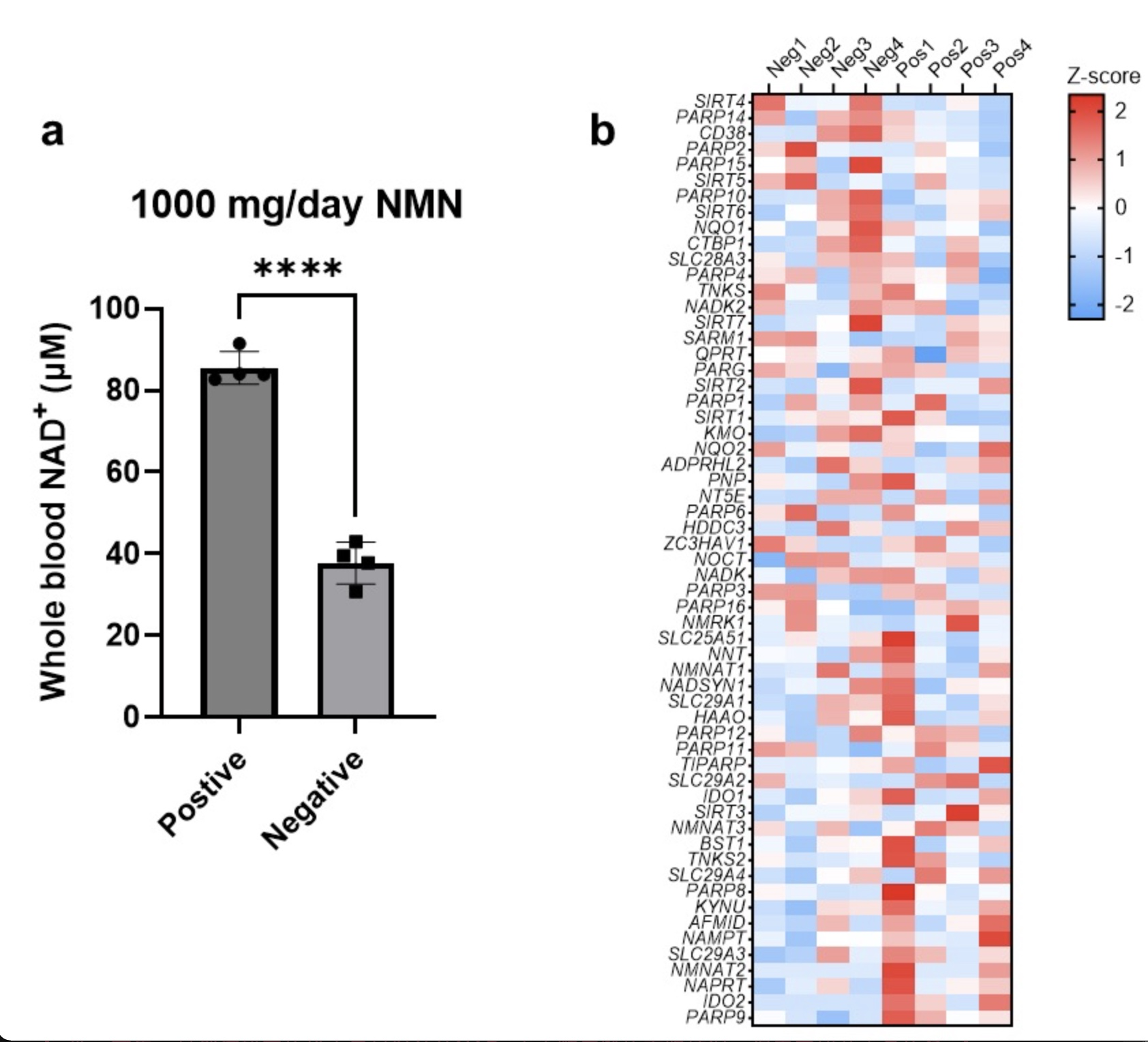
团队表示,该研究利用全遗传编码的NAD+探针和自动化仪器实现了指尖血NAD+快速、去中心化的定量检测,并揭示了NAD+膳食补充、有氧运动、性别、年龄、昼夜节律等因素对人类NAD+水平差异化的影响,以识别衰老表型中具有意义的特殊亚群,并通过定量评估NAD+干预方案的效果实现个体化的衰老管理。同时,团队还表示该研究尚存在一定局限性。首先,虽然该研究的样本量足以评估NAD+水平随年龄的下降情况,但未来招募更多的参与者将有助于确定更细致的年龄段之间潜在的NAD+差异。其次,该研究的纵向分析表明有氧运动和NMN可以增加受试者的NAD+水平,但更多的数据点和更大的样本量将有助于识别其他调控NAD+代谢的因素,并建立新的运动或饮食方案以提升衰老过程中的NAD+衰退。
研究提出,结合智能手表等可穿戴设备获取的更全面和更连续的数据,将让人们更深入地了解不同日常行为和习惯对NAD+代谢的影响,并为NAD+多样化调控提供新方法。最后,NAD+普查显示存在个体NAD+水平显著较高的情况。然而,本研究尚未对这些个体的遗传或代谢特征进行表征。未来,简便高效的NAD+指尖血普查将赋能更大范围的NAD+测量,并引导更深入的NAD+调控机制研究。

