新生血管的形成是增殖性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)、湿性年龄相关性黄斑变性(wet age-related macular degeneration,wAMD)、早产儿视网膜病变(retinopathy of prematurity,ROP)以及各种原因引起的角膜新生血管等多种眼部疾病的共同病理特征,成为导致视力损伤和不可逆盲的重要因素[1,2]。临床上针对新生血管性眼底病以对症治疗为主,如眼底激光光凝术以降低视网膜耗氧量,促进新生血管消退为目的,但同时也造成周边视网膜神经元的损伤;而抗血管内皮生长因子(VEGF)药物对部分患者无应答,长期反复使用可引起视网膜损伤等不利影响[3,4]。鉴于临床治疗的局限性,深入探索眼部新生血管形成的复杂调控机制,开发新的治疗靶点,对减缓新生血管性眼病的进展、提高患者视功能并改善生活质量具有重要意义。核酸类药物开启新一代靶向治疗时代,以ASO、siRNA、miRNA为代表的小核酸类药物研发已进入最后冲刺阶段,也有部分已成功上市[5]。近年来,诸多研究揭示了非编码RNA在各种生物学过程中的重要作用,促进了许多微小RNA药物的临床应用研发。
“Anti-angiogenic properties of microRNA-29a in preclinical ocular models”的研究论文[6]。研究表明miR-29a参与调控视网膜血管网的发育成熟,并通过多靶点抑制病理性新生血管的形成。该研究阐明了眼部新生血管形成的表观遗传调控新机制,为临床治疗提供更多的选择。

该研究首先利用三种不同的眼部新生血管临床前模型(分别模拟角膜、视网膜和脉络膜新生血管,即Corneal NV、OIR和CNV),通过定量检测发现miR-29家族(miR-29a/b/c)在血管新生过程中均显著下调(图1A-F)。进一步的细胞功能实验表明,miR-29家族对血管内皮细胞的增殖、迁移和管腔形成能力有不同程度的影响,其中miR-29a的作用尤为显著(图1G-I)。
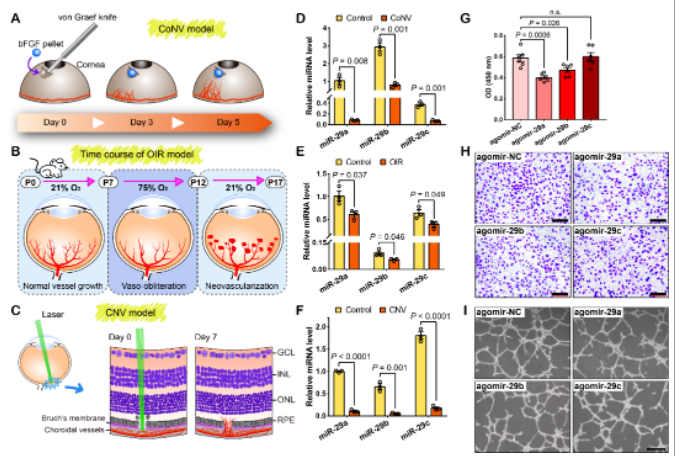
图1 miR-29家族在眼部血管新生过程中的表达变化以及对血管内皮细胞功能的影响
(图源:Peng DW, et al., PNAS, 2022)
为了进一步阐明miR-29a在眼部新生血管形成过程中的作用,研究者利用miR-29a基因敲除鼠开展了在体功能研究。结果显示,在小鼠视网膜血管发育阶段,敲除miR-29a会促进血管重塑过程(vascular remodeling),包括血管的修剪和深层血管网的形成,但并未影响血管网的最终成熟(图2A-G)。另一方面,在构建的病理性新生血管模型中,miR-29a的敲除显著促进角膜、视网膜以及脉络膜新生血管的形成,而过表达miR-29a则逆转其功能而抑制新生血管形成(图2H-J)。
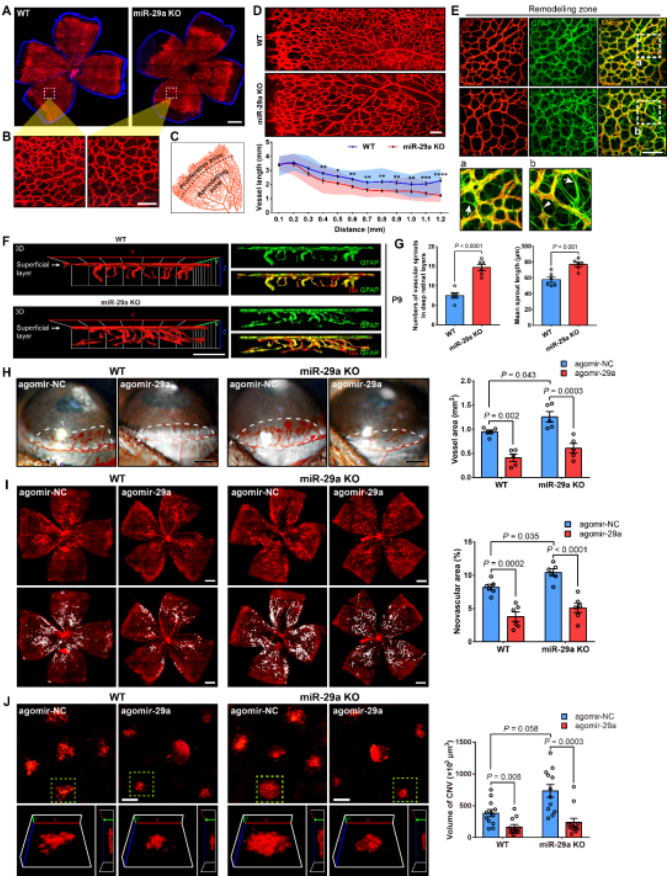
图2 miR-29a影响视网膜血管重塑和眼部新生血管形成
(图源:Peng DW, et al., PNAS, 2022)
为探究miR-29a调控眼部血管新生的表观遗传分子机制,作者利用高通量测序联合生物信息学分析,并通过双荧光素酶报告实验以及体内外功能实验验证,证实了miR-29a参与调控细胞外基质重构、趋化因子活性、血管新生、血管壁细胞表面相互作用等生物进程(GO和KEGG分析),确认了胶原蛋白COL7A1、溶质运载蛋白SLC43A2和血小板衍生生长因子PDGFC是miR-29a的关键靶基因(图3)。COL7A1是胶原蛋白超家族的成员,也是锚原纤维的主要结构成分。SLC43A2是溶质载体家族的成员,负责中性氨基酸的跨膜转运。PDGFC是血小板衍生的生长因子家族的成员,已被证明是非VEGF依赖性的血管生成刺激因子和促炎细胞因子[7]。在这些靶基因中,PDGFC在三种不同新生血管模型中均表现出一致的表达变化趋势和调节作用。然而,COL7A1和SLC43A2在角膜和脉络膜新生血管动物模型中的作用并不明显,这可能是因为在筛选靶基因的过程中,利用了视网膜新生血管模型有关。鉴于此,作者推测利用角膜或脉络膜新生血管动物模型筛选靶基因,或可寻到其它组织特异性的靶基因。综上所述,该研究阐明了miR-29a在维持血管稳态中的重要作用,或可成为新生血管性眼病的潜在治疗靶点。
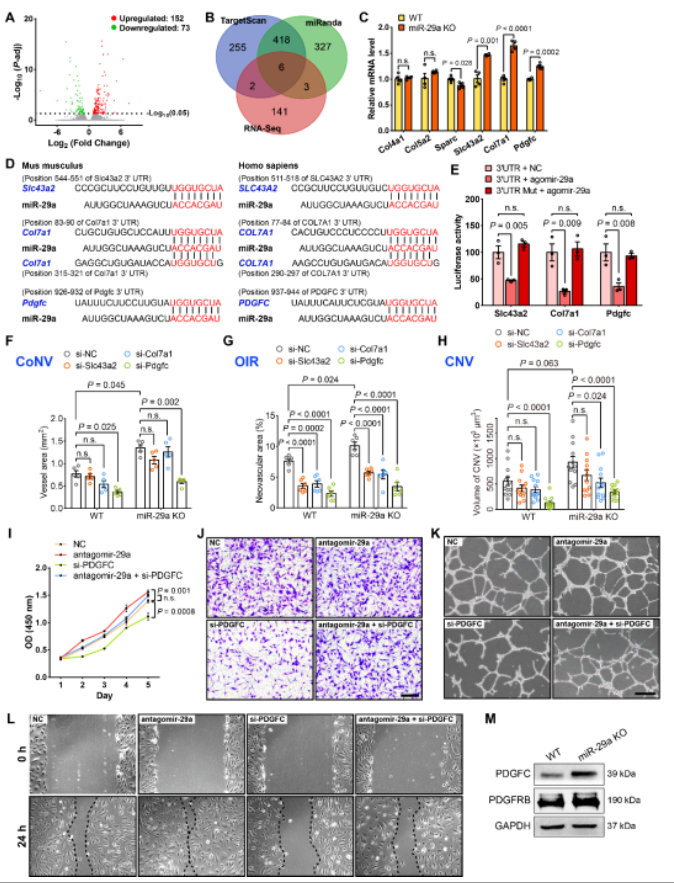
图3 miR-29a靶基因筛选和验证
(图源:Peng DW, et al., PNAS, 2022)
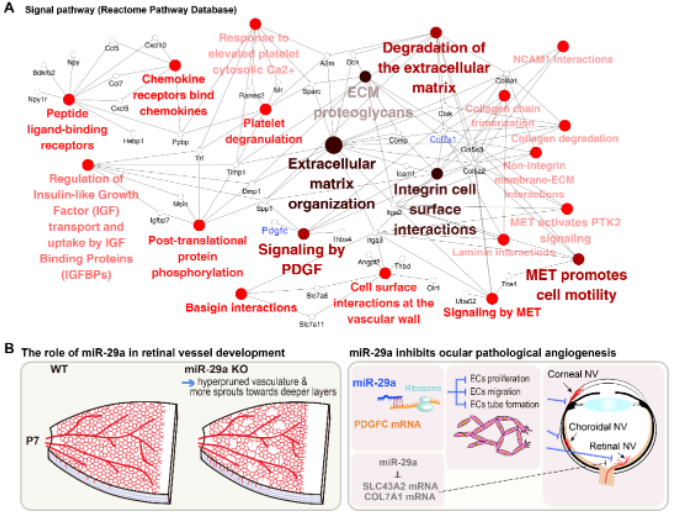
图4 miR-29a调控眼部血管发育和病理性新生血管的表观调控机制示意图
(图源:Peng DW, et al., PNAS, 2022)

