选取分别种植有扁蓿豆、紫花苜蓿、红豆草、蚕豆4种不同豆科牧草的土壤,采用5点取样法取样,使用土钻采取0~20cm植物根系及土壤样品,抖落根系大块土壤,收集根上0~5mm的土壤作为根际土,立即装人无菌样品采集袋,所有样品在低温条件下带回实验室,样品分为两份,一份自然风干过2mm筛用于土壤理化性质的测定,另外一份一80°C冰箱保存,用于土壤微生物总DNA提取。
二、测定指标与方法
2.1土壤理化指标
土壤理化性质的测定方法如下:利用碱解扩散法测定土壤速效氮含量;利用钼锑抗比色法测定土壤速效磷含量;利用火焰光度计法测定土壤速效钾含量;利用凯氏定氮法测定土壤全氮含量;利用钼锑抗比色法测定土壤全磷含量;利用火焰光度计法测定全钾含量;利用重铬酸钾法测定有机质含量。
2.2 土壤总DNA提取及ITS基因扩增
采用土壤DNA提取试剂盒提取豆科植物根际土壤样品中的微生物基因组DNA,采用Illumina HiSeqPE250测序平台的通用引物对真菌ITS1区域进行PCR扩增,引物为ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3' )和ITS2R (5'-GCTGCGTTCTTCATCGATGC-3'),并对PCR产物进行测序。
2.3生物信息学分析
根据Barcode 序列和PCR扩增引物序列从下机数据中拆分出各样品数据,截去Barcode 和引物序列后对Reads进行拼接,得到原始Tags数据(Raw Tags) ;对原始测序数据进行质量过滤并去除嵌合体序列,进而得到优质Tags数据;在相似性97%的水平,上对序列进行聚类,用Mothur方法与SIIVA软件的SSUrRNA数据库进行物种注释(阈值0.8~1.0);采用PyNAST软件与Green-Gene数据库中数据信息进行多序列比对,最后对测序数据进行标准化处理,进一步进行a多样性分析、β-多样性分析和显著物种差异分析等来挖掘样品之间的差异。通过RStudio软件绘制热图,采用非加权配对平均法进行层次聚类绘制系统发育树。
三、结果分析
3.1土壤理化性质
4种不同豆科牧草根际土壤理化性特征测定结果如下表所示,结果表明4种豆科牧草根际土壤的pH值在8.02~8.25之间,其差异显著(P<0.05) ,全氮含量变化范围为1. 1~2.79 g/kg,全磷含量范围在1.96~3.44g/kg之间,全钾含量范围为23. 85~24.81g/kg ,蚕豆样品和其他3个样品全钾含量差异显著,速效氮含量范围为78~187mg/kg,速效磷含量范围为19.3~75.2mg/kg,速效钾含量范围为78~168mg/kg,有机质含量范围为16.39~41.73g/kg,扁蓿豆的土壤速效氮、速效磷和速效钾,以及有机质含量均远远小于其他3个样品。
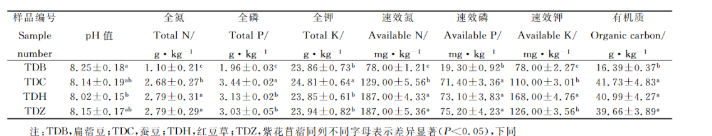
3.2土壤真菌群落丰度与Alpha多样性分析
通过对4个土壤样品进行高通量测序,共得到267532条有效序列,序列长度相对集中,平均长度分别为260bp,256bp,238bp,243bp,聚类共得到966个OTUs。各样品测序覆盖度均在99.9%以上,并且趋于平缓的稀释曲线,说明本研究测序数据合具有可靠性,能够准确提供土壤真菌群落的真实信息。如下表所示,各样品真菌群落丰富度指数(Chao1指数)依次为TDC>TDZ>TDH> TDB,真菌群落多样性指数(Shannon Wiener)指数依次为TDC>TDB>TDH>TDZ。在97%的相似度水平下,得到了每个样品的OTU个数,如图3所示,所有样品中共有OTUs数目为61个,其中TDB,TDC,TDH,TDZ所特有的OTUs数目分别为44,50,26 和19个。
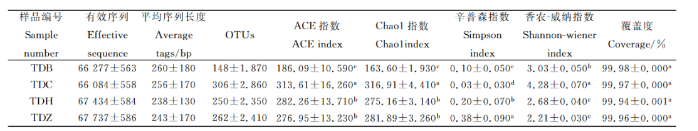
3.3土壤真菌群落分布特征
在豆科牧草根际土壤中各样地土壤真菌分属于9个门,相对丰度>1%的菌群分别为子囊菌门、被孢霉门、担子菌门、壶菌门、丝足虫门、油壶菌门、球囊菌门、毛霉门,其中子囊菌门在4组土样中的相对丰度为39.52%-84.51%,是最优势菌门。在各样地中真菌在属分类水平上相对丰度>1%的分别为四枝孢属、被孢霉属、小不整球壳属、毛壳菌属、小画线壳属、假裸囊菌属、线黑粉酵母属、小鬼伞属、油壶菌属、镰刀霉属。
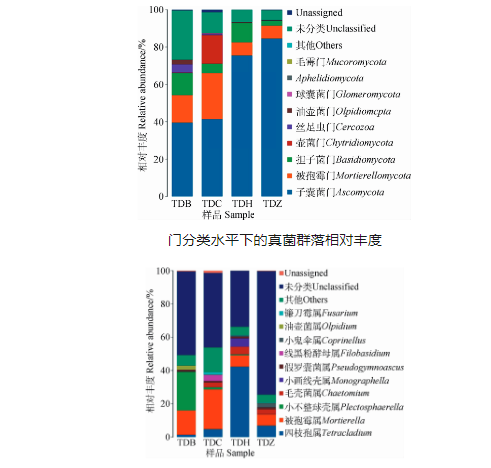
门分类水平下的真菌群落相对丰度
属分类水平下的真菌群落相对丰度
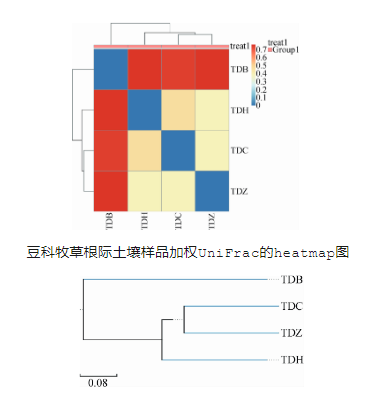
3.4土壤真菌群落Beta多样性分析
通过以Rstudio软件的P-heatmap 包绘制聚类热图,从聚类中可根据颜色梯度的变化直观看出两两样品间的差异性。聚类结果显示,紫花苜蓿(TDZ)样品和蚕豆(TDC)样品的真菌群落组成及丰度差异最小,而和扁蓿豆(TDB)样品的真菌群落组成及丰度差异最大。基于Beta多样性分析得到的四种距离矩阵,通过R语言工具采用非加权配对平均法(UPGMA)对样品进行层次聚类,以判断各样品间物种组成的相似性。紫花苜蓿(TDZ)样品和蚕豆(TDC)样品的真菌组,成及丰度相似性较高,而和扁蓿豆(TDB)样品的真菌群落结构差异较大。
3.5土壤理化性质与真菌种群分布的相关性
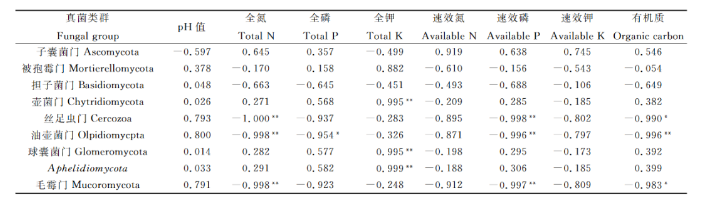
对4种豆科牧草根际土壤真菌群落多样性与土壤理化性质进行相关性分析,结果表明,土壤真菌群落丰富度Chao1指数与土壤全磷含量呈极显著正相关(P<0.01),与土壤有机质含量呈显著正相关(P<0.05);土壤真菌群落多样性指数Shannon与土壤pH值、全磷、全钾、有机质含量呈正相关,与土壤全氮、速效氮、速效磷、速效钾含量呈负相关。
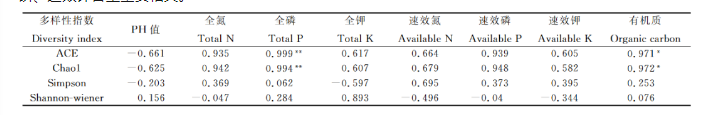
真菌对季节变化、土壤理化性质、植被类型等的响应各有不同,而土壤环境因子是影响土壤真菌多样性的主要因素。4种豆科牧草根际土壤理化性质间具有显著 差异,与扁蓿豆样地相比,蚕豆、红豆草、紫花苜蓿3种样地土壤理化性质更为相似。4种豆科牧草根际土壤真菌群落丰富度指数(Chao1指数)依次为蚕豆>紫花苜蓿红豆草>扁蓿豆,真菌群落多样性指数(Shannon-Wiener)指数依次为蚕豆> 扁蓿豆> 红豆草>紫花苜蓿;Beta多样性分析表明,蚕豆与紫花苜蓿根际土壤真菌多样性相似度较高,与扁蓿豆差异性较大。通过相关性分析,土壤全氮、全磷、全钾、速效磷和有机质是土壤真菌群落分布的主要影响因子。
MIAO L, WANG S Y,LI B K,et al. Effect of carbon sourcetype on intracellular stored polymers during endogenous deni-tritation ( ED) treating landfill leachate[J]. Water Research ,2016(100) :405-412
MAGOC T , SALZBERG S L. FLASH: fast length adjustmentof short reads to improve genome assemblies[J ]. Bioinformat-ics,2011 ,27(21) :2957-2963
WANG Q,GARRITY GM, TIEDJE J M,et al. Naive Bayes-ian classifier for rapid assignment of rRNA sequences into thenew bacterial taxonomy[ J ]. Applied and environmental micro-biology,2007 ,73(16) :5261-5267
QUAST C, ELMAR P,PELIN Y,et al. The SILVA ribosomal RNAgene database project : improved data processing and web- based tools[J]. Nucleic Acids Research,2013 ,41(D1) :590-596
WANG N F, ZHANG T, ZHANG F, et al. Diversity andstructure of soil bacterial communities in the Fildes Region(maritime Antarctica) as revealed by 454 pyrosequencingLJ].Frontiers in microbiology ,2015(6):1188
HAZARDC,GOSLING P,VAN DER GAST CJ,et al. The role oflocal environment and geographical distance in determining community composition of arbuscular mycorrhizal fungi at the landscape scale[J]. The ISME Journal, 2013,7(3) :498-508
JANSA J ,OBERHOLZER HR,EGLI S. Environmental deter-minants of the arbuscular mycorrhizal fungal infectivity ofSwiss agricultural soils[J]. European Journal of Soil Biology,2009,45(5/6) :400-408
XU L H, RAVNSKOV S, LARSEN J,et al. Soil fungal community structure alonga soil health gradient in pea fields ex-amined using deep amplicon sequencing [J ]. Soil Biol Bio-chem,2012,46(1) :26-32

