人类脑血管长达400英里,脑血管能够选择性地向中枢神经系统(central nervous system,CNS)输送营养物质,并从CNS交换代谢产物至循环系统[1]。血脑屏障(blood brain barrier,BBB)是决定脑血管选择性物质运输的结构单元,分隔血液和大脑的生理屏障。正常情况下,机体BBB的存在能够阻挡血液中各类细胞、蛋白和有害病原的进入。在中枢神经系统的疾病往往伴随着BBB的破坏,例如脑肿瘤形成、脑局部缺血、高血压、阿尔兹海默症、癫痫、感染性疾病、多发性硬化和脑部创伤等[2]。BBB的严重破坏往往会引起机体强烈不可控的炎症反应,甚至导致死亡。日本乙型脑炎病毒感染过程中,病毒能够以不破坏BBB的方式,通过单核细胞携带的方式进入CNS[3],而病毒诱导的炎症因子风暴最终引起了BBB的破坏[4]。寨卡病毒(Zika virus,ZIKV),作为与日本乙型脑炎病毒同一病毒属成员,关于其入侵中枢神经系统的方式知之甚少。因此,探讨ZIKV感染入侵CNS的机制,对于ZIKV感染后的治疗具有重要借鉴意义。
阐述了一种ZIKV感染和入侵CNS的机制。该研究提示ZIKV感染新生小鼠后具有较高发病率和死亡率。ZIKV感染小鼠主要在大脑皮层和海马区进行复制,伴随着血脑屏障通透性的改变。体外BBB模型证实,ZIKV能以不改变BBB通透性的方式穿过BBB到达CNS。ZIKV感染通过抑制RPS6的磷酸化来抑制脑微血管内皮细胞(human brain microvascular endothelial cells,hBMECs)干扰素b(IFN-β)的翻译,促进病毒在hBMECs中的复制。此外,ZIKV感染hBMECs诱导干扰素刺激基因的表达和MAPK信号通路的活化。这些信号通路共同调控ZIKV在hBMECs中的复制。这项研究为ZIKV感染期间病毒在血脑屏障中复制和穿越血脑屏障提供新的见解。

作为一种新兴传染病,ZIKV引起的寨卡热的发病机制尚不明确。近年来研究发现,ZIKV对神经前体细胞具有较强的嗜性,并且ZIKV感染母体后病毒能够到达胎儿CNS并且引起典型的小头畸形症。然而,ZIKV感染和入侵CNS的方式存在较大的研究空白。为了模拟ZIKV感染及发病过程,此研究建立新生鼠ZIKV感染模型,解析ZIKV感染和发病机制。在ZIKV感染的新生鼠模型中,ZIKV MR766毒株和ZIKV H/PF/2013毒株均能导致明显的临床症状和体重的下降(图1B-C),MR766感染组小鼠第9天小鼠全部死亡,H/PF/2013感染组小鼠14天后全部死亡(图1A),说明ZIKV MR766比H/PF/2013毒株具有更强的毒力。组织病理切片表明,ZIKV感染能够引起明显的血管袖套、胶质细胞增生和免疫细胞浸润(图1D),这可能与ZIKV感染引起小鼠死亡有关。
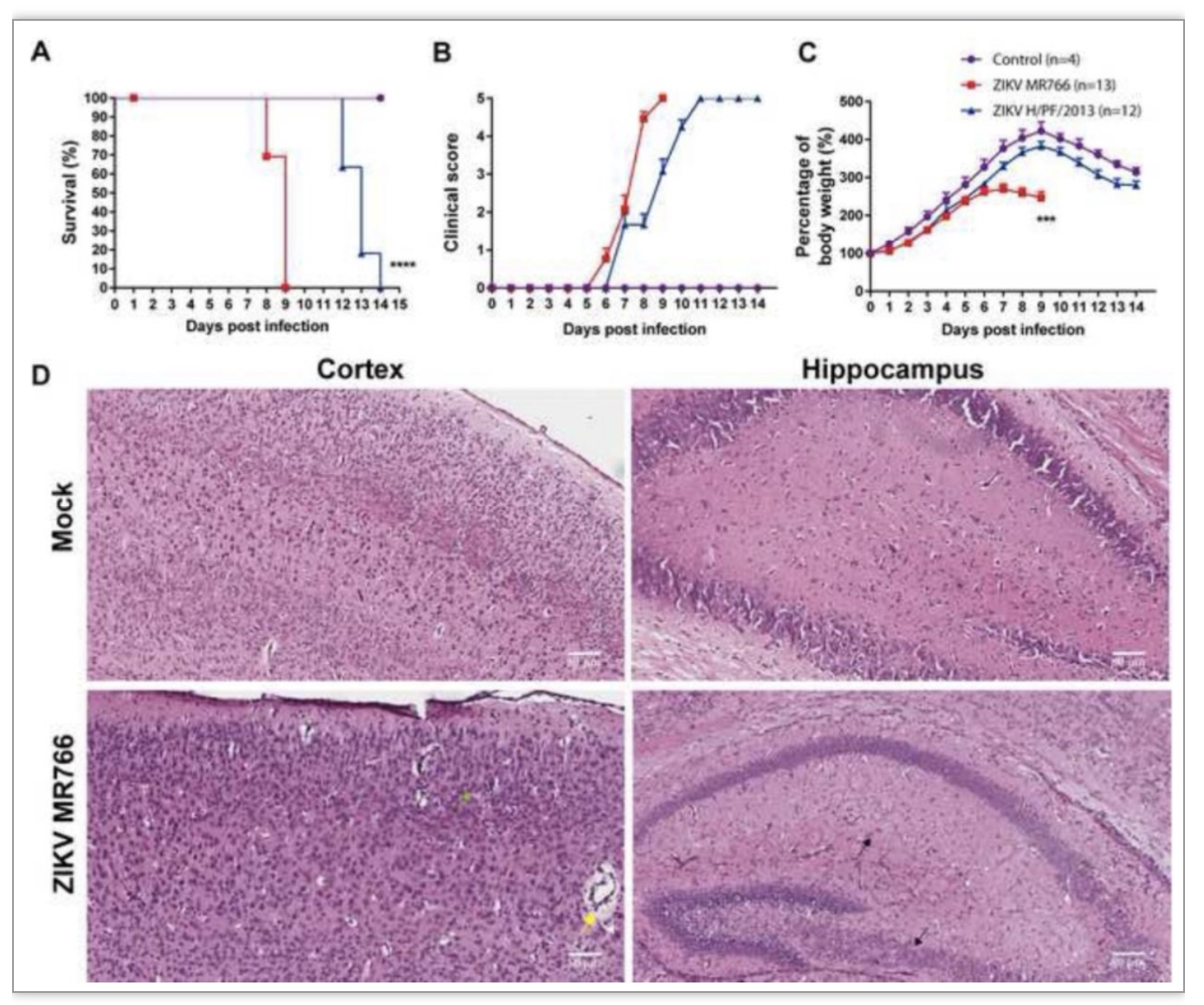
图1.ZIKV感染C57BL/6野生型小鼠模型的建立
(图源:Wang et al., Virology, 2023)
为了探讨ZIKV的致病机理,研究者分析了ZIKV感染C57BL/6野生型小鼠后病毒的分布。通过检测肝脏、肺脏、脾脏、大脑、肾脏和肠道的病毒,发现ZIKV主要在大脑内复制,肠道中也有较低的复制,其他组织只有零星的复制(图2A)。在脑内,ZIKV感染能够诱导IFN-b mRNA显著增加(图2B)。间接免疫荧光分析发现病毒主要分布在大脑皮层区和海马区,其中在海马区呈聚集性分布(图2C-D)。ZIKV感染引起小鼠脑内炎性因子IL-6、TNF-a、IL-1b和IL-18表达上调,伴随着脑微血管内IgG的积累和IgG具有向血管外渗透的趋势,提示ZIKV感染引起脑微血管的渗漏。ZIKV的这种组织嗜性可能与ZIKV引起的成年人格里巴利综合症和胎儿小头畸形有关。
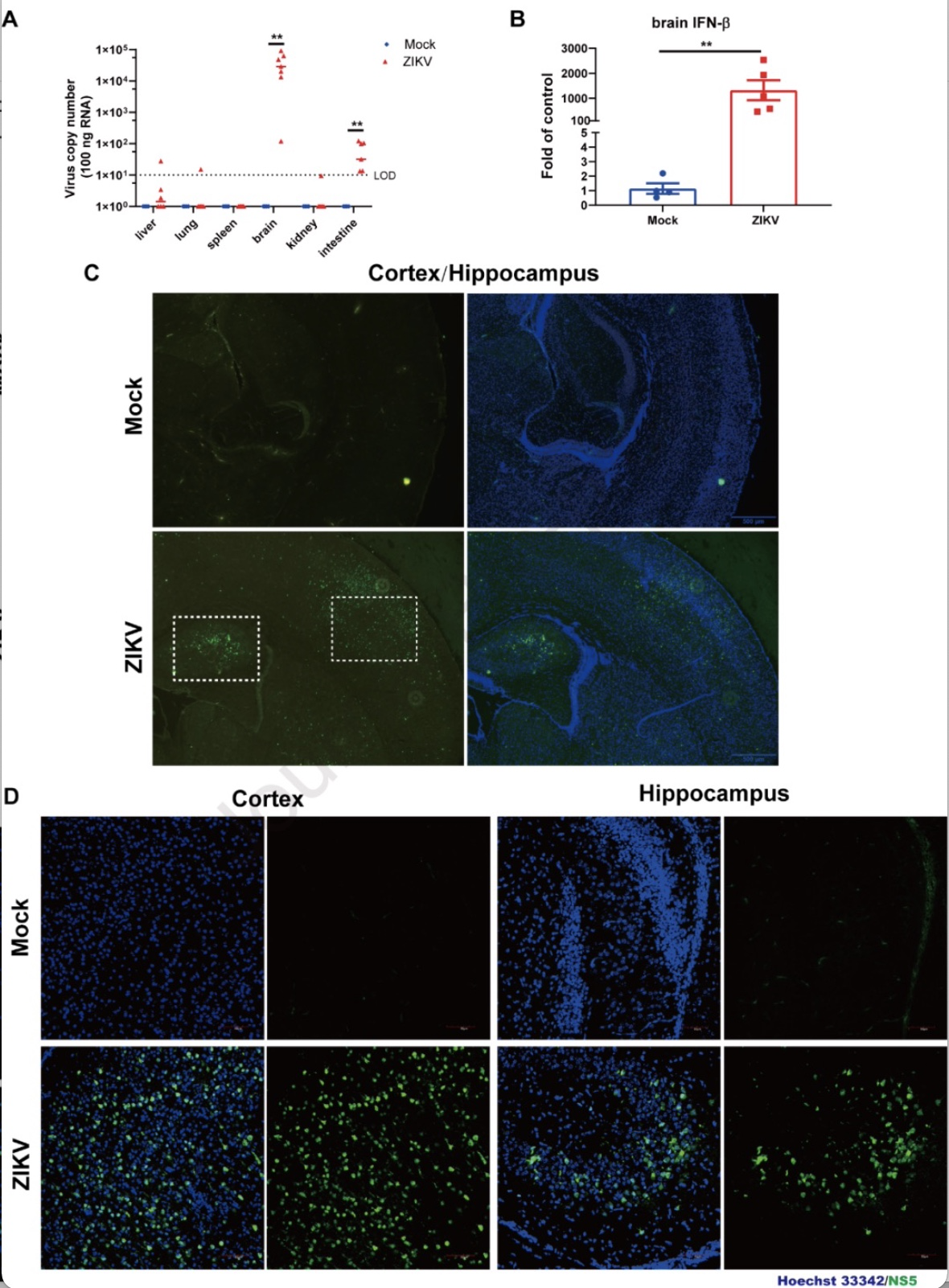
图2.ZIKV在小鼠大脑内的复制
(图源:Wang et al., Virology, 2023)
利用体外BBB—transwell模型研究了ZIKV感染与BBB破坏的相关性及病毒入侵的机理。ZIKV感染hBMECs后,跨内皮电阻和细胞旁通透性未发生改变,说明ZIKV自身并未改变血脑屏障的完整性(图3A-B)。但是,ZIKV感染后,能够在transwell下室检测到病毒(图3C),说明ZIKV可能是通过hBMECs管腔侧感染,从管腔基底侧释放进入CNS。ZIKV感染对hBMECs的细胞活性没有影响(图3D),也未改变紧密连接蛋白occludin和claudin-5的表达,但是引起粘附分子VE-cadherin和b-catenin表达上调(图3E),说明ZIKV感染促使hBMECs发生活化。事实上,ZIKV感染引起了hBMECs细胞骨架F-actin的重排(图3F-G)。
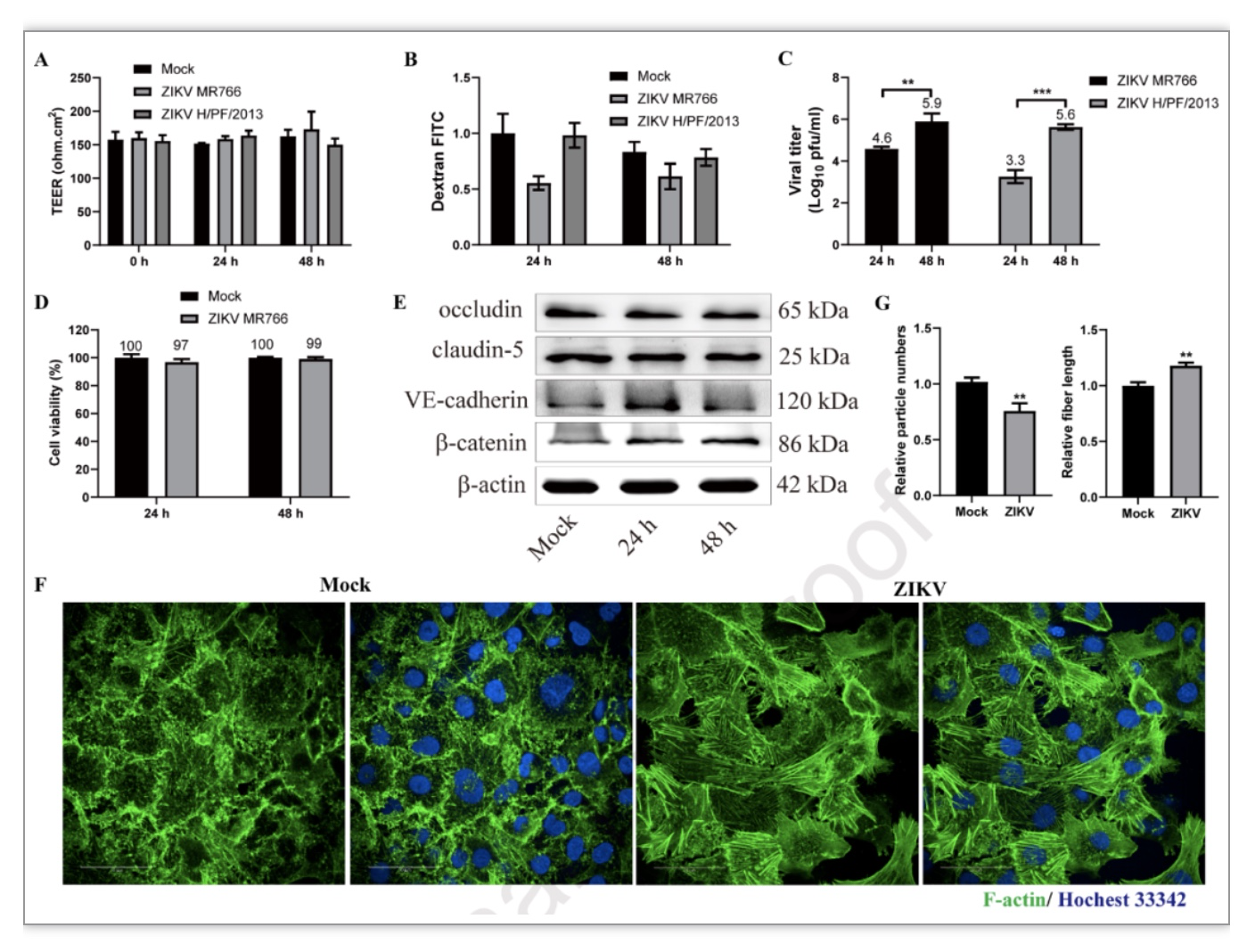
图3.ZIKV感染不改变内微血管内皮细胞的通透性
(图源:Wang et al., Virology, 2023)
ZIKV感染hBMECs能够以不破坏BBB的方式到达CNS,说明ZIKV可能在hBMECs内复制。研究人员发现ZIKV能够在hBMECs中复制较高,而在BV2中复制较低(图4A-B)。进一步分析发现,ZIKV感染hBMECs引起IFN-b mRNA极高水平的增加,而感染BV2诱导的IFN-b mRNA较为有限(图4C-D)。ZIKV感染hBMECs后,IFN-b蛋白的产生低于检测下限;而在BV2中感染前后,IFN-b均有较高水平的表达(图4E)。在hBMECs中IFN-b中mRNA和蛋白水平的不一致,提示ZIKV可能会影响IFN-b的翻译调控。研究者发现,ZIKV感染减少了核糖体蛋白S6(RPS6)的磷酸化(图4F)。考虑到ZIKV对IFN-b极为敏感,研究者在ZIKV感染的Vero培养液中外源添加IFN-b,发现IFN-b的存在降低了ZIKV的增殖(图4G)。这些结果表明ZIKV可能是通过抑制RPS6的磷酸化来抑制IFN-b的翻译。进一步发现ZIKV感染hBMECs可以诱导干扰素刺激基因的产生,激活MAPK信号通路,促进多种趋化因子的分泌。因此,这些过程可能共同调控了ZIKV在hBMECs中的复制。
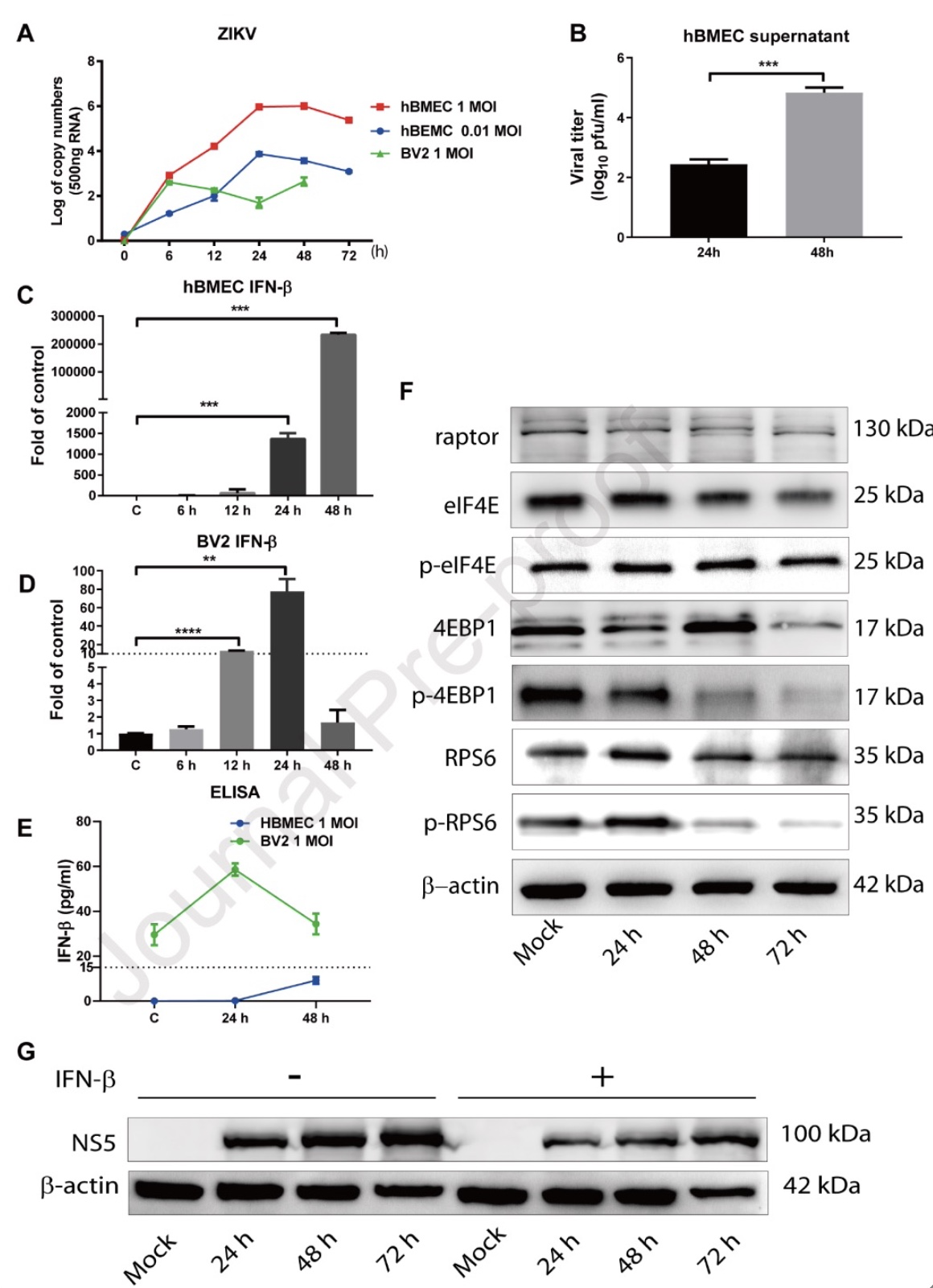
图4.ZIKV通过抑制核糖体蛋白S6磷酸化来抑制IFN-b的翻译
(图源:Wang et al., Virology, 2023)

图5.ZIKV在hBMECs中感染复制和入侵CNS的流程图
(图源:Wang et al., Virology, 2023)

