组蛋白H2B的单泛素修饰(H2Bub1)在真核生物中高度保守,参与调控转录的起始和延伸( Fleminget al, 2008; Pavri et al, 2006)、不同组蛋白之间的交联会话(Briggs et al, 2002; Sun & Allis, 2002)、DNA的损伤应答和修复(Moyal et al, 2011; Nakamura et al, 2011; Shiloh et al, 2011; Zheng et al, 2018)等一系列生命相关活动。在人体中,组蛋白H2Bub1水平的异常参与了多种癌症的发生发展及不良预后(Marsh & Dickson, 2019; Marsh et al, 2020; Zhou et al, 2021)。在酵母细胞中,Bre1和Rad6是催化H2Bub1的泛素连接酶(E3)和泛素转移酶(E2),两者之间如何发生相互作用并调控H2Bub1水平目前还不清楚。
该研究解析了Bre1 的N端Rad6结合结构域(Rad6 binding domain,RBD)与Rad6所形成复合物的结构,揭示了Bre1 RBD与 Rad6发生相互作用具体机制,并且发现Bre1 RBD可有效调控Rad6的活性,参与调控H2Bub1的水平及下游相关事件。

该研究通过X射线衍射获得复合物晶体结构。结构显示,两分子Bre1 RBD形成一个同源二聚体,与一分子Rad6形成复合物(图1A,B)。复合物的相互作用界面位于Bre1 RBD一端和与Rad6活性位点相对的背部,占据约2000Å2的面积,包含氢键、盐桥和疏水相互作用在内的多种作用力。通过对相互作用界面的部分重要氨基酸引入突变和一系列相互作用实验验证,发现多个在相互作用界面发挥重要作用的氨基酸位点(图1A-D)。
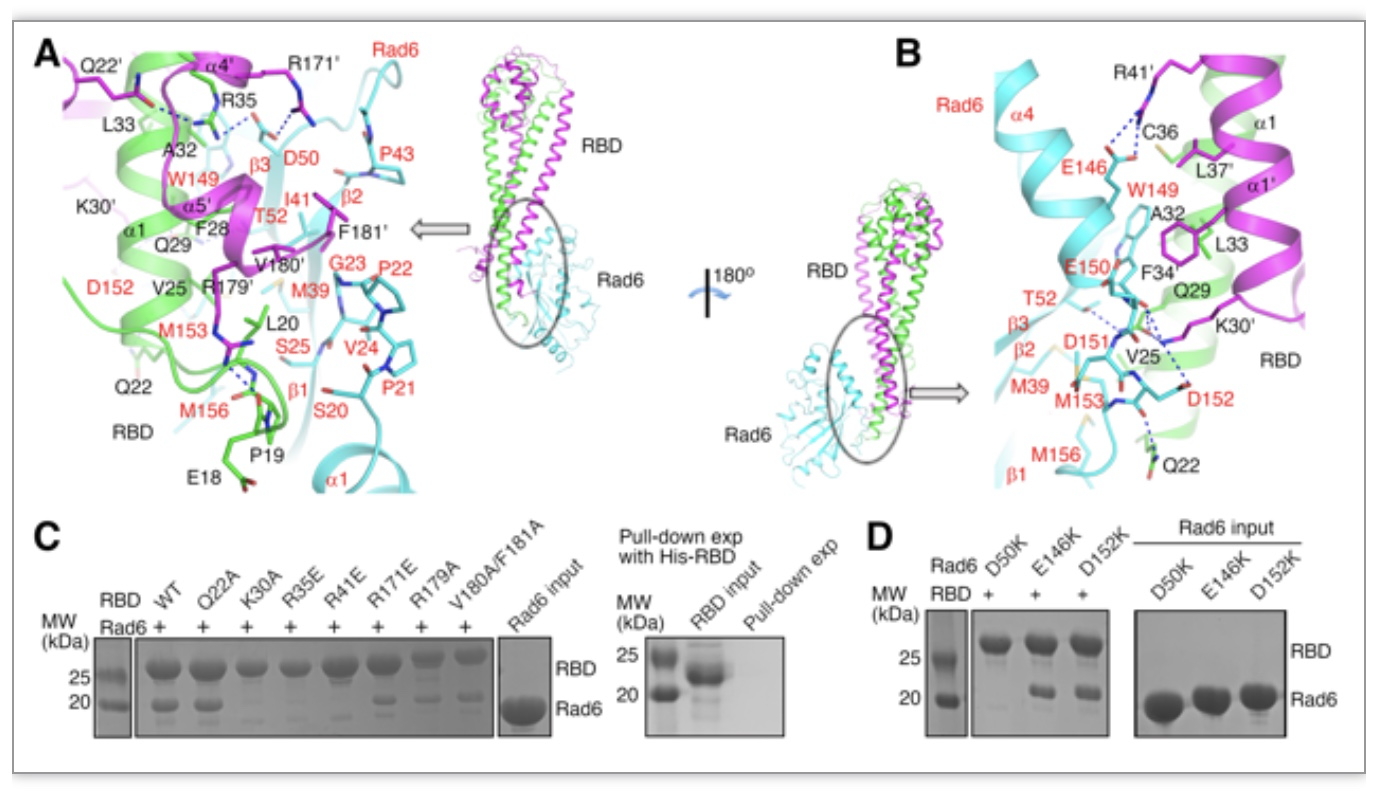
图1.复合物互作界面结构
(图源:Shi, et al., eLife, 2023)
有意思的是,研究发现Bre1 RBD可激活Rad6的酶活性。之前的研究表明,Rad6的背部可结合泛素分子,调控其活性。该研究发现,Bre1 RBD可与泛素分子竞争性结合Rad6背部(图2A),并在结合了Rad6后激活其催化泛素链生成的活性(图2B)。进一步研究表明,造成Bre1 RBD-Rad6相互作用下降的突变降低Bre1 RBD对Rad6的激活能力,提示Bre1 RBD的该能力依赖与它与Rad6的相互作用(图2C)。Bre1 RBD对Rad6的活化主要表现为促进泛素分子从其活性位点向受体底物释放(图2D-G)。
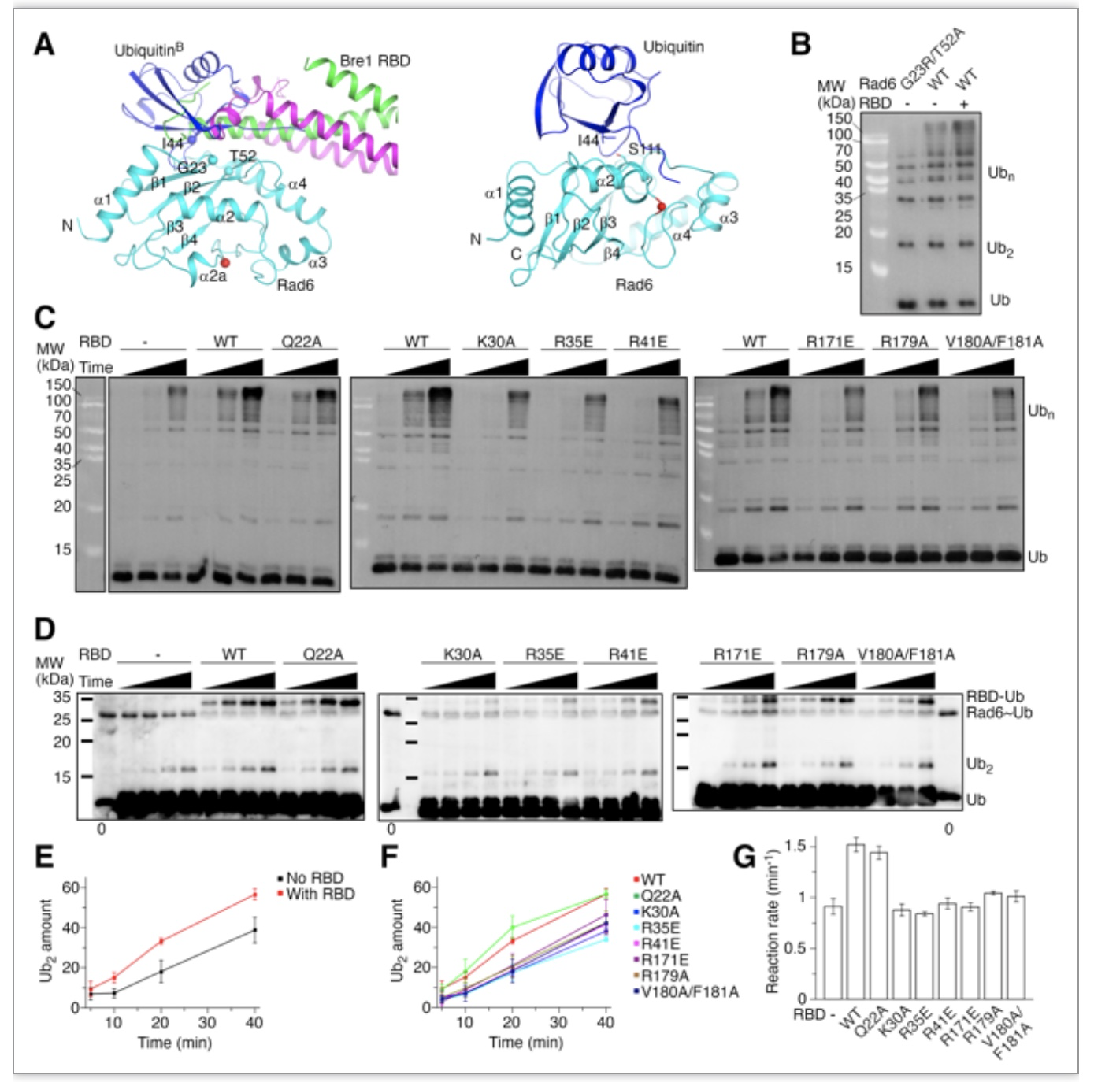
图2.Bre1 RBD激活Rad6的活性
(图源:Shi, et al., eLife, 2023)
结构分析发现Bre1 RBD对Rad6的活化主要体现为促进其活性位点的暴露(图3A-D)。与此一致,用烷化剂标记活性位点的实验表明,在Bre1 RBD的存在情况下, Rad6活性位点的标记显著增加(图3E)。
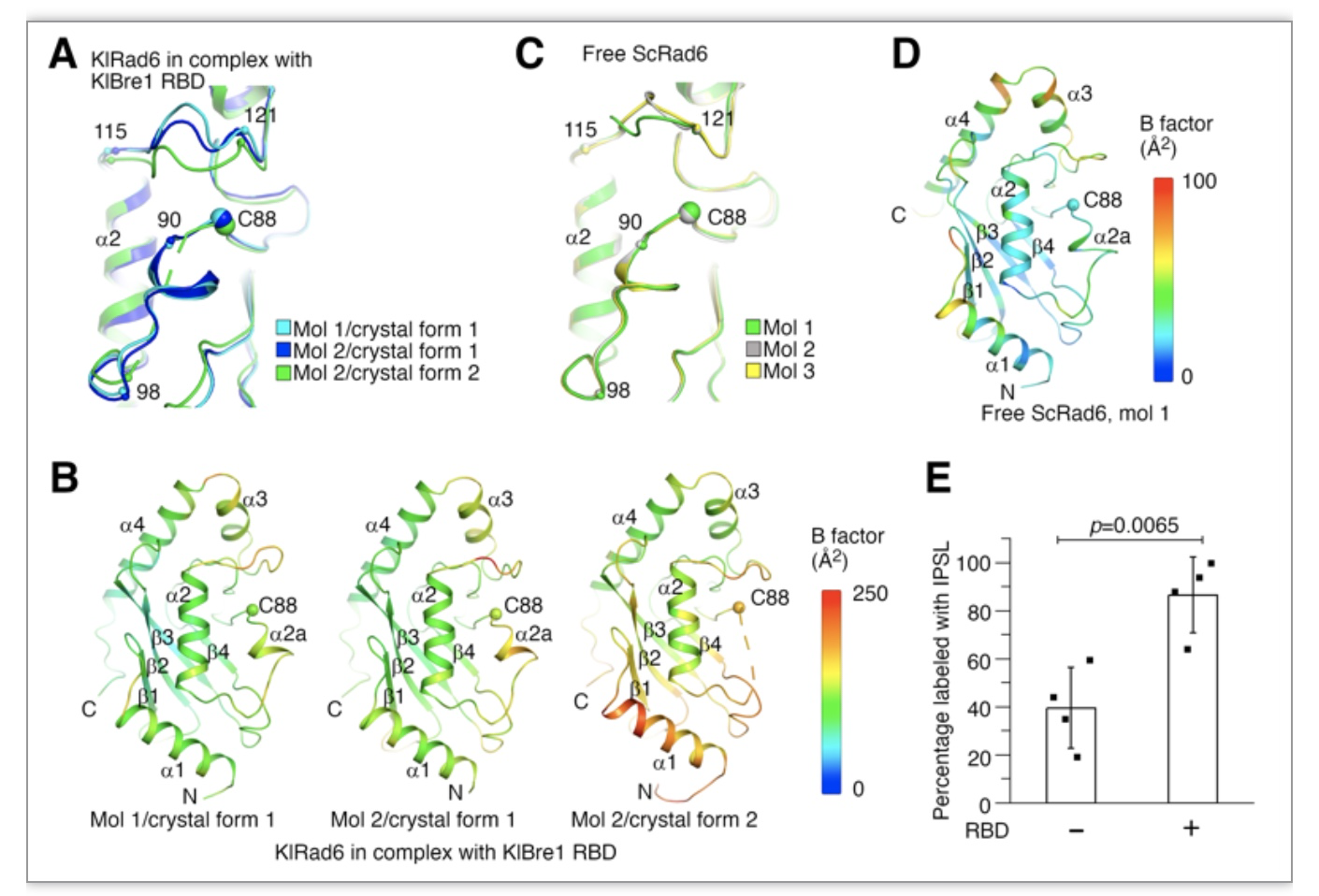
图3.Bre1 RBD增加Rad6活性位点的暴露
(图源:Shi, et al., eLife, 2023)
该研究也通过一系列细胞内实验验证了Bre1 RBD-Rad6相互作用在细胞内的功能。发现Bre1 RBD-Rad6相互作用对细胞H2Bub1的水平至关重要,抑制相互作用的突变导致H2Bub1水平显著下降(图4A)。这些突变也阻止了H2Bub1介导的DNA同源重组修复,并使得细胞对一系列DNA损伤诱导剂的耐受性显著降低(图4B-E)。
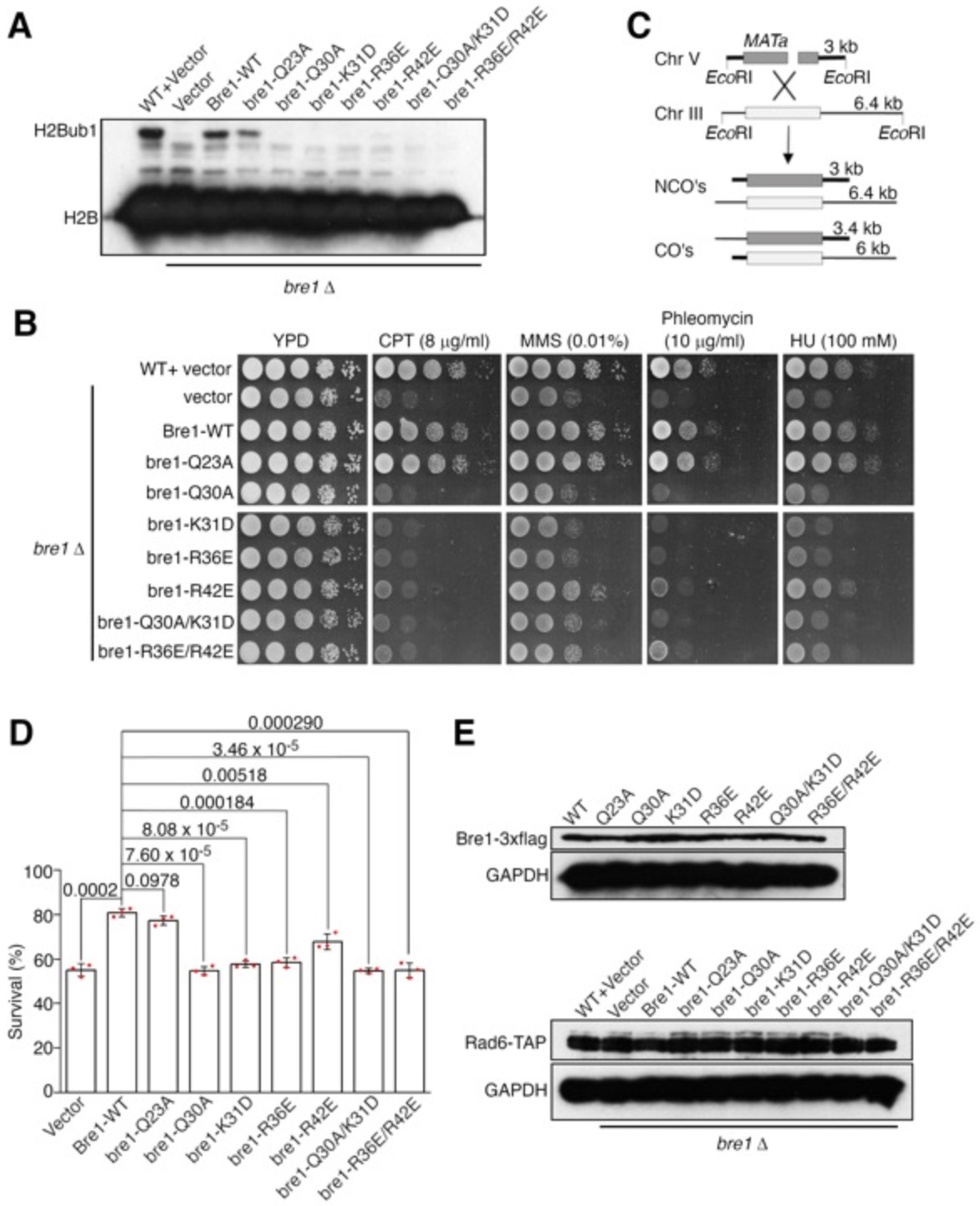
图4.Bre1 RBD与Rad6相互作用具有生物学功能
(图源:Shi, et al., eLife, 2023)

