心肌梗死和心力衰竭等心血管疾病的发病率随着年龄的增长而增加。衰老是导致心血管疾病发展的一个主要因素,但其潜在的分子机制在很大程度上仍然未知,原因之一是缺乏合适的动物模型。

研究材料与方法
研究结果
1 circHIPK3在年轻和中年小鼠心脏中的表达及影响
研究者对不同年龄的小鼠心脏进行RNA-seq,分析得到circHIPK3来源于HIPK3基因外显子2,是一种高表达且高度保守的circRNA。同时检测到circHIPK3在小鼠心、肝、脾、肺和肾脏等组织中均有表达,在心脏中表达最多。随后研究者发现circHIPK3在心脏中的表达水平随着年龄的增长而降低,这提示了circHIPK3可能在心脏衰老的发展中发挥着重要作用(图1)。
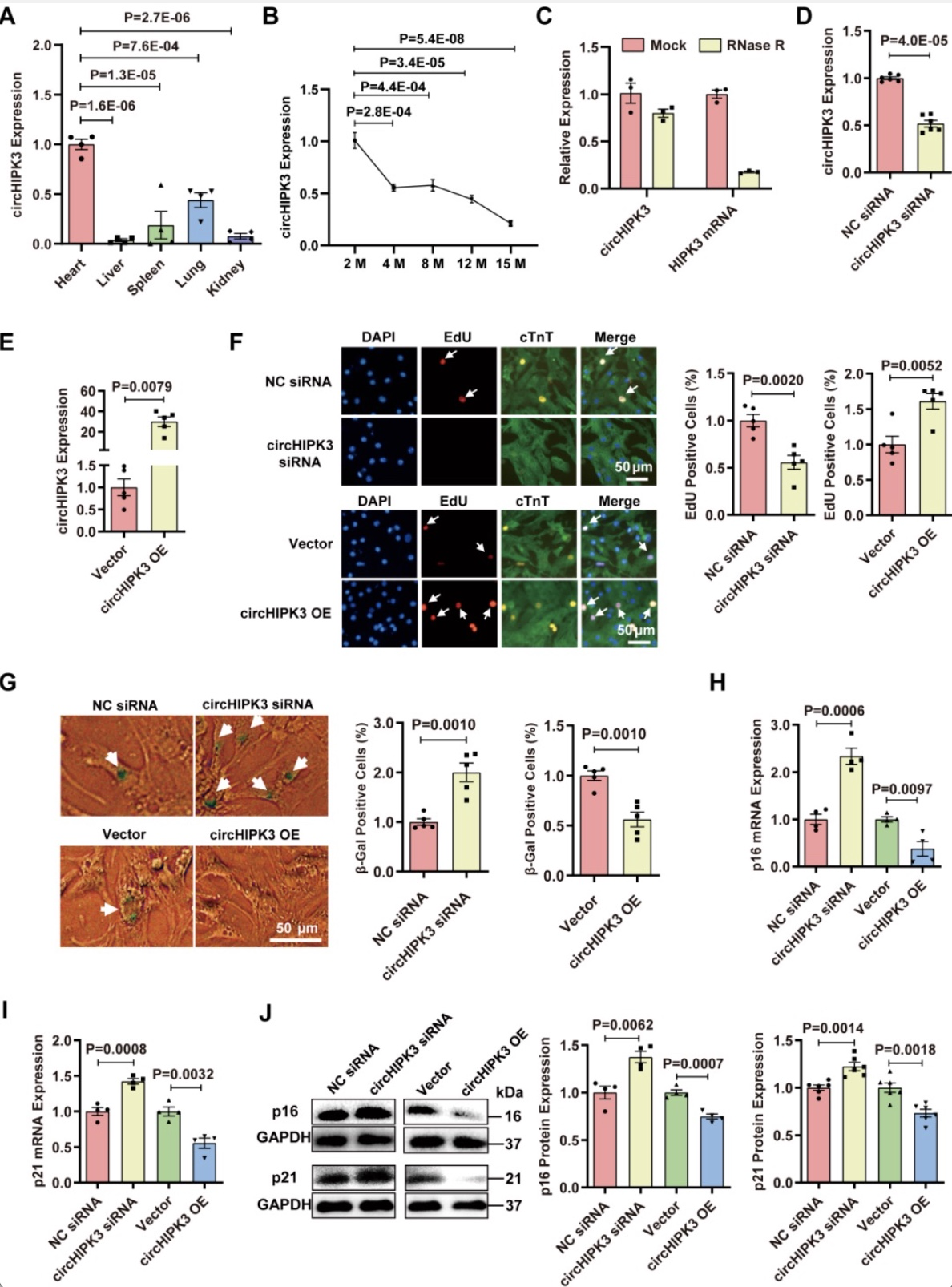
图1 circHIPK3在年轻和中年小鼠心脏中的表达及影响[4]
2 circHIPK3敲除诱导小鼠心脏衰老
为了证实circHIPK3在心脏衰老中的作用[1],研究者用赛业构建的他莫昔芬诱导心肌细胞特异性circHIPK3敲除小鼠,发现与同窝的circHIPK3Flox/Flox小鼠相比,KO小鼠的心功能下降,小鼠端粒长度缩短,p16和p21表达增加,小鼠的繁殖速度非常慢,这表明circHIPK3的缺失损害了发育。这些数据表明,circHIPK3缺失导致心脏早期衰老和心功能障碍(图2)。
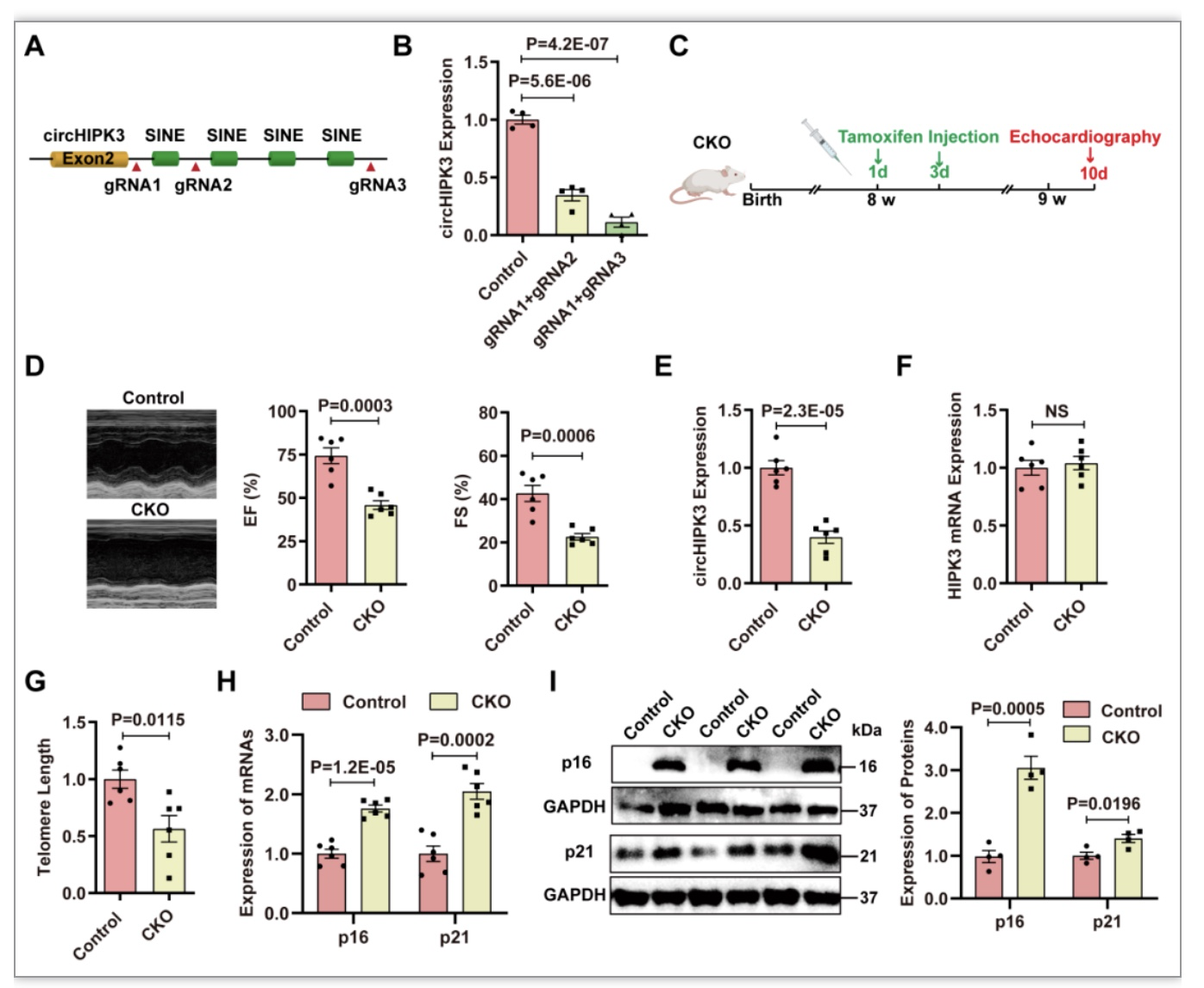
图2 circHIPK3的敲除诱导小鼠心脏衰老[4]
3 circHIPK3调控HuR蛋白表达
为了了解为什么circHIPK3缺失会导致p21上调,研究者通过circRNA相互作用网站(https://circinteractome.nia.nih.gov/)分析了circHIPK3可能的靶蛋白。分析没有发现p21或p16是circHIPK3的靶点,但是在人源中发现HuR和circHIPK3之间有三个结合位点。随后RPISeq分析(http://pridb.gdcb.iastate.edu/RPISeq)证实circHIPK3在小鼠中与HuR结合,且HuR蛋白在人和小鼠之间高度保守[2]。通过PPI数据库(https://www.string-db.org/)分析发现,HuR通过调节SIRT1、细胞周期相关蛋白和端粒长度参与衰老的发展,这表明HuR蛋白可能直接参与衰老过程。重要的是,HuR与p21 mRNA 3'-UTR区域的ARE结合,增加其稳定性,最终导致p21蛋白在细胞质中的表达增强(图3)。
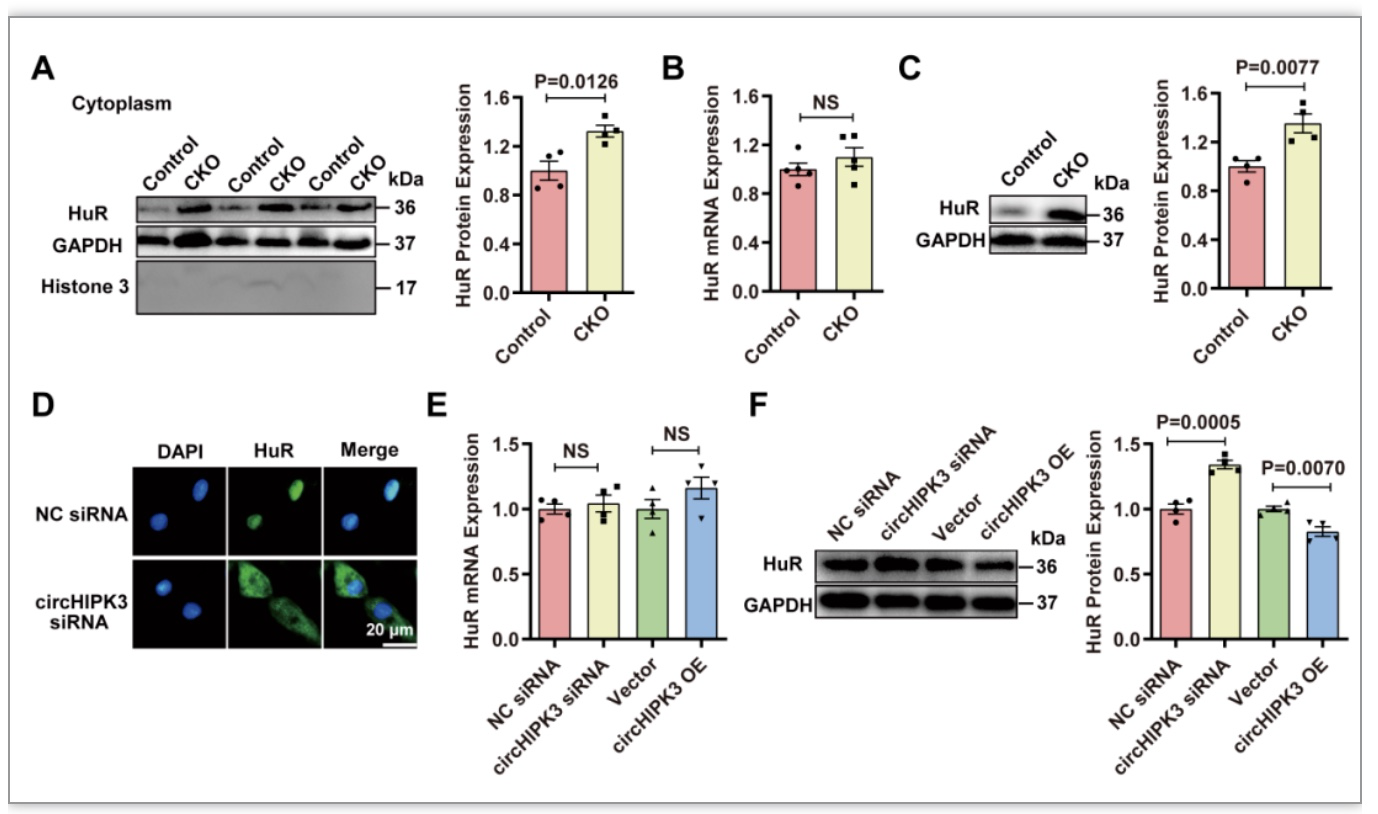
图3 circHIPK3调控HuR蛋白表达[4]
4 circHIPK3作为HuR和E3泛素连接酶的支架,促进HuR降解
前期研究表明,HuR可通过泛素-蛋白酶体途径与E3泛素连接酶β-TrCP相互作用降解[3]。事实上,在PPI数据库中可以找到HuR与E3泛素连接酶β-TrCP之间的相互作用。研究者试图用特定的蛋白酶体抑制剂MG132处理H9C2细胞,以阻止蛋白质通过蛋白酶体降解,以确定circHIPK3诱导的HuR蛋白下调是否由泛素-蛋白酶体系统介导。MG132处理增强了敲低circHIPK3诱导的HuR在细胞质中的积累,说明HuR被蛋白酶体降解,而敲低circHIPK3细胞中相对较高的HuR水平是由于抑制了HuR的降解。
RNA-pulldown同WB判定了circHIPK3和HuR之间的结合,RIP实验和qRT-PCR再次验证二者结合。这表明circHIPK3可能通过直接相互作用调节HuR的稳定性(图4)。
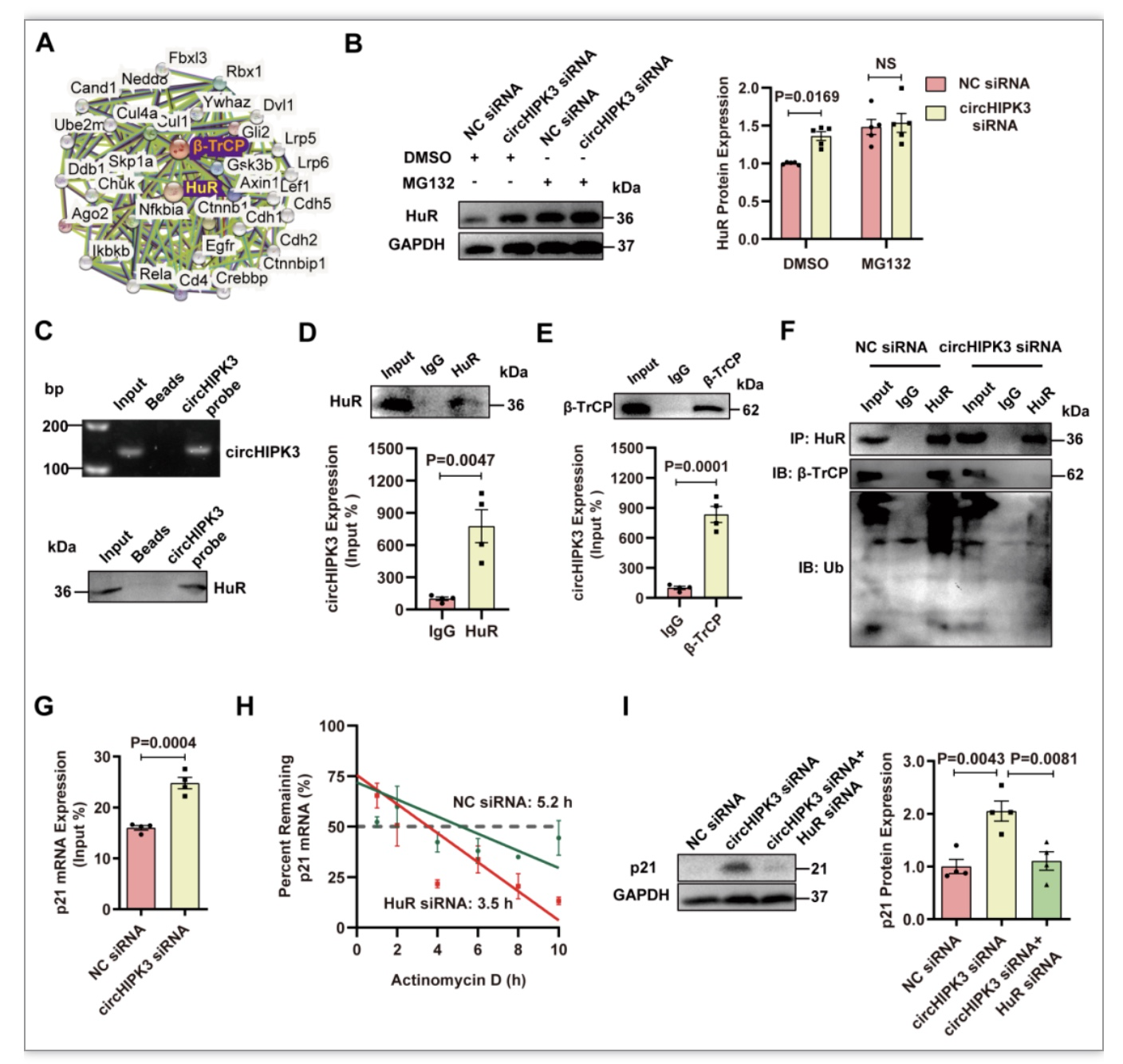
图4 circHIPK3作为HuR和E3泛素连接酶的支架,促进HuR降解[4]
5外泌体通过释放circHIPK3来防止心肌细胞衰老
外泌体含有非编码RNA,包括microRNA、lncRNA和circRNA。有研究表明,间充质来源的外泌体(UMSC-Exos)可抑制衰老引起的血管功能障碍和心功能障碍。研究者发现circHIPK3在外泌体中富集。外泌体circHIPK3处理可导致H9C2细胞中circHIPK3表达上调,并促进H9C2细胞增殖,抑制衰老,降低p16和p21的表达。不过,敲低circHIPK3可抑制外泌体对衰老的保护作用。这些结果表明了外泌体通过传递circHIPK3促进H9C2细胞增殖并抑制其衰老(图5)。
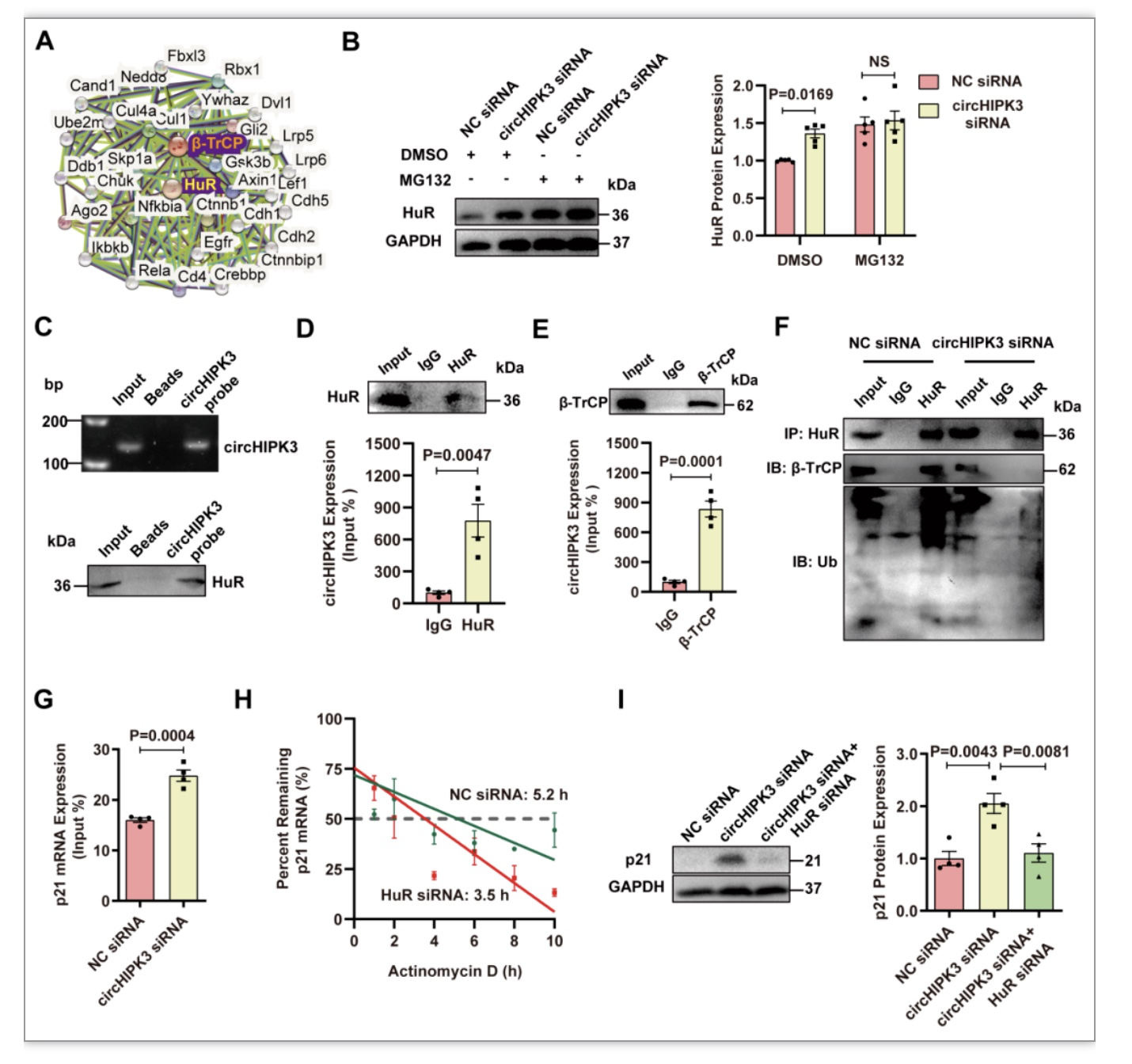
图5外泌体通过释放circHIPK3来防止CM衰老[4]
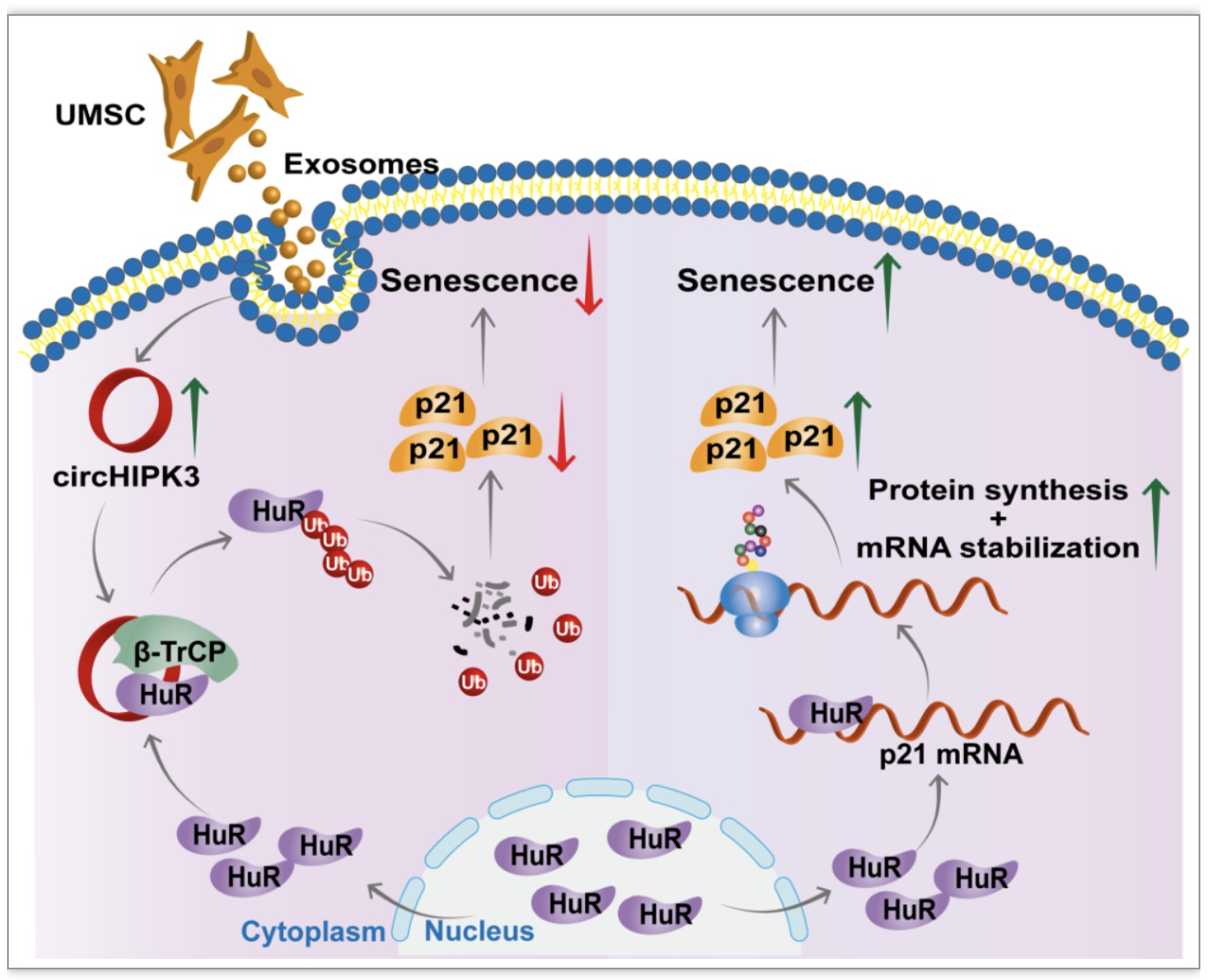
图6 circHIPK3/HuR/p21在心脏早衰中的调控机制[4]

