阿尔兹海默症(AD)是一种神经退行性疾病,症状包括记忆力下降、短期学习能力下降、语言功能障碍等,是导致痴呆最常见的原因[1]。目前,全球有超过5000万⼈受到痴呆症的影响,其中约70%是AD引起的[2]。
糖基化是最常见的蛋白质翻译后修饰,糖蛋白上糖链的种类按照其连接区和蛋白质连接键的性质区分,主要有N-聚糖和O-聚糖两大类。另有一种特殊的蛋白质糖基化模式:蛋白质O-GlcNAc化,它指的是单个GlcNAc被添加到丝氨酸和苏氨酸上。糖蛋白在细胞内发挥重要的生物学作用。
越来越多的研究表明AD细胞中一些关键蛋白的糖基化模式发生改变,暗示糖基化与AD间的有趣联系[3-8]。对蛋白质糖基化和AD关系的进一步研究,可能对AD的发生机制产生新的理解。同时,在AD细胞中被异常糖基化的蛋白可以作为AD临床诊断的生物标志物和治疗的潜在靶点,为AD的精确诊断和高效治疗提供新的思路。综述总结了目前发现的AD细胞中一些重要蛋白糖基化模式改变的情况,介绍对于蛋白质糖基化影响AD产生机制的最新研究进展,以及蛋白质糖基化在AD检测和治疗中的潜在应用,着重关注了N/O/O-GlcNAc/唾液酸化对AD中各重要蛋白质的不同影响。这些发现有助于进一步深入研究AD蛋白质糖基化,也为AD的诊断和治疗提供了新的思路。
一、AD中标志性蛋白APP和tau的糖基化水平与类型改变
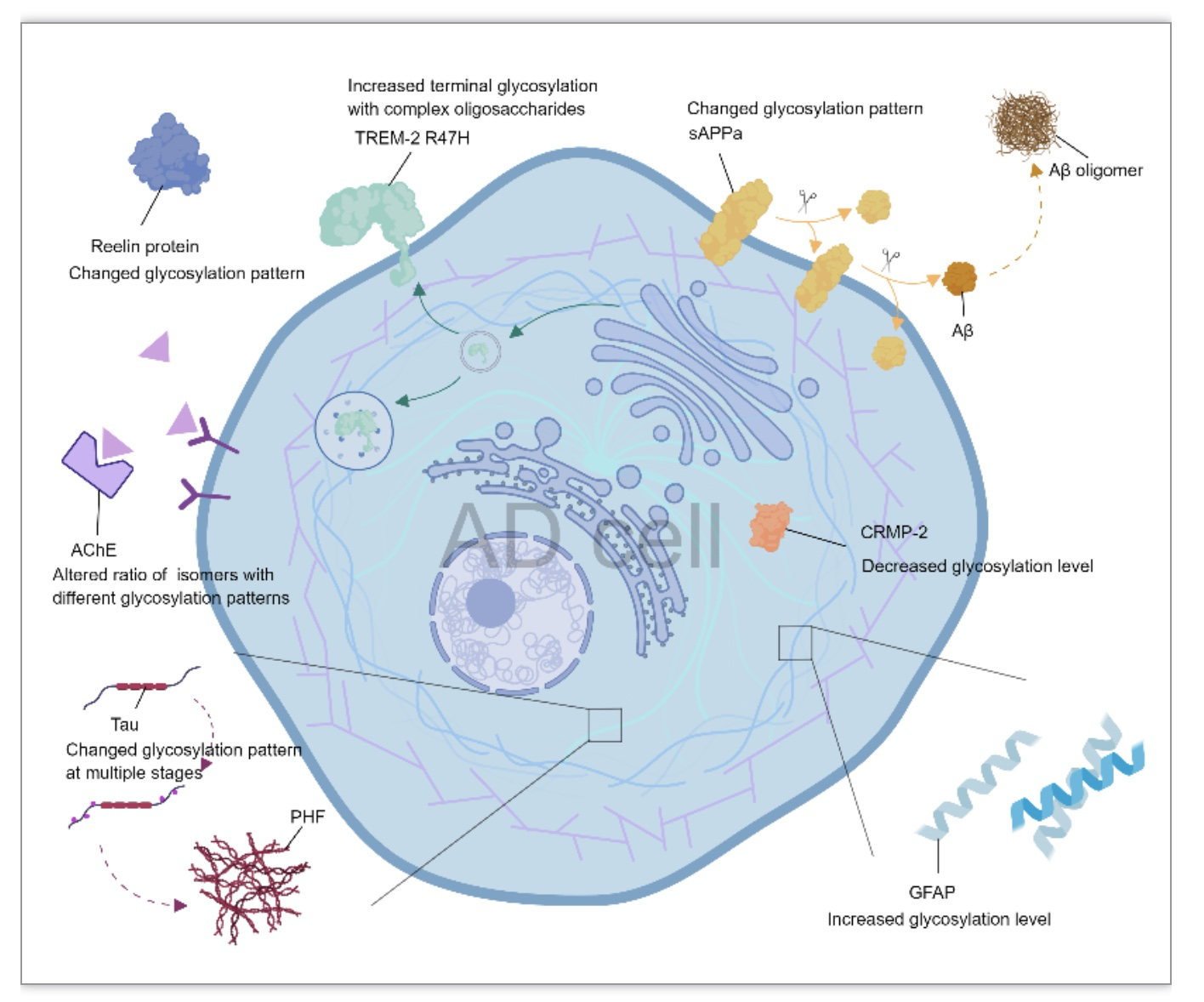
淀粉样前体蛋⽩(APP)在健康人体的细胞中先由α-分泌酶切割,再由γ-分泌酶切割成可以完全降解的⼩⽚段。而在AD细胞中,APP则先后由β-分泌酶和γ-分泌酶切割,产生不同长度的Aβ片段。Aβ聚集形成斑块或毒性更大的低聚物[9]。近期发现α、β、γ分泌酶切割APP的过程大部分发生在其在高尔基体中被O-糖基化修饰之后[10],这暗示着APP被哪种途径加工水解可能受其糖基化模式影响,导致不同产物的产生,这种影响可能出自这类O-糖基化对APP构象的诱导。β分泌酶和γ分泌酶还分别能够通过除切割以外的机制影响APP的唾液酸化程度和复杂N-糖基化情况[11]。可以认为APP与多种分泌酶之间存在复杂的互相调控的关系。此外,Aβ蛋白似乎也能够影响前体蛋白的糖基化,暗示APP加工产物对其前体的反馈式影响。几种分泌酶的活性似乎也可以由其糖基化模式影响。
tau蛋白是AD中的关键蛋白,是一种微管相关蛋白,其过度磷酸化会导致异常缠绕和积聚,造成AD一个经典的神经病理学特征:细胞内神经原纤维缠结(NFT)形成。AD细胞中tau蛋白早期的异常糖基化多数是N-糖基化[12],这种N-糖基化能够以位点依赖的方式促进之后的tau异常磷酸化。相反,AD脑样本产生的富含tau的细胞骨架部分的蛋白质O-GlcNAc糖基化显着降低,暗示O-GlcNAc糖基化对tau蛋白磷酸化的整体负向调节[5]。过度磷酸化的tau形成的神经原纤维缠结中则检测出相比于正常人脑更高的O-糖基化水平[6]。这些结果暗示糖基化模式变化可能出现在tau蛋白的多个形成阶段,且不同的糖基化模式对tau蛋白形成的影响不同。在tau的聚集过程中,O-GlcNAc糖基化则又减缓tau纤维化组装的速度[13]。这也引出了一种可行的改善AD症状的思路:提高tau蛋白的O-GlcNAc糖基化水平,从而抑制其过度磷酸化和纤维化组装。
二、AD病人中金属离子代谢和氧化应激关键蛋白糖基化水平与类型改变
糖基化还可能通过改变氧化应激影响AD发病。氧化应激是AD重要的发病机制之一。转铁蛋白是一种糖基化的金属结合血清蛋白,能够通过⾎液将铁运输到细胞。转铁蛋白具有促氧化特性的变体TfC2的等位基因频率在AD患者中变高。转铁蛋白的糖基化种类和水平在AD患者细胞中都发生变化[14-16]。多个实验结果提示糖基化可能通过调节转铁蛋白的寿命影响其功能,进而调节细胞中氧化应激,或改变铁的转运情况,间接调控铁的稳态。AD的脑脊液(CSF)中Tf异构体特有的糖基化模式则有潜力作为AD的检测指标。
其他与氧化应激有关的酶也被发现受到糖基化的调控。如Cu,Zn-超氧化物歧化酶(Cu,Zn-SOD)的活性由于糖基化水平升高而降低[17]。这种酶在机体氧化与抗氧化平衡中起关键作用[18]。Cu,Zn-超氧化物歧化酶的水平也与细胞内的金属稳态有关,暗示糖基化和金属稳态之间或许存在直接或间接的相互影响关系。其他抗氧化酶的糖基化翻译后修饰改变也会导致在病理条件下酶活性丧失或降低,从而导致氧化应激[17]。
最近的研究表明,Reelin蛋白水平在包括AD的几种神经退行性疾病的大脑和脑脊液中上调。AD中reelin蛋白糖基化模式发生改变。并且脑脊液和⾎浆Reelin对LCA、RCA等凝集素均显示不同的结合特性,暗示脑脊液和血浆reelin具有不同的细胞起源[8]。
AchE and BuchE
乙酰胆碱酯酶AchE在人体内有多种分子形式,不同分子形式的AchE的糖基化模式不同[19, 20]。不同糖基化模式的AchE异构体在AD中的比例改变。异常糖基化的AchE可能来自大脑细胞。丁酰胆碱酯酶(BuChE)的糖基化在AD的CSF中被发现发生了改变。结合CSF的AChE-BuChE糖基化分析被认为可以以超过90%的敏感性和特异性识别AD病例[21]。
骨髓细胞-2上表达的触发受体的R47H编码变体(TREM2-R47H)近期被报道参与AD的发病机制。TREM2有几种突变体,其中R47H变体在AD中表达量上升,被认为增加了人患AD的风险。TREM2-R47H具有改变的糖基化模式和被降低的稳定性[22]。
载脂蛋白E(APOE)和载脂蛋白J(APOJ)已被证明与阿尔茨海默病的发生有关[23, 24]。作为一种O糖基化的蛋白质[25],APOE的糖基化修饰被认为提高其溶解性,且影响神经元的健康。APOE有多种亚型。对APOE糖基化模式的检测,可能帮助预言人患AD的风险。最近的研究证实脑脊液APOE糖基化百分比与脑脊液Aβ42水平呈正相关。AD脑中的APOJ含量比正常脑高出40%左右。APOJ蛋白在细胞内被高度糖基化,共有六个N-糖基化位点,每个位点具有不同程度的糖基化多样性。血浆APOJ的糖基化模式和亚型与海马体萎缩水平相关[26]。
以上AD关键蛋白的糖基化变化被总结在图1中。图2总结了这些糖基化变化在AD发展中起到的作用,希望帮助读者清晰快速地理解本文的重点。
(图源:Zhao J, Lang M. Cell Death Discov. 2023)
图2. AD关键蛋白糖基化变化与AD发病机制的关系
(图源:Zhao J, Lang M. Cell Death Discov. 2023)
四、N-/O-/O-GlcNAc糖基化在AD中均产生整体变化
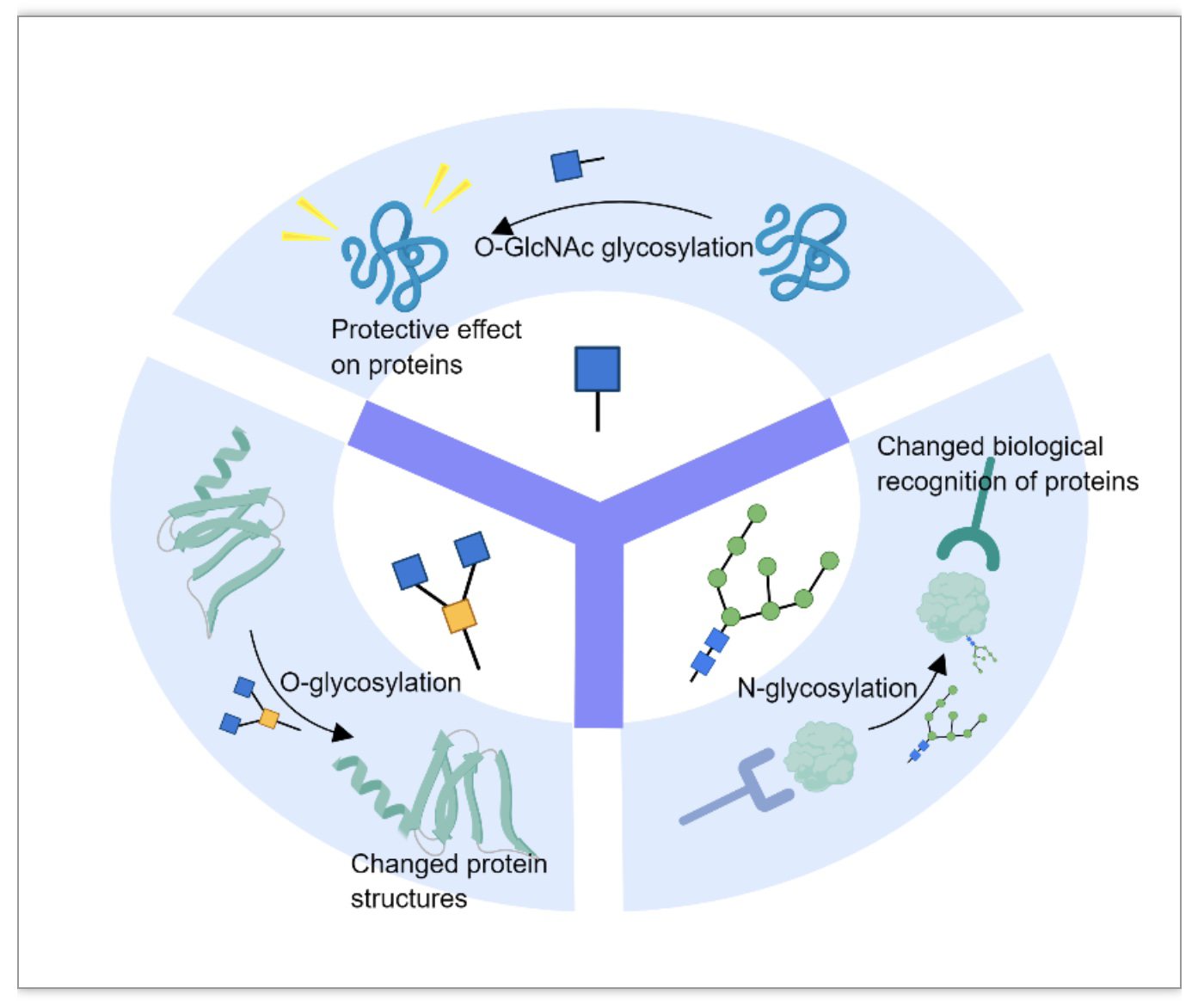
综合性糖分析关注N-糖基化,O糖基化和O-GlcNAc糖基化在AD脑中呈现的整体性的变化趋势。在AD中明显受损的一些脑区,参与N糖基化和O糖基化的多种酶水平表现下调。蛋白质O-GlcNAc糖基化的整体水平在AD中降低,但在海马中有所增加。这些发现暗示着糖基化模式与AD发展之间的整体相关性。探究N-/O-/O-GlcNAc糖基化对蛋白质结构功能的影响对于研发对症的AD药物将有很大的帮助。本综述总结后认为N-糖基化与蛋白质的生物识别有关,如参与APP和TREM2的加工和向胞膜的转运。O-糖基化主要影响蛋白质的结构。O-GlcNAc则表现出了显著的积极的保护作用,如帮助减少蛋白质的动态变化,导致稳定性增强等。O-GlcNAc糖基化还能够通过位点竞争减少tau的磷酸化,抑制PHF的生成(图3)。
由于几种糖基化的水平在AD脑中都呈现出整体变化的趋势, AD脑中整体的糖基化水平有潜力成为AD诊断和治疗的新目标。然而,需要注意的是,蛋白质的糖基化模式在AD中发生的变化是复杂的,如蛋白质O-GlcNAcylation和N-/O-糖基化途径之间可能存在负相关关系,表明不同糖基化模式之间可能存在相互调控[27]。
图3. N-/O-/O-GlcNAc糖基化对蛋白质的影响
(图源:Zhao J, Lang M. Cell Death Discov. 2023)
目前不少关于AD糖基化的实验关注蛋白质糖基化影响AD发病的机制。已经发现,糖基化模式的改变可能影响APP蛋白的加工产物,改变tau的异常磷酸化程度,直接影响AD的病理特征。糖基化还会通过调控转铁蛋白、Cu, Zn-SOD等酶的寿命和活性来影响细胞的氧化应激。此类研究有助于更加深入地理解AD的病理特征和发病机制。
在AD中糖基化模式改变的蛋白质可能作为AD诊断的生物标志物。如何准确检测糖基化水平的改变、如何确定这种改变是在AD中的特异性改变是技术的关键。靶向特定蛋白质,改变糖基化水平的药物也被视作有潜力治疗AD的新药物。但是,由于蛋白质糖基化模式在AD中发生的变化是复杂的,且存在相互影响的关系,设计药物时要尤其注意可能造成的对细胞内糖稳态的不良影响。