如果细胞要表现出复杂的、组织特异性的表型,需要一系列的基因特异性表达,而转录因子在基因的表达中起到关键性的作用。转录因子KLF7(Krüppel-like factor 7)是一种含锌指结构的转录因子,属于KLFs家族。KLF7在生物体各组织内广泛表达,参与调控细胞的增殖、分化、再生以及肿瘤发生等重要的生理功能[1]。研究表明,KLF7在发育中的中枢和周围神经系统中高度表达,可促进神经轴突、树突的生长与再生[2];近年来,临床研究表明 KLF7与智力障碍和自闭症有关,位于染色体2q33.3上的KLF7可能是与2q33.3q34缺失型自闭症患者表型相似的候选基因之一[3,4]。然而,目前对于KLF7如何调控发育期的大脑皮层、胼胝体等区域中的神经细胞增殖、分化和迁移相关的分子机制尚不清楚。
2023年7月3日,Brain Pathology上在线发表了题为“Krüppel-like factor 7 deficiency disrupts corpus callosum development and neuronal migration in the developing mouse cerebral cortex”的文章。该研究从分子、细胞水平系统地阐述了神经祖细胞中KLF7的条件性敲除导致大脑皮层中神经元发生、迁移受损,胼胝体发育缺陷;通过转录组分析研究KLF7调控参与神经元分化和迁移的一系列基因,其中包括p21和Rac3。这为了解KLF7突变引起的神经系统疾病的潜在机制奠定了基础。
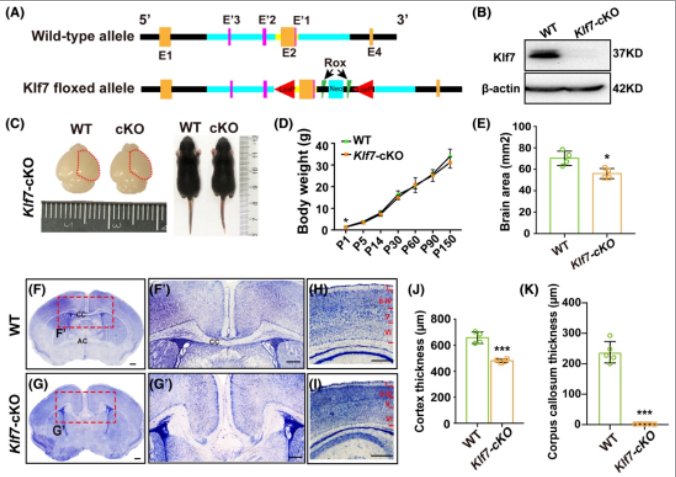
为了研究KLF7在大脑发育过程中的具体作用,作者成功构建了Klf7 flox/flox转基因小鼠模型,并与Emx1-Cre小鼠交配繁殖得到Klf7条件性敲除小鼠,即Emx1-Cre; Klf7flox/flox (Klf7-cKO) (图1A,B)。通过组织形态学观察发现,与野生型小鼠相比,Klf7-cKO小鼠的脑面积和体型均变小(图1C-E)。而且,KLF7条件性敲除后导致大脑皮层变薄,且出现严重的胼胝体(Corpus callosum, CC)发育缺陷,胼胝体轴突无法穿过中线,前连合(Anterior commissure, AC)也严重破坏(图1F-K)。
(图源:Wentong Hong, et al., Brain Pathol, 2023)
一、Klf7-cKO小鼠发育过程中出现中线胶质群畸形和轴突异常
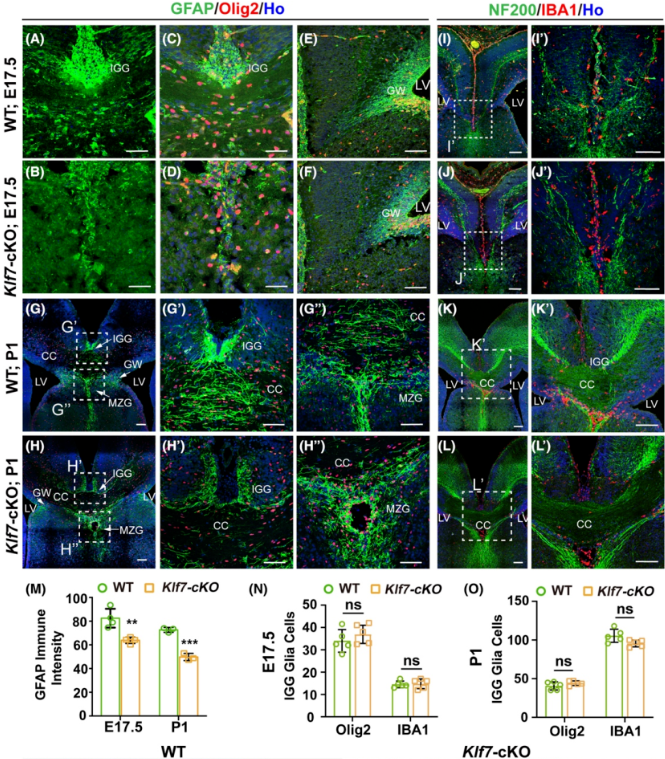
为了进一步了解Klf7-cKO小鼠出现严重的胼胝体发育缺陷的原因,研究从胼胝体发育的前提条件——中线胶质细胞群在KLF7缺失后的变化入手,中线胶质细胞群包括胶质楔(Glial wedge,GW),灰被(Indusium griseum,IGG),中线拉链胶质(Midline zipper glia,MZG)[5]。作者采用GFAP,Olig2,IBA1等胶质细胞等标记物研究中线胶质细胞结构在胚胎晚期和出生后早期的Klf7-cKO小鼠中的变化。结果发现,与野生小鼠相比,在Klf7-cKO小鼠胼胝体发育过程中出现IGG和MZG结构畸形(图2A-H,M-O)和穿越中线的轴突异常(图2I-L,P-Q),这表明KLF7缺失后导致中线胶质结构中的IGG,MZG异常,胼胝体的轴突束在穿过中线时无支撑和引导,从而无法正常越过中线。
(图源:Wentong Hong, et al., Brain Pathol, 2023)
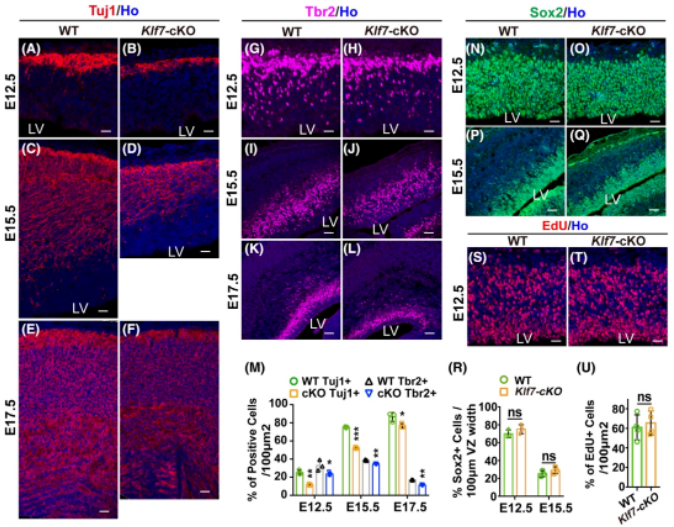
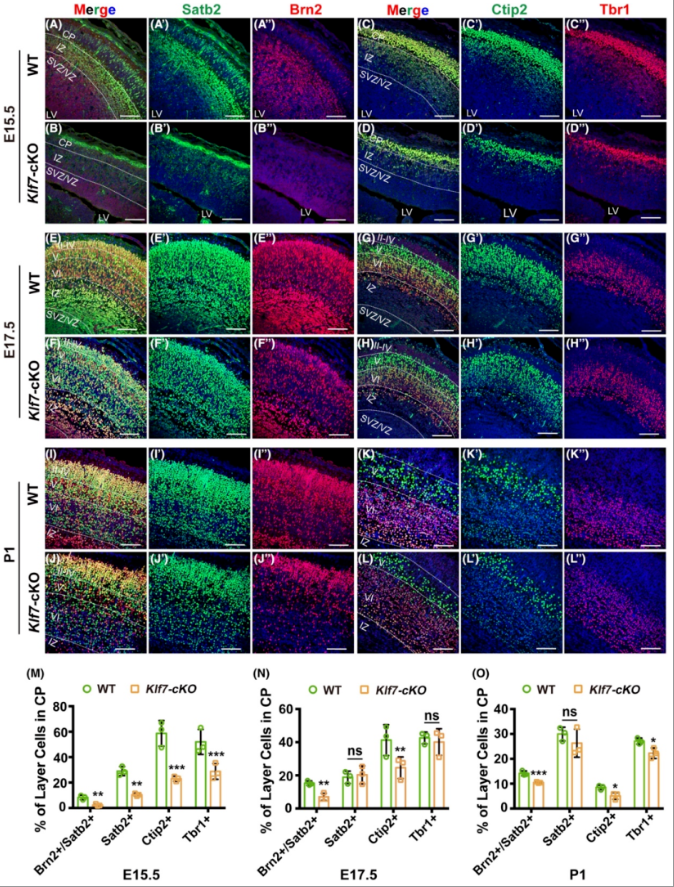
为了评估KLF7对胚胎期神经元分化的影响,作者采用免疫荧光分析对胚胎不同时期(E12.5, E15.5, E17.5)的大脑皮层进行标记,结果发现与对照组相比,Klf7-cKO小鼠皮层中的新生神经元(Tuj1)及中间祖细胞(Tbr2)的数量在每个时间点都明显减少(图3A-M)。为进一步探究,作者还采用不同层特定的神经元标记物进行分层标记,其中Satb2代表II-IV层神经元,Brn2代表II/III层神经元,Ctip2代表第V层神经元,Tbr1代表第VI层神经元,结果显示KLF7缺失后导致胚胎发育期及出生后早期(E15.5、E17.5、P1)大脑皮层整体的六层结构似乎没有变化,但是各层神经元的数目相较于野生型显著减少(图4A-O),这些结果说明KLF7条件性敲除后导致神经元发生受损。另外,采用Sox2标记以及EdU细胞示踪研究神经祖细胞的增殖情况,结果显示Klf7-cKO小鼠与野生小鼠相比,神经祖细胞的数量没有明显变化(图3N-U)。综上,KLF7条件性敲除抑制大脑皮层中神经元的生成,但不影响脑室区附近的神经祖细胞的增殖。
(图源:Wentong Hong, et al., Brain Pathol, 2023)
图4 KLF7条件性敲除抑制发育中后期的大脑皮层中各层神经元形成
(图源:Wentong Hong, et al., Brain Pathol, 2023)
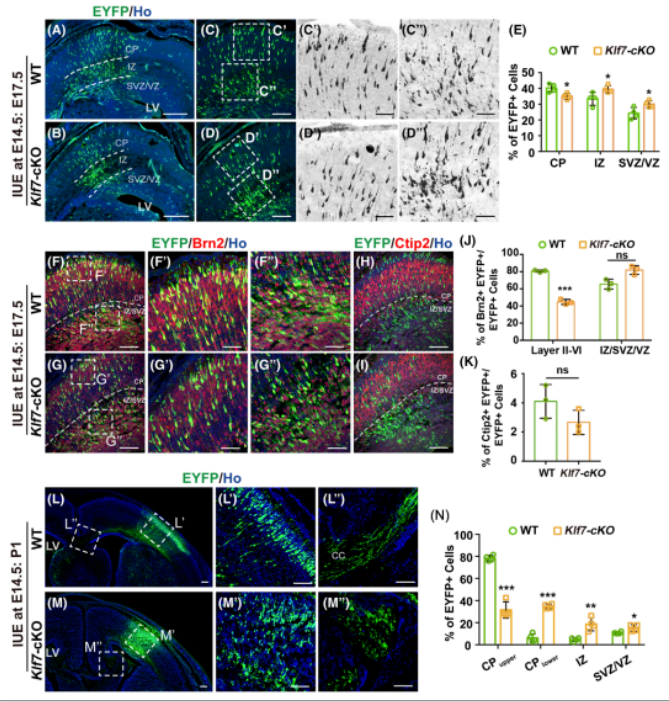
为了研究KLF7对皮层神经元迁移的影响,作者采用子宫内胚胎电转(In utero electroporation, IUE)分别向E14.5的野生型和Klf7-cKO胎鼠侧脑室注入增强型黄色荧光蛋白(pCAG-EYFP)质粒,通过电转让侧脑室壁表面的神经祖细胞被EYFP标记。分别在电转后第3天(E17.5)取脑观察皮层神经元的迁移情况。结果显示,KLF7条件性敲除后,迁入皮层板中的EYFP+细胞数量明显减少(图5A-E),且分布在浅层中的细胞远比野生型的少(图5F-G,J),停留在IZ/VZ/SVZ区的EYFP+细胞数量显著增加(图5A-E,F-G,K)。类似地,进行E14.5电转,在出生后第一天(P1)取脑观察,发现KLF7条件性敲除后皮层中神经元的放射状迁移也出现明显的迁移受阻缺陷,只有约30%的EYFP+细胞迁移到浅层皮层中,而在野生小鼠中则有78%(图5L-N)。综上,KLF7条件性敲除抑制皮层神经元放射状迁移。
(图源:Wentong Hong, et al., Brain Pathol, 2023)
四、KLF7通过调控p21和Rac3影响皮层神经元迁移
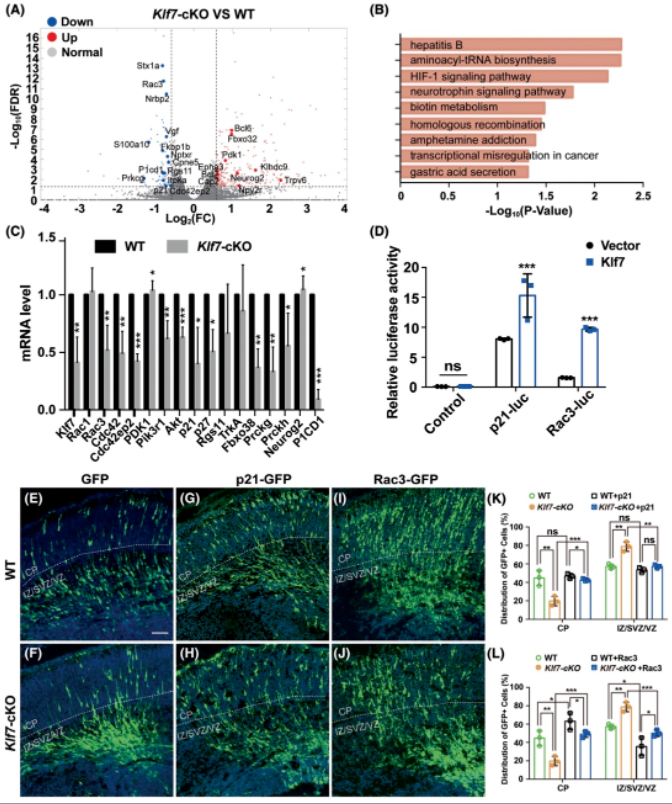
为了研究KLF7调控皮层中神经元分化和迁移的分子机制,作者提取了3组野生型和Klf7-cKO小鼠脑皮层中的RNA进行转录组测序。与野生型相比,Klf7-cKO小鼠皮层中有398个差异性表达基因(Differentially expressed genes, DEGs),其中295个上调基因,103个下调的基因(图6A)。根据KEGG分析这些DEGs参与了与神经系统发育密切相关的信号通路,如HIF-1、神经营养素信号通路(图6B)。进一步地采用实时定量聚合酶链反应(qRT-PCR)验证了部分DEGs以及一些表达没有变化的基因,这些基因都参与了神经元的分化和迁移(图6C)。在这些基因中,有一种调控肌动蛋白骨架重塑和生长的关键因子——Rac3的表达在KLF7缺失后显著降低。除此之外,还有一种细胞周期蛋白依赖性激酶因子p21的表达也显著减少,p21是KLF7的一个已知的下游靶点,参与神经细胞的骨架重塑。为了深入研究KLF7对p21和Rac3的转录调控作用,作者采用双荧光素酶报告基因检测法研究,结果发现KLF7对表达显著增加了p21-Luc和Rac3-Luc的荧光素酶活性(图6D)。说明p21和Rac3是受KLF7调控的靶基因。最后,通过子宫内胚胎电转实验研究p21和Rac3的诱导表达是否能挽救Klf7-cKO小鼠皮层神经元的迁移缺陷的表型。结果显示过表达p21和Rac3之后可导致迁移到皮层板中的GFP+细胞数量增加(图6E-L),这说明p21和Rac3都可以在一定程度上挽救Klf7-cKO小鼠皮层神经元的迁移缺陷。
图6 KLF7通过调控p21和Rac3影响皮层神经元迁移
(图源:Wentong Hong, et al., Brain Pathol, 2023)
本研究通过构建KLF7条件性敲除小鼠模型,并采用免疫组化、子宫内胚胎电转、转录组测序等一系列方法研究了KLF7在大脑发育中的作用。证明了KLF7缺失后导致新皮质畸形以及胼胝体发育缺陷;与野生型小鼠相比,KLF7缺失后大脑皮层中神经元分化和迁移出现障碍。基于转录组分析确定了受KLF7调控的靶基因,并证明KLF7通过调控p21和Rac3控制皮层中神经元的迁移。这项工作从分子和细胞水平揭示KLF7调控大脑皮层神经元迁移和胼胝体发育的作用和机制,为临床上胼胝体发育缺陷/异常的预防和治疗提供靶标和理论依据。