吲哚胺-2,3-双加氧酶1(Indoleamine 2,3-dioxygenases 1,IDO1)是定位于胞质中的免疫检查点分子,它参与并调控色氨酸分解代谢[1]。研究表明,IDO1的激活与癌症的不良预后密切相关,高水平的IDO1通过调控多种免疫细胞维持免疫抑制性的肿瘤微环境,促进肿瘤免疫逃逸[2]。作为重要的肿瘤免疫治疗靶点,已有一系列针对IDO1的小分子抑制剂被开发和报道[3]。然而,这些IDO1抑制剂在临床应用中的进展并不顺利,多个临床试验宣告失败,最终导致针对IDO1的靶向治疗开发受限[4]。因此,结合其他靶向手段探究新型IDO1靶向策略具有重要意义和应用前景。
2023年7月13日,北京大学教授团队在iScience上发表了题为“Development of a DNA aptamer targeting IDO1 with anti-tumor effects”的研究,报道了一种通过靶向IDO1发挥抑制肿瘤生长、增强抗肿瘤免疫应答作用的功能性适配体。

适配体(Aptamer)是一种具有靶标识别功能的单链寡核苷酸,能够与靶标产生类似于抗原和抗体的结合[5]。考虑到适配体作为一种区别于小分子抑制剂的有效靶向工具,且在生物医药领域具有广泛应用前景,该研究选择以其作为IDO1靶向手段进行功能探究,以期通过筛选特异性靶向IDO1的功能性适配体开发出靶向IDO1的替代策略,并探究以此作为新型疗法的可开发性。
研究人员首先利用指数富集的配体系统进化(systematic evolution of ligands byexponential enrichment,SELEX)方法,以重组IDO1蛋白为靶标进行了适配体的筛选,并基于靶标结合实验以及体外酶活实验获得了具有IDO1活性抑制效果的适配体,将其命名为IDO-APT。随后,在体外以及细胞内的表征实验均证明了IDO-APT能够以高亲和力特异性地结合IDO1蛋白(图1A-E)。

图1. IDO-APT特异性结合IDO1
适配体的内化是进行适配体的体内应用所必需的,为了实现适配体的胞内靶向,使其能够与胞质中的IDO1结合,研究人员构建了以适配体-鱼精蛋白复合物为内核的仿生矿化纳米颗粒递送体系,该纳米颗粒帮助IDO-APT被细胞摄取,并且延长了IDO-APT的半衰期。进一步在IDO-APT-纳米颗粒的基础上,研究人员对IDO-APT的功能性做了探究,对体外培养的淋巴细胞进行的分析结果显示IDO-APT具有增强淋巴细胞免疫反应的效果(图2A-E)。随后的研究发现,IDO-APT对T细胞的免疫激活作用由DCs介导。
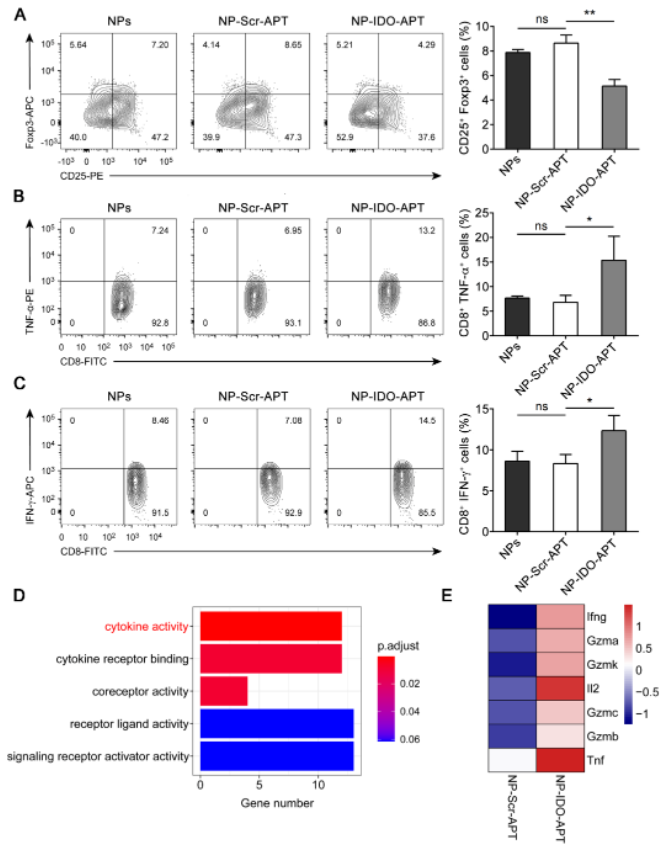
图2. IDO-APT在体外促进T细胞功能
接下来,研究人员探究了这一具有功能性的IDO-APT能否通过作用于肿瘤微环境达到肿瘤抑制效果。在同源肿瘤移植小鼠模型中进行IDO-APT-纳米颗粒治疗,显著降低了体内IDO1的活性、抑制了肿瘤的生长并提高了小鼠的生存率,并确定了IDO-APT的这种抗肿瘤效果由免疫细胞介导并依赖于IDO1的表达(图3A-K)。对肿瘤浸润的免疫细胞进一步分析发现,IDO-APT-纳米颗粒处理的肿瘤中具有淋巴细胞浸润增多、CD8+ T细胞的效应功能增强以及抑制性免疫细胞比例减少的特点。此外,在实验周期内小鼠的生理状态没有出现异常情况,体重维持稳定,血生化的检测结果也显示小鼠的肝功能和肾功能均正常,表明这一研究中开发的适配体-纳米粒具有较好的生物安全性。
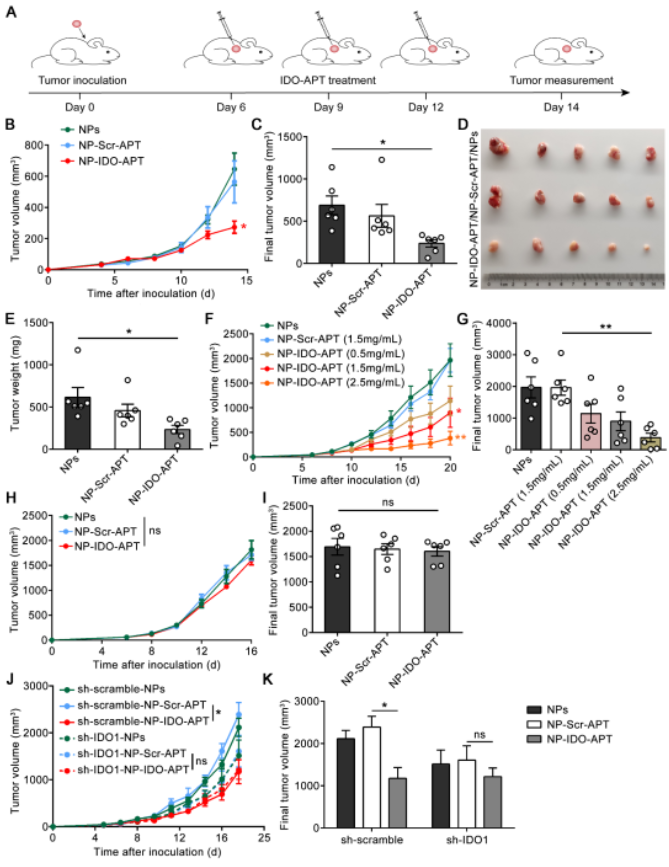
图3. IDO-APT具有抗肿瘤作用
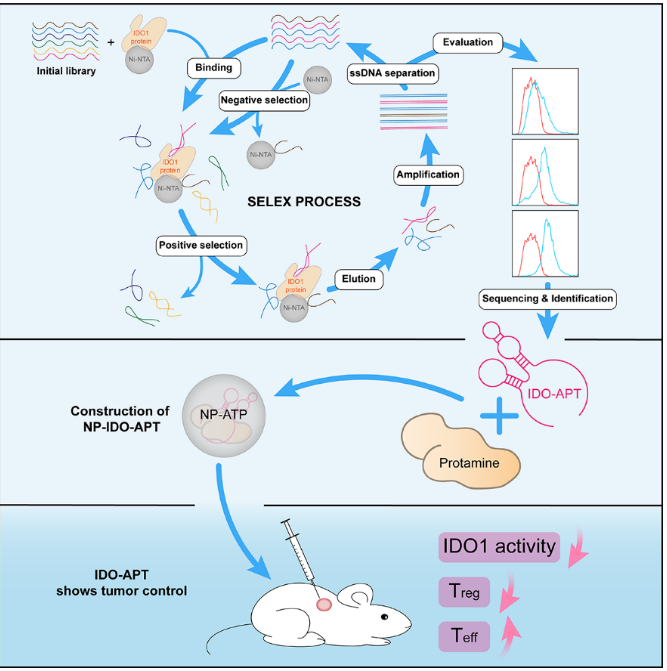
图4. IDO-APT的筛选及功能研究概述图

