当燕麦幼苗培养至两叶一心时,随机分成9组做如下处理:对照组(CK),1/2Hoagland营养液+叶喷蒸馏水;单独盐胁迫处理(S0),1/2Hoagland营养液+70mmol/L盐(NaCl和Na2SO4摩尔比1∶1混合,一次性加入70mmol/L)+叶面喷施蒸馏水;盐胁迫下叶面喷施Spd处理,1/2Hoagland营养液+70mmol/L盐(NaCl和Na2SO4摩尔比1∶1混合)+叶喷不同浓度的Spd处理(S1-S7),各处理Spd浓度依次为0.01、0.25、0.50、0.75、1.00、1.50和3.00mmol/L。连续喷施4 d,喷施量为15mL/(次·盒),喷施处理结束后第8天进行各项指标测定,每个处理重复3次。
二、指标测定
2、离子含量
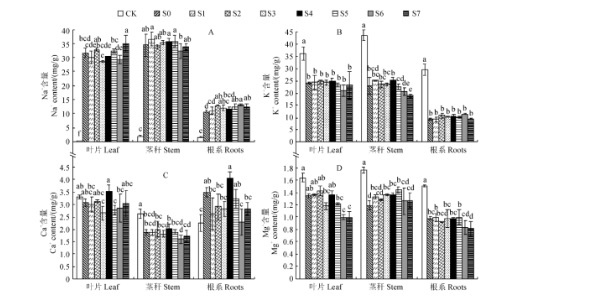
2+含量以及根、茎、叶中的 Ca2+ 含量,并降低了叶片Na+/K+ 、Na+/Ca2+ 和 Na+/Mg2+ 值。
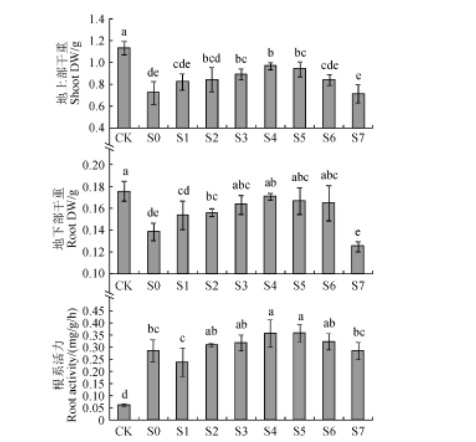
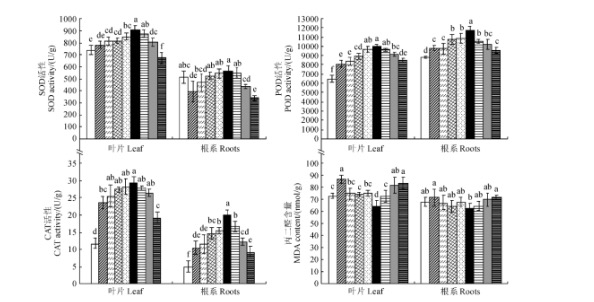
化酶活性,降低 MDA 的生成量,减轻盐胁迫下的氧化损伤,有助于膜结构的稳定,提高了脯氨酸等渗透调节物质的含量,改善了燕麦幼苗中的 Na+/K+ 稳态,而高于或低于该浓度的亚精胺喷施处理对燕麦耐盐性的影响较小。0.75 mmol/L 的亚精胺喷施处理可高效修复燕麦幼苗因渗透胁迫和离子毒害引起的伤害,恢复和维持生理代谢和生化反应的恒稳状态,从而增强了盐胁迫下燕麦幼苗的抗氧化胁迫能力,使燕麦幼苗在逆境下受到的生长抑制得以缓解,提高了燕麦幼苗的抗盐性。
主要参考文献
ZHU Y X,GONG H J.Beneficialeffectsofsilicononsaltand droughttoleranceinplants[J]Agronomyfor Sustainable Development,2014,34(2):455-472.
VUOSKUJ,KARPPINENK,MUILUMÄKELÄR,etalScotspineaminopropyltransferasesshednewlightonevolutionofthepolyaminebiosynthesispathwayinseedplants[J].An-nalsof Botany,2018,121(6):1243-1256.
LIJ M,HU LP,ZHANG L,etal.Exogenousspermidineisenhancingtomatotolerancetosalinity-alkalinitystressbyreg-ulatingchloroplastantioxidantsystemandchlorophyllmetabolism[J].BMC PlantBiology,2015,15(1):1-17.
YAMAMOTO A,SHIM IS,FUJIHARA S.Inhibition of putrescinebiosynthesisenhancedsaltstresssensitivityandde-creasedspermidine content in rice seedlings[J].BiologiaPlantarum,2017,61(2):385-388.
KHOSHBAKHT D,ASGHARIM R,HAGHIGHIM.Influenceoffoliarapplication of polyamines ongrowth,gas-exchangecharacteristics,andchlorophyllfluorescencein Bakraiicitrusundersalineconditions[J].
Photosynthetica,2018,56(2):731-742.
WUJQ,SHU S,LICC,etal.Spermidine-mediatedhydrogen peroxide signaling enhancesthe antioxidant capacity ofsalt-stressedcucumberroots[J].Plant Physiologyand Bio-chemistry,2018,128:152-162.
PARVIN S,LEE O R,SATHIYARAJ G,etal.Spermidinealleviates the growth of saline-stressed ginseng seedlingsthroughantioxidative defensesystem [J].Gene,2014,537(1):70-78.
LIU Q,NISHIBORI N,IMAII,etal.Responseofpoly-aminepoolsin marine phytoplanktonto nutrientlimitation
andvariationintemperatureandsalinity[J].MarineEcologyProgressSeries,2016,544:93-105.

