线粒体是执行各种基本生物过程的必要细胞器,作为高度动态的可塑性网络,线粒体可通过裂变/融合、线粒体生物发生和线粒体自噬等分子过程完成质量控制[1,2]。在多细胞生物中,线粒体质量控制系统受到细胞间的信号通讯调控,以协调生物局部或整体的线粒体稳态。既往研究已经证实,线粒体在细胞间转移是一种常见现象,在生理条件下,线粒体转移与生物发育、能量协调和细胞有害成分的清除有关。而在病理条件下,严重的线粒体损伤将进一步放大经典线粒体质量控制系统的缺陷,从而动员更活跃的线粒体转移,补充外源性健康线粒体,清除内源性受损线粒体,促进疾病转归。尽管线粒体细胞间转移的机制一直在不断完善,同时线粒体转移的治疗潜力也在多种疾病中得到探索,但转移的线粒体如何影响受体细胞以及机体整体的线粒体质量控制仍未得到明确阐述。
作者概述了细胞间线粒体转移的方式,并进一步讨论了线粒体转移在线粒体质量控制中的新兴作用,揭示了细胞间线粒体转移可能是多细胞生物中协调整体线粒体质量控制的重要机制。
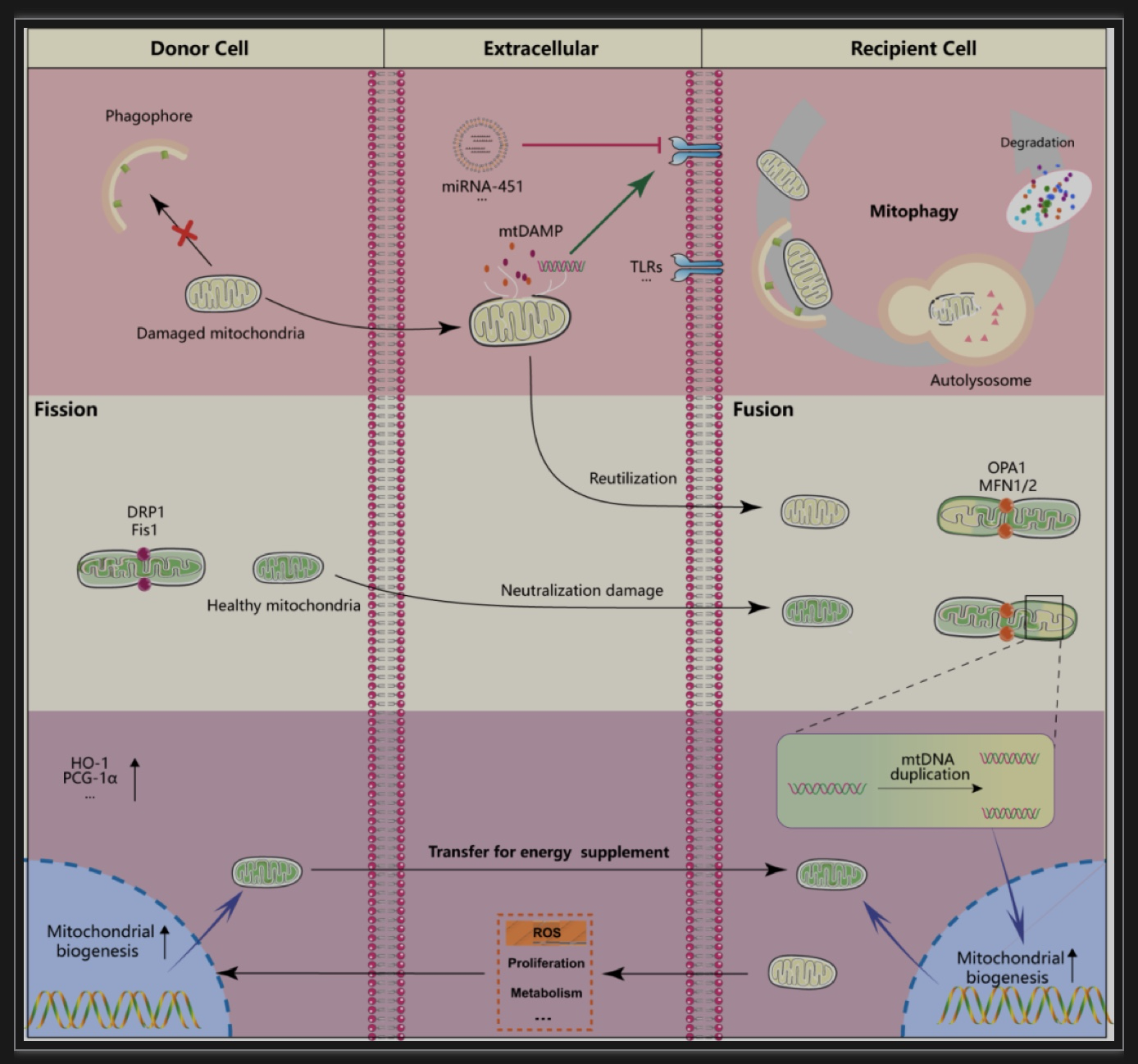
隧道纳米管(Tunneling nanotubes, TNTs):TNTs是基于细胞F-肌动蛋白的纳米级膜管,长度从几百纳米到100微米不等,其作为细胞间线粒体转移的主要模式,介导细胞成分和细胞器的运输[3-5]。钙离子信号在这种TNT介导的线粒体运输中发挥核心作用。一方面,Ca2+依赖的肌动蛋白和肌球蛋白动力学对TNT生长-收缩平衡起着基本控制作用。另一方面,钙离子的变化可能参与了供体细胞内线粒体动力学事件的动员,线粒体动力学向分裂优势的表型转换将促进线粒体向受体细胞转移[6-8]。
某些细胞外囊泡(Extracellular vesicles, EVs)亚群可携带线粒体成分在细胞间转移,从而影响供体细胞与受体细胞的代谢状态和表型[9,10]。MitoEVs可能起源于MDV和其他EVs形成途径。MDVs形成的mitoEV仅包含较小的线粒体和其组分[11],更完整的线粒体平行转移需要由细胞起泡形成的具有更大直径的microvesicles(MVs)。此外,在轻度线粒体应激条件下,受损线粒体可通过迁移体(migrasome)转运到胞外[12]。
2.3 Free mitochondria transfer
细胞可释放游离的线粒体,细胞衍生的线粒体的存在形功能上存在式有较大的异质性,但特定类型的线粒体存在形式在功能上存在的异质性仍有待更深入的研究。游离的线粒体可被周围细胞识别吞噬[13]。
线粒体自噬:胞内线粒体自噬分为两类:泛素依赖性途径和非泛素依赖途径,它们的共同下游是与溶酶体交互作用降解线粒体。广泛的线粒体应激可能导致溶酶体自噬途径受阻。另外,在一些具有长突起的细胞中,如神经元,大量的线粒体成分聚集在轴突末端,自噬体的长距离运输和蛋白质局部翻译不足导致了线粒体自噬的空间障碍。这些原因限制了单个细胞的内源性自噬对线粒体受损部分的典型清除。因此,细胞通过将线粒体内容物排到胞外作为自噬替代物以保证线粒体质量。排出细胞的受损线粒体将被周围细胞吞噬,被更为强大的溶酶体自噬系统降解,这种依赖于其它细胞辅助的线粒体清除方式被称为transmitophagy[14]。
固有免疫细胞,尤其是巨噬细胞是清除这类细胞产物的主要效应细胞。mtRNA以组蛋白类核( histone-free nucleoids)的形式分散在线粒体网络中,在线粒体的转移过程中释放,可能激活固有免疫细胞的炎症反应。这表明,在线粒体转移过程中可能还伴随着其他对线粒体转移脱敏的机制。
线粒体动力学:线粒体是高度动态的细胞器,通过分裂\融合的动力学来调节线粒体形态、促进内容交换、维持线粒体DNA和分离受损的线粒体[15]。当线粒体由供体细胞转入受体细胞后,与受体细胞原有的线粒体网络融合,同时供体细胞的线粒体mtDNA也在受体细胞中复制[16]。这种细胞间的线粒体交换融合促进了受损细胞的线粒体质量恢复,另一方面,供体细胞受损的线粒体转入受体细胞后,可能与受体细胞的线粒体网络再融合以恢复极性,这表明,去极化线粒体转入巨噬细胞可能不一定参与transmitophagy,也可能与受体细胞线粒体网络整合。因此,去极化线粒体进入受体细胞后的命运可能与其去极化程度有关,在膜结构完整的状态下可能与受体细胞线粒体网络融合实现再利用。转移的线粒体在受体细胞中与已有的线粒体网络融合相对应的是,线粒体从供体细胞中经历的分裂过程是线粒体转移的重要事件。
线粒体生物发生:线粒体生物发生是细胞对生物能量供应不足引起的适应性线粒体增生,在线粒体生物发生不足以满足细胞的能量供应时,来源于其他细胞的线粒体补充可能是对受体细胞线粒体生物发生的有效补偿机制。细胞可向基质细胞发送信号,刺激基质细胞的线粒体生物发生并向具有线粒体需求的细胞转移[17]。
作为线粒体生物发生以外的能量补充机制,线粒体的细胞间传递独立于经典的线粒体生物发生程序,如感染条件下,骨髓间充质干细胞将线粒体转移至造血干细胞以应对急性细菌感染,但该过程先于造血干细胞自身的线粒体生物发生转录程序[18]。此外,转移的线粒体可将供体细胞的mtDNA也转移至受体细胞,编码电子传递链(ETC)的组成部分,从而实现线粒体转移事件的持久功能性后果[26,27]。一些研究表明仅转移少量线粒体,外源mtDNA即可迅速与整合或替换掉受体细胞内源性mtDNA,从而拯救溴化乙锭培养的mtDNA耗尽的细胞[19,20]。重要的是,细胞交互作用间转移的线粒体在整体线粒体网络中的占比不高,因此转移的线粒体促进线粒体生物发生可能是受体细胞能量供应增加的一个重要事件,可以推测,健康的外源性线粒体在进入到能量生成障碍的细胞中后,迅速启动氧化磷酸化缓解受体细胞的急性期能量限制,同时在mtDNA可迅速繁殖,并激活受体细胞的线粒体生物发生,以持续性地恢复受体细胞的能量供应。
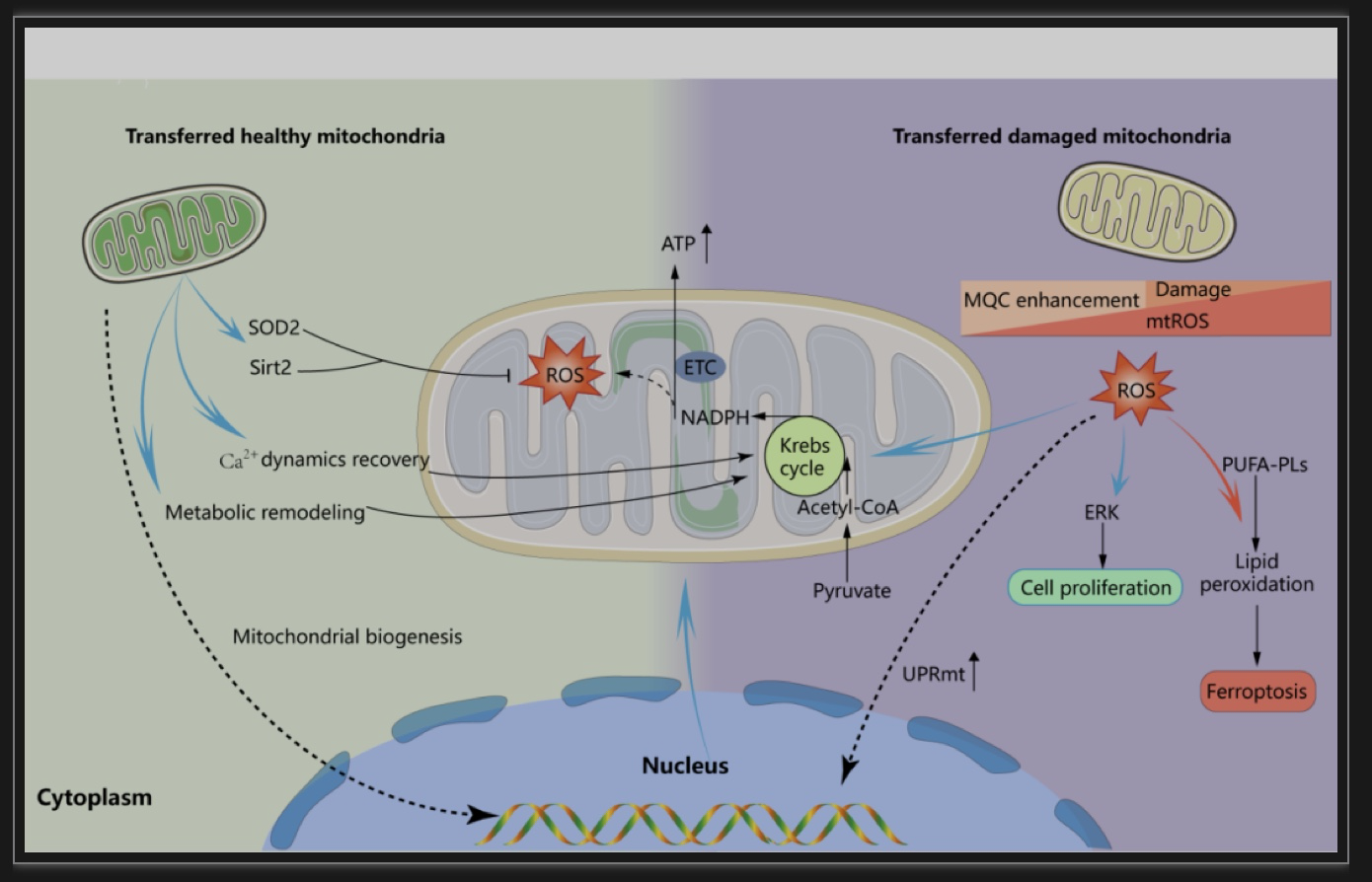
在经典的线粒体控制系统以外,转移的线粒体还可发挥信号传递的作用,维持受体细胞的线粒体稳态。局部发生氧化应激的组织可分泌包含氧化损伤但保持呼吸功能的线粒体的细胞外囊泡,这些小细胞外囊泡可通过循环被远端组织器官吸收,并促发ROS增加,从而介导远端器官的氧化应激适应,激活受体细胞本身的经典线粒体质量控制程序[21]。而在损伤信号超过了受体细胞的线粒体质量控制限度后,就可能引起受体细胞损伤。此外,转移的损伤线粒体伴随电子传递链功能障碍,可能在受体细胞中激活UPRmt,通过细胞核的逆向信号传导对线粒体质量控制产生有益效应。
另一方面,供体细胞提供的健康线粒体携带了线粒体的固有成分,如SOD2,Sirt2等,这些固有成分可缓解受体细胞内氧化应激并支持能量代谢。此外,线粒体转移可恢复应激细胞内线粒体钙失调,尽管钙稳态的恢复不太可能是转移的线粒体的直接作用,因为少量的线粒体转移不足以发挥钙库的作用,这可能涉及更复杂的信号调节机制,但可以明确的是健康线粒体转移后发挥的作用远不止单独地产生ATP以恢复生物能量,而是通过更为复杂的分子事件促进线粒体质量控制和细胞存活。
线粒体生物发生不足导致的生物能量缺陷或者线粒体功能障碍是多种疾病的共有特征,是因此最直接的治疗策略是将线粒体移植到患者体内,以补偿线粒体功能障碍或生物发生不足。但这种方法面临难以在细胞外环境维持有效功能等问题。替代的方法是间充质干细胞或mitoEV移植,对间充质干细胞或对mitoEV进行工程化改造可有效提升线粒体递送效率。
通过药物干预细胞间线粒体递送是另一极具前景的疾病治疗方法。肿瘤细胞具有从基质细胞中获取线粒体,以满足自身能量需求的特性,通过药物削弱肿瘤细胞和基质细胞间的线粒体体转移可有效缓解肿瘤细胞增殖和耐药。在其他能量代谢受损的疾病中,通过药物增强线粒体的细胞间转移,可有效恢复应激细胞的能量缺陷并缓解炎症和氧化损伤,促进疾病转归。
作者指出,线粒体的细胞间转移参与了线粒体质量控制过程,通过细胞间相互协调作用,共同维持局部组织或机体整体的线粒体稳态,这为与线粒体相关的疾病提供了极具前景的治疗靶点。然而,线粒体转移的启动机制和在受体细胞内的命运在很大程度上仍旧未知,明确这些细胞生物学过程将有助于进一步的临床转化。