适应性免疫抵抗(adaptive immune resistance, AIR)是肿瘤细胞逃避宿主免疫攻击的关键,可以加速肿瘤生长、促进肿瘤转移。三阴性乳腺癌(triple-negative breast cancer, TNBC)发病率占全部新增乳腺癌的15-20%。与其他亚型相比,TNBC具有分期高、转移能力强等特点,是预后最差的乳腺癌亚型[1]。近年研究显示,AIR在TNBC早期转移方面具有重要意义,并以此切入,研发出PD-1和PD-L1抑制剂等免疫检查点抑制剂(immune checkpoint inhibitor, ICI)[2, 3]。虽然部分临床试验取得了理想的结果,但ICI对大多数转移性TNBC患者以及多线治疗的患者,疗效并不显著[4-6],提示TNBC AIR具有异质性。因此,我们需要对TNBC肿瘤微环境进行全局考量,从AIR的角度出发,在ICI新时代探索新型疗效预测指标。AIR受到遗传学和表观遗传学的共同调控:从遗传学角度,p53[7]、BRCA2[8]等单基因改变可以影响免疫微环境,而从表观角度,染色质重塑、DNA甲基化、组蛋白翻译后修饰、非编码RNA等因素,虽然不改变DNA序列,但可以实时地改变细胞生物学表型,以动态模式对免疫微环境加以调控[9],是近年的研究热点。
2023年7月4日,复旦大学附属肿瘤医院教授团队在国际知名肿瘤学杂志《Cancer Communications》(IF:16.2)发表了题为“Low level of ARID1A contributes to adaptive immune resistance and sensitizes triple-negative breast cancer to immune checkpoint inhibitors”的研究,结合高通量组学筛选、人源化动物模型及大量临床样本验证等多重策略,对三阴性乳腺癌适应性免疫抵抗的表观调控模式进行了探索,发现ARID1A低表达型TNBC可诱导形成免疫抑制性微环境、促进AIR,采用免疫检查点抑制剂治疗效果较好。

为了探究调控TNBC AIR的关键性表观因子,该研究利用TNBC患者的转录组测序,基于AIR特征表达谱,结合表观基因集,发现与AIR最显著相关的表观基因是ARID1A(图1A)。ARID1A全称富含AT互作结构域1A,是染色质重塑复合物SWI/SNF的核心亚基。然后利用人TNBC细胞系MDA-MB-231敲除或过表达ARID1A,在免疫人源化小鼠中成瘤(图1B),发现ARID1A-ko型TNBC生长最快,肺转移灶最多;ARID1A-oe型TNBC虽然可以成瘤,但移植Hu-PBMC后瘤体逐步缩小至不可测出,且几乎没有肺转移(图1C-D)。不过ARID1A不影响TNBC细胞裸鼠成瘤(图1E-F),提示免疫调控是TNBC ARID1A缺失诱导疾病进展的关键。将258名来自复旦大学附属肿瘤医院(Fudan University Shanghai Cancer Center, FUSCC)的TNBC患者根据ARID1A表达高低分为4组,发现ARID1A低表达型TNBC恶性程度高、预后差,并且ARID1A是无病生存和总体生存的独立预后因素(图1G)。综上,TNBC表观因子ARID1A缺失可诱导AIR,引起不良预后。
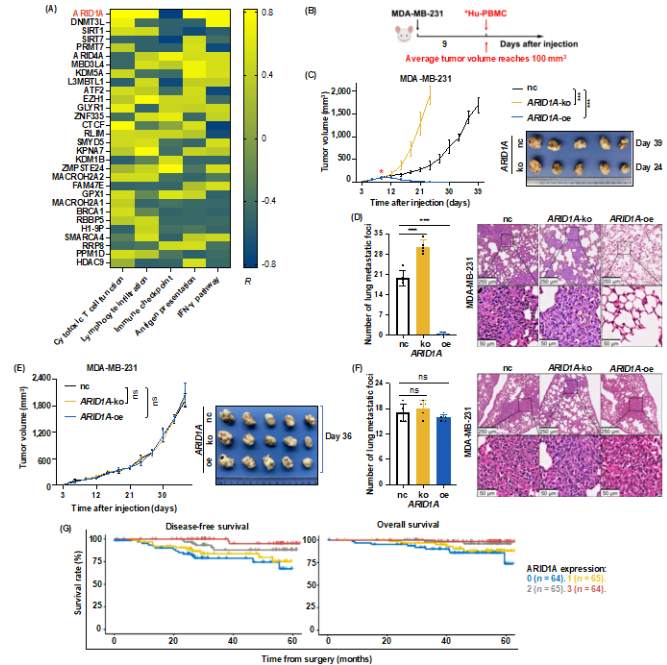
图1. ARID1A低表达促进适应性免疫抵抗
进一步为了探究TNBC ARID1A低表达对免疫微环境的重塑作用,研究者利用临床患者TNBC组织,发现ARID1A低表达型TNBC微环境中浸润的CD8+ T细胞、滤泡辅助性T细胞、M1型巨噬细胞较少,而调节性T细胞、M2型巨噬细胞较多,表明TNBC ARID1A低表达与免疫抑制性微环境相关。在各类免疫细胞中,与TNBC 和ARID1A表达最显著相关的免疫细胞类型是CD8+ T细胞(图2A-B)。在免疫人源化小鼠和FUSCC患者中,ARID1A缺失型TNBC低表达CD8+ T细胞标志物CD8和GB(图2C-D)。体外共培养实验证实,ARID1A-ko型TNBC细胞可抑制共培养的T细胞分泌抗肿瘤细胞因子(图2E)。综上,TNBC ARID1A缺失可通过抑制CD8+ T细胞诱导AIR。
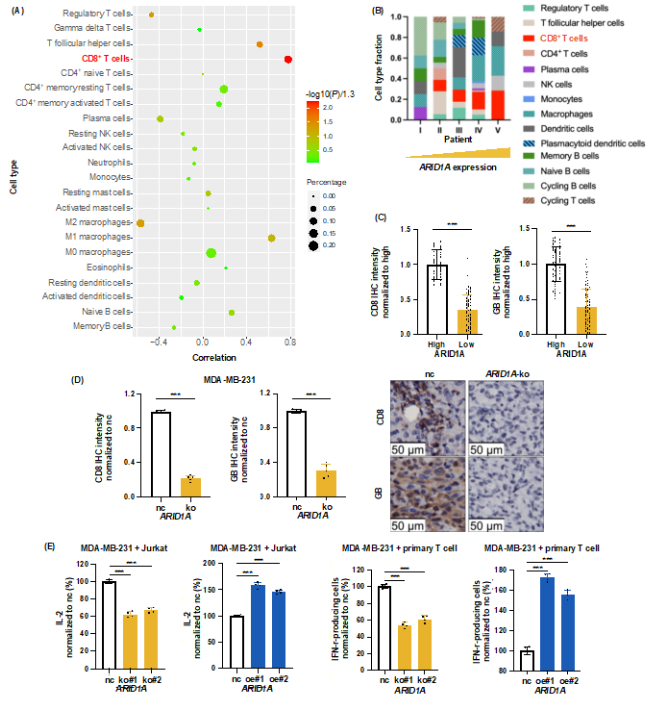
图2 . ARID1A缺失抑制CD8+ T细胞诱导适应性免疫抵抗
研究团队为探究三阴乳腺癌 ARID1A低表达如何抑制CD8+ T细胞,研究者通过转录组测序分析ARID1A-ko相比对照型MDA-MB-231细胞的基因表达变化;利用TCGA数据库中的TNBC患者,分析高、低ARID1A型TNBC的基因表达差异。结合细胞、患者两方面的差异基因,筛选参与调控CD8+ T细胞、表达变化与CD8+ T细胞活性改变趋势一致的基因,作为候选基因(图3A)。其中,表达变化最显著的候选基因是PD-L1(图3B)。因此,TNBC ARID1A低表达可能通过PD-L1抑制CD8+ T细胞,促进AIR。研究者进一步采用qPCR、Western blotting、免疫组化等,证实TNBC ARID1A低表达可诱导PD-L1上调(图3C-F)。在ARID1A-ko型MDA-MB-231细胞中敲减PD-L1,利用免疫人源化小鼠成瘤,发现虽然ARID1A-ko可促进TNBC生长、转移,但敲减PD-L1后,肿瘤生长显著减缓、肺转移灶显著减少(图3G)。
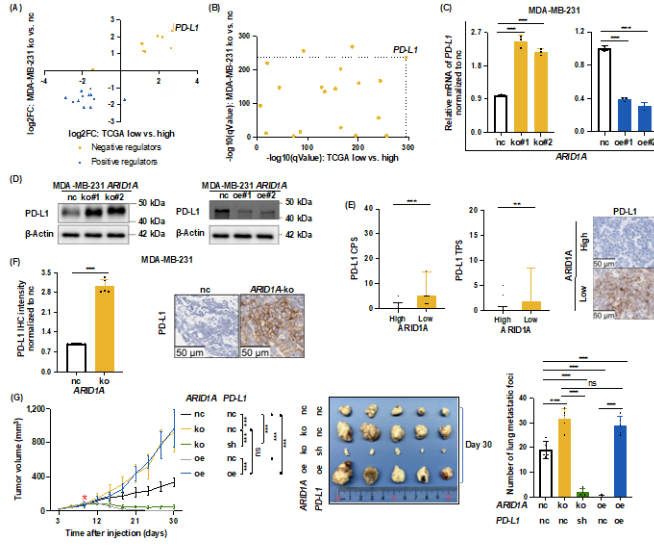
图3. ARID1A低表达诱导PD-L1表达上调
为了探究三阴乳腺癌ARID1A低表达通过上调PD-L1促进AIR这一现象的临床应用价值,研究者采用PD-L1抑制剂Atezolizumab(Ate)治疗免疫人源化TNBC荷瘤小鼠,构建ICI治疗模型(图4A)。虽然ARID1A缺失型TNBC恶性程度高,但Ate治疗可激活抗肿瘤免疫,显著抑制TNBC生长和转移(图4B-C)。CTR20191353是一项由复旦大学附属肿瘤医院乳腺及泌尿肿瘤内科主持的PD-1单抗在转移性TNBC一线治疗的Ib期临床试验[10]。研究者通过回顾分析,发现ICI对ARID1A低表达型TNBC患者疗效更佳(图4D);比较长、短生存期的患者,发现预后较好的患者,基线TNBC ARID1A较低、PD-L1较高,并且CD8+ T细胞标志物表达较低(图4E)。
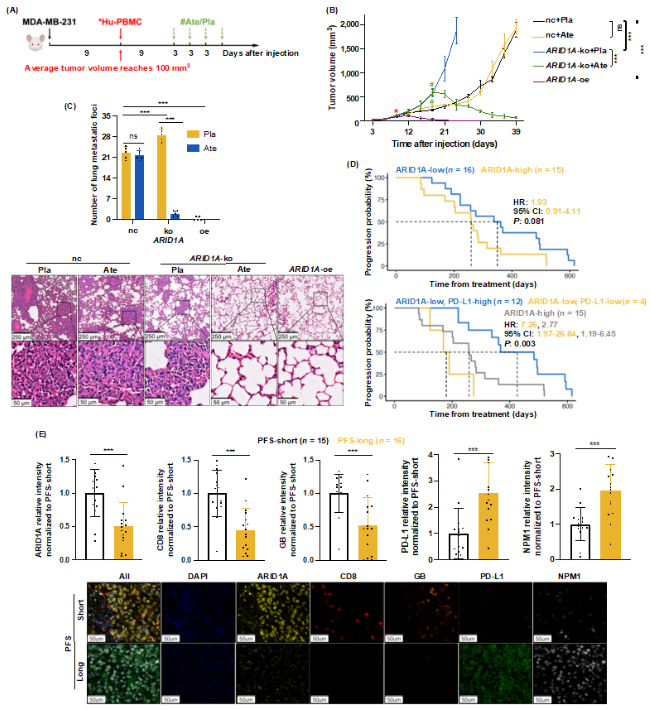
图4. PD-L1抑制剂Atezolizumab治疗ARID1A低表达引起的适应性免疫抵抗
在三阴乳腺癌中ARID1A低表达可促进AIR和TNBC进展,但也可作为肿瘤的阿喀琉斯之踵,为ICI治疗带来新的机遇。这一现象与人表皮生长因子受体2(HER2)阳性乳腺癌类似,HER2阳性患者的预后较HER2阴性患者差,采用抗HER2靶向治疗后,HER2阳性患者的预后可得到显著改善[11-13]。晚期TNBC患者疗效不佳是ICI治疗的重要困境。因此,如何筛选ICI治疗的适宜患者,是现今亟待解决的问题。该研究从表观调控的角度出发,提出TNBC ARID1A低表达可作为ICI的疗效预测指标。前期研究在卵巢癌[14]和肺癌[15]也发现,ICI对ARID1A低表达型患者疗效更好。因此,ARID1A低表达在筛选ICI适宜患者方面,具有潜在的普适性价值。
PD-L1阳性是公认的ICI疗效预测指标,但其异质性限制了临床应用价值[16, 17]。例如,携带PTEN缺失、PI3K/AKT突变、EGFR突变或MYC过表达的患者均可组成性过表达PD-L1,但肿瘤微环境缺少免疫细胞浸润,采用ICI治疗效果并不理想[18-20]。基于传统的AIR四分型理论,PD-L1阳性的肿瘤细胞和PD-1阳性的T细胞可共同诱导形成II型AIR,是唯一适宜采用ICI治疗的AIR亚型。本研究是对传统AIR分型理论的完善,虽然曾经认为低CD8+ T细胞浸润型TNBC不宜采用ICI治疗,但其中ARID1A低表达、PD-L1高表达型患者,是ICI治疗的潜在受益人群。

图5.免疫检查点抑制剂逆转三阴乳腺癌ARID1A低表达引起的适应性免疫抵抗
文章结论与讨论,启发与展望
综上,本研究从三阴乳腺癌表观调控出发,发现ARID1A低表达可诱导表达PD-L1促进AIR,但ICI治疗是逆转ARID1A低表达型三阴乳腺癌AIR、激活抗肿瘤免疫并改善预后的潜在治疗策略(图5)。

