子宫内膜异位症(内异症)是指子宫内膜组织(腺体和间质)在子宫腔被覆内膜及子宫以外的部位出现、生长、浸润,反复出血,继而引发疼痛、不孕及结节或包块等。内异症是导致育龄期女性不孕的重要原因,占女性不孕症的30%[1]。然而内异症导致女性不孕的因素尚未完全阐明。铁死亡是一种新型的非凋亡性细胞死亡,其特征是铁依赖性脂质过氧化膜损伤[2]。过去的研究已经报告子宫内膜异位病灶以及内异症患者的腹腔液和卵泡液中铁水平升高。高铁环境与铁死亡密切相关,但是铁死亡对子宫内膜异位症似乎具有双重作用。因此系统总结铁死亡的主要途径和调控机制,探讨内异症异位病灶、腹腔液和卵泡液中铁超载环境形成的可能机制,为治疗育龄期女性不孕具有重要意义。
该综述系统总结了铁死亡在内异症以及内异症相关性不孕症中的最新研究进展,并提出铁死亡可能是内异症导致不孕症的主要因素的观点,为内异症性不孕症提供研究新思路新方向。
Dixon等人在2012年首次将铁死亡定义为一种独特的铁依赖性的非凋亡性细胞死亡[2]。铁死亡在形态学、生物化学和遗传学上与坏死、细胞凋亡和自噬不同,并且这些不同的特征包括异常线粒体膜密度、铁积累、脂质过氧化、铁死亡生物标志物的过表达和白细胞亚群的死亡以及相应的免疫功能丧失。总的来说,铁死亡的核心分子机制由各种细胞信号传导途径和基因调节,但主要通过两种主要途径介导,即外源性或转运蛋白依赖性途径(例如半胱氨酸或谷氨酰胺摄取的减少和铁摄取的增加),以及内源性或酶调节途径(例如谷胱甘肽过氧化物酶4抗氧化系统受到抑制)(图1)。
内异症的异位病灶、腹腔液和卵泡液中铁超载环境的原始原因仍不清楚,目前受到研究者认可的是可能与月经反流和局部病灶反复出血引起的红细胞过度降解和内流增加有关。逆行性月经和异位子宫内膜出血病变可将月经期子宫内膜组织和红细胞转运至腹腔。这些组织和细胞中的一些将被腹膜巨噬细胞吞噬、吸收和降解,并以含铁血黄素的形式储存。此外,铁蛋白和血红蛋白被释放到腹膜液中。血红蛋白水解消化释放的血红素被血红素加氧酶分解代谢产生活性铁并形成铁-铁蛋白沉积。这破坏了铁内稳态和铁清除系统,最终导致腹膜液中的铁过载环境。
内异症也是一种雌激素依赖性妇科疾病[1],其中过量的雌激素信号转导和改变的雌激素信号通路在其发病机制中起重要作用,导致雌激素优势和孕激素抵抗。雌激素依赖可能是由于17β-羟类固醇脱氢酶-1和芳香酶基因的上调,而孕酮抵抗可能是由于孕酮受体活化和孕酮靶基因转录的失败。在正常子宫内膜组织中,雌激素可通过抑制缺氧诱导因子-1/ROS/AMP激活的蛋白激酶信号通路并在非月经期进一步激活哺乳动物雷帕霉素复合物靶蛋白(mTOR)信号通路来抑制子宫内膜中的自噬。然而,活性氧(ROS)的水平不再被抑制的雌激素在异位子宫内膜组织细胞。异位内膜ROS水平明显高于正常在位内膜,这可能是因为异位组织细胞中的铁超载环境。
月经反流和红细胞降解产生的过量铁通过诱导芬顿反应产生大量的ROS,形成与机体抗氧化剂之间的不平衡,并导致氧化应激细胞损伤。这种铁超载和过氧化环境为内异症中异位子宫内膜组织的铁死亡创造了条件。Li等发现,一种铁死亡诱导剂可以通过铁转运蛋白介导的铁积累诱导异位子宫内膜间质细胞的铁死亡,进而减轻子宫内膜异位症的异位病灶[3]。然而,诱导剂对正常子宫内膜间质细胞几乎没有影响,这种差异可能与异位子宫内膜间质细胞铁超载的特殊微环境密切相关。
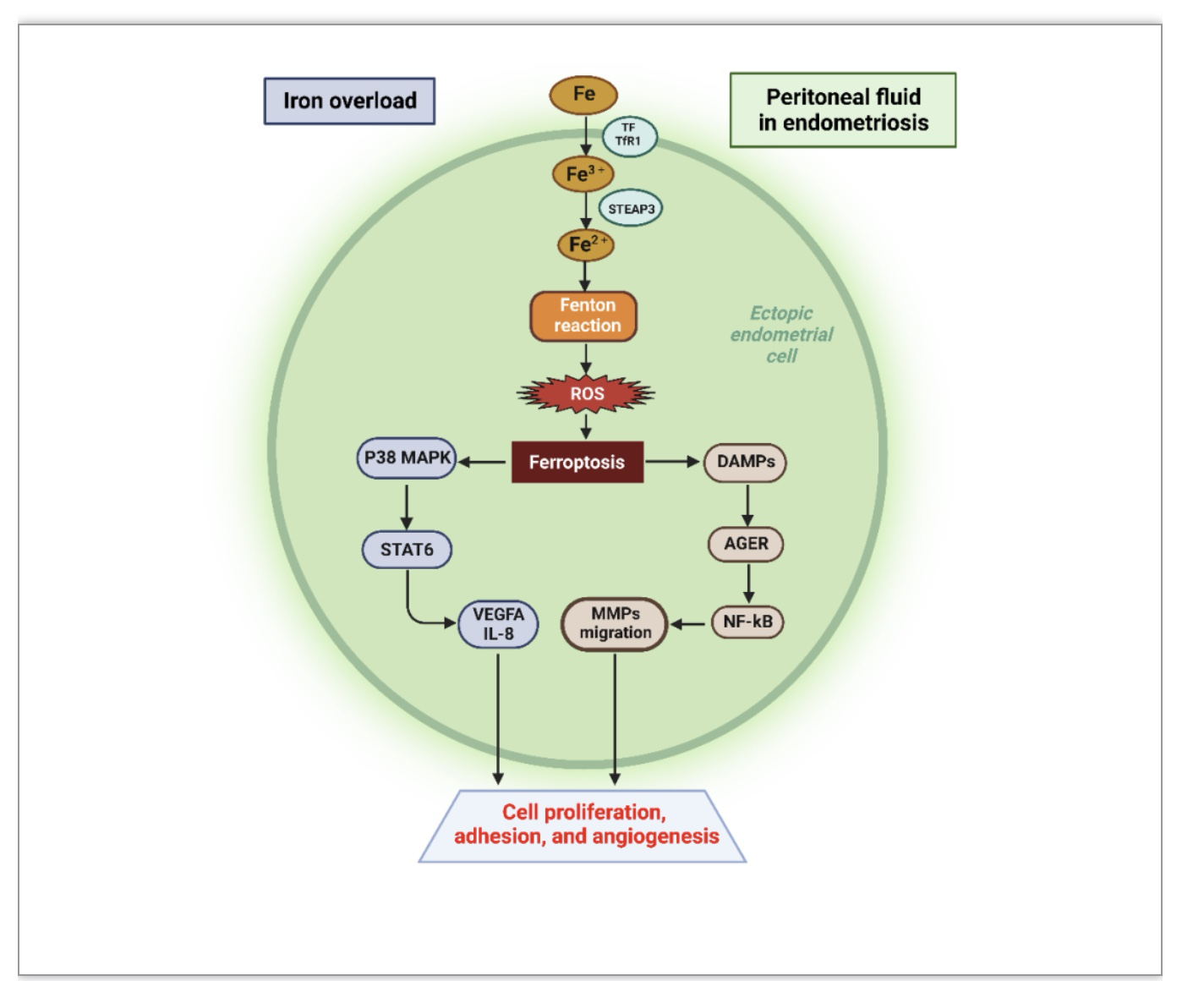
然而,铁死亡在内异症中的作用似乎是双向的。一方面,铁凋亡诱导剂可促进异位子宫内膜间质细胞的铁死亡,因此,这些诱导剂可能成为治疗内异症的潜在药物。另一方面,发生铁死亡的子宫内膜间质细胞可以释放炎性细胞因子并激活下游调节通路,以促进周围组织的增殖和血管生成[4]。卵巢子宫内膜异位症患者异位子宫内膜间质组织中的铁过载诱导铁死亡,促进纤维化和组织粘连,该过程与子宫内膜间质细胞亚群相关。此外,Li 等人发现卵巢内异症患者异位子宫内膜间质细胞中的铁死亡可激活p38丝裂原活化蛋白激酶(p38 MAPK)/信号转导和转录激活因子(STAT)6信号通路,从而促进异位病灶中血管内皮生长因子A(VEGFA)和白细胞介素-8(IL-8)的局部上调。VEGFA和IL-8可促进异位子宫内膜组织的细胞增殖、粘附和血管生成,从而促进子宫内膜异位症的发展。此外,作为炎性细胞死亡的一种形式,铁死亡与损伤相关分子模式(DAMP)的释放相关,DAMP可触发先天免疫系统并通过AGER激活NF-κB途径。异位子宫内膜基质细胞中过量的Fe2+通过芬顿反应产生ROS,这有助于MMP通过ROS-NF-κB途径的迁移能力。铁超载和铁死亡确实发生在子宫内膜异位症病变,使用铁死亡诱导剂可能是一种潜在的治疗子宫内膜异位症。然而,不能忽视铁凋亡后激活的一系列下游炎症通路,并且这些通路进一步促进血管生成和局灶性纤维化(图2)。因此,在开发有潜力靶向子宫内膜异位症的铁死亡相关药物的过程中,应考虑异位子宫内膜组织中铁下垂引起的一系列下游反应,这些问题需要在未来进一步解决。
图2 子宫内膜异位症患者腹腔液中铁超载的异位子宫内膜细胞
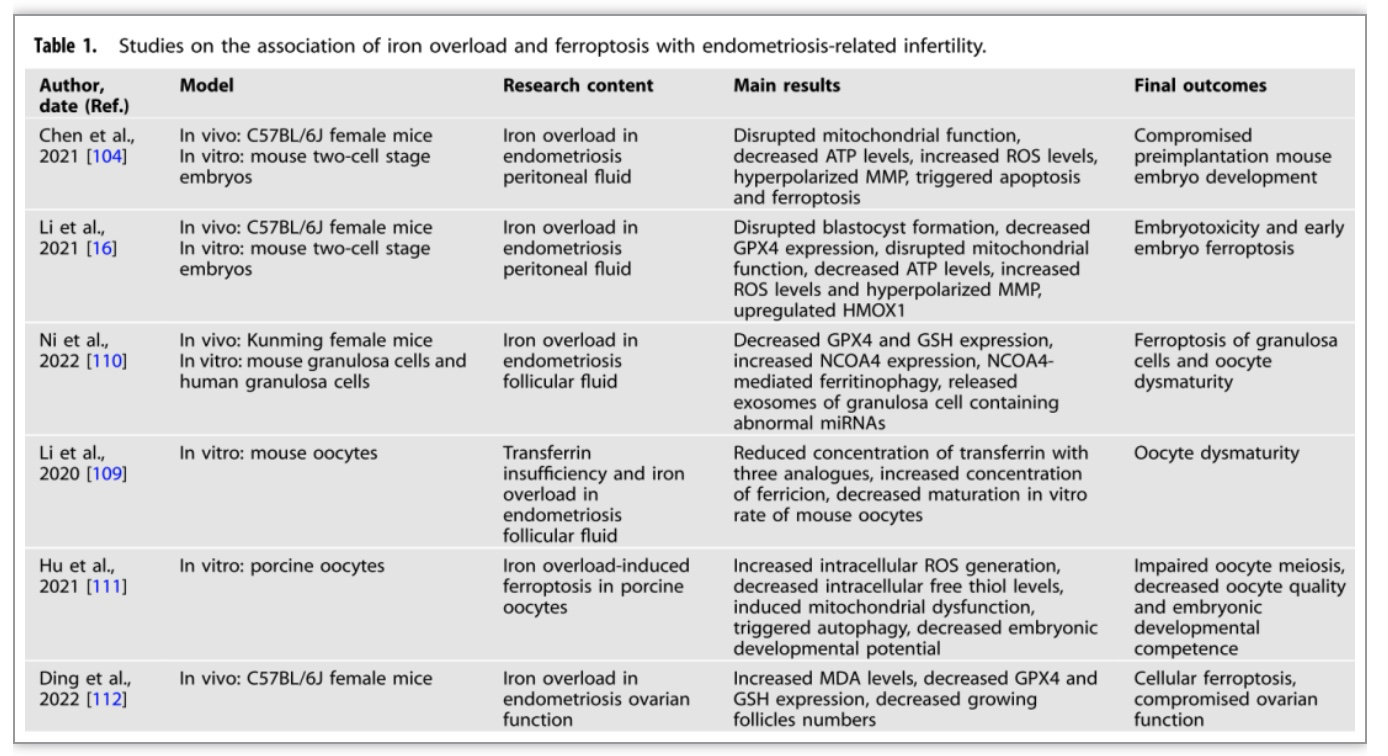
由铁超载环境促进的铁死亡对卵母细胞或胚胎有害,并且与内异症相关不孕症也密切相关。腹腔液和卵泡液是卵母细胞成熟和囊胚形成的外部微环境,这些微环境的异常受铁超载的影响可能导致生殖功能受损,近年来,关于铁超载和铁缺乏在子宫内膜异位症相关不孕中的作用和机制的研究相继报道(表1)。
腹腔液中的铁过载可通过导致胚胎毒性和铁死亡而影响胚胎发育。Chen等人表明,内异症患者的盆腔铁超载环境损害早期胚胎发育,并通过触发植入前小鼠胚胎中GPX 4下调依赖性铁死亡引起胚胎毒性。这导致内异症相关的不孕症和不良妊娠结局[5]。在这一过程中,过量的铁可诱导ROS的过度积累,从而导致氧化应激,损害植入前小鼠胚胎线粒体功能。这触发ATP生成障碍并降低线粒体膜电位(MMP)水平。此外,胚胎中对胚胎发育至关重要的GPX 4的表达显著降低。与所有其他GPX家族成员的缺陷相比,GPX 4缺陷导致胚胎发育异常,并最终在小鼠中产生致死表型。内异症患者腹腔液中的铁超载环境除了破坏线粒体功能外,还可降低GPX 4的表达,并诱导脂质过氧化。因此,胚泡形成被破坏,并发生胚胎毒性和铁死亡,而铁死亡抑制剂Fer-1可改善这些不良状况。此外,血红素加氧酶1(HMOX 1)在胚胎铁凋亡中上调,抑制HMOX 1可以维持正常的线粒体功能,从而防止铁死亡的发生。
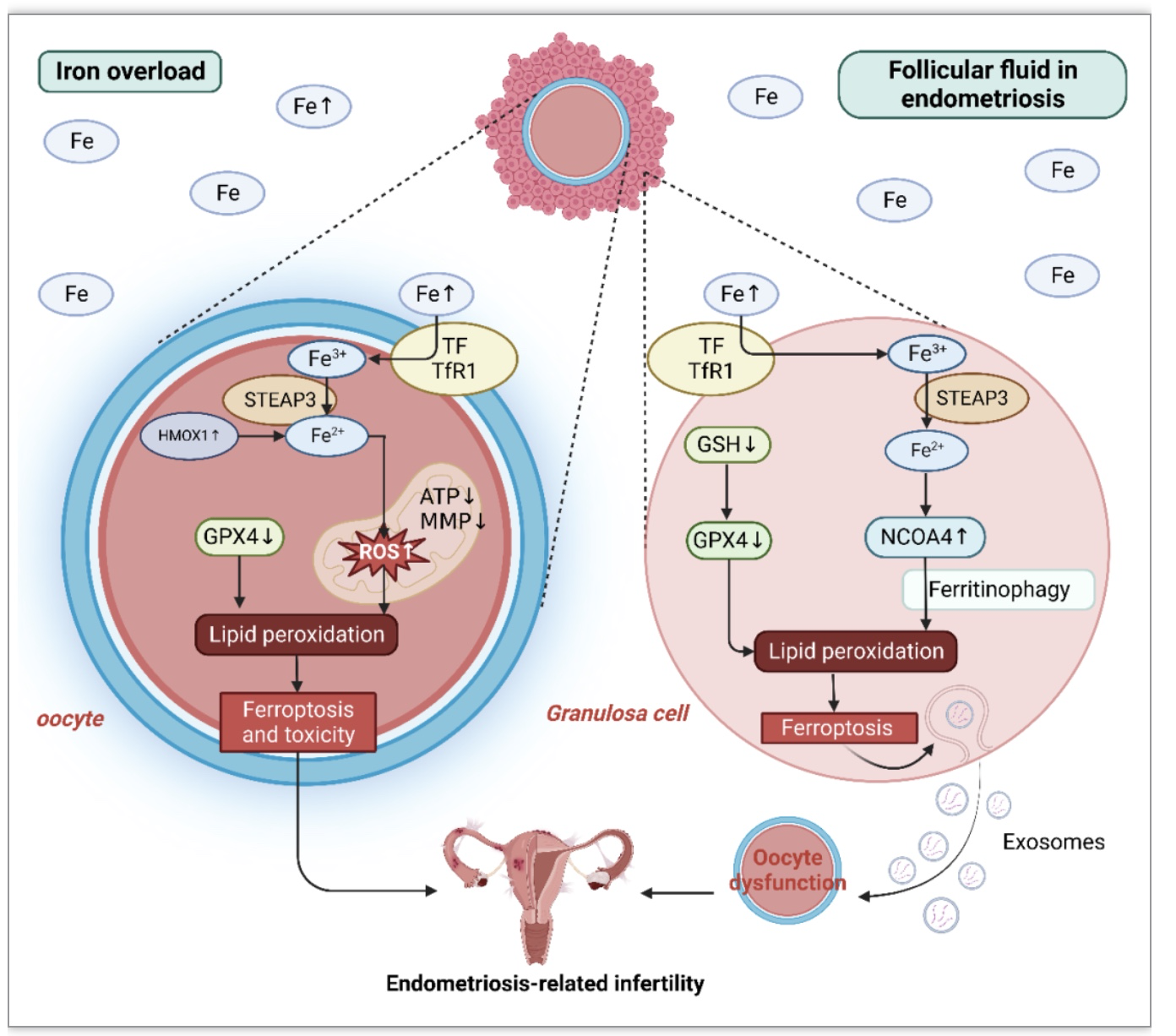
内异症近端卵泡的总铁水平、铁蛋白和TfR 1表达水平均高于远端卵泡和健康卵泡。此外,子宫内膜瘤近端和远端卵泡的取卵率低于健康卵泡,这说明卵泡摄入过量的铁导致细胞毒性积累,影响正常的卵母细胞发育。Ni等人发现,铁超载的卵泡液可引发颗粒细胞的铁凋亡和卵母细胞的不成熟,从而增加内异症相关不孕的风险[6]。卵泡液铁超载环境不仅能抑制颗粒细胞GPX 4及其上游调控靶点GSH的表达,还能引起颗粒细胞核受体辅激活因子4(NCOA 4)的高表达。这将导致NCOA 4依赖性铁蛋白吞噬,其增加颗粒细胞中的脂质过氧化并促进铁凋亡。此外,经历铁死亡的颗粒细胞不能对卵母细胞发挥营养和旁分泌功能,并且可以释放含有异常miRNA的颗粒细胞外泌体。因此,卵母细胞的成熟受到抑制,内异症相关的不孕症可以发展。铁螯合剂甲磺酸去铁胺和维生素E可以通过增加GPX 4表达和减少铁过载来改变这些情况。
此外,在体外铁死亡诱导剂柠檬酸铁铵(FAC)干预后,哺乳动物卵母细胞经历了ROS和自噬相关蛋白LC3和线粒体功能障碍的增加。在有显着积累的Fe2+在细胞质中,并降低极体排出率和囊胚形成率。因此,外源性诱导的铁死亡通过增加氧化应激、诱导线粒体功能障碍、触发自噬分裂过程和影响卵母细胞质量来抑制卵母细胞减数分裂。总之,这些研究结果表明,内异症患者的腹膜液和卵泡液中的铁过载及其诱导的铁死亡在内异症相关不孕症的进展中起重要作用(图4)。因此,减轻铁应激对局部微环境的影响,如使用抗氧化剂或铁螯合剂,有望成为预防和治疗内异症相关不孕症的有效方法。
图3 子宫内膜异位症患者卵泡液中铁超载的卵母细胞和颗粒细胞
这些发现强调了异位子宫内膜组织抵抗铁超负荷诱导的铁死亡的能力,并通过介导内异症患者腹腔液中的局部细胞铁死亡促进异位病灶生长。然而,来自内异症相关不孕症患者的卵母细胞受到铁过载的威胁,卵母细胞的发育和成熟受到影响,并且容易触发细胞铁死亡,这可能是由于卵母细胞的不成熟的抗氧化系统和膜修复机制。此外,虽然铁的积累和脂质过氧化是独特的中间事件在发病的铁死亡,但他们不是最终的执行者。脂质过氧化也可以发生在其他细胞死亡类型中,这取决于不同的最终效应物。铁死亡的关键调节因子也可以调节其他类型的细胞死亡。例如,抗氧化系统中的关键因子GPX4也抑制细胞凋亡和坏死性凋亡,以保护细胞免受各种损伤。因此,异位子宫内膜组织中铁死亡的独特标志物需要进一步鉴定。目前,子宫内膜异位症中铁死亡的详细调节机制尚未完全阐明。总之,铁死亡及其在子宫内膜异位症中的作用,以及子宫内膜异位症相关的不孕症,需要系统和深入的研究。