细胞核中,染色质非随机的空间排布和不同染色质位点的相互作用在调控基因表达等过程中发挥着关键作用。近年来,Hi-C(high-throughput chromosome conformation capture)技术在探究动植物细胞核内染色质构象的研究中被广泛应用[1-3],其能够揭示的染色质结构包括:染色体疆域(chromosome territories,CTs)、A/B区室(A/B compartments)、拓扑偶联结构域(topological associated domains,TADs)等。现有研究表明,物种的分化通常伴随着染色质(体)的数目和结构动态改变。在此过程中,细胞核内的三维(3D)染色质结构是否会发生改变以及3D结构的改变是否与染色体的重排存在特定的关联等问题是当前进化生物学与细胞生物学交叉领域的研究热点目前,在植物的相关研究更多的探讨了多倍化过程中细胞核内各层级染色质结构的动态变化以及进化过程中转座子对3D染色质结构的影响。然而,植物进化过程中染色体重排与各层级染色质构型之间的关系以及进化过程中相应染色质构型特征的动态变化及其对基因表达的具体影响仍有待进一步探索。该研究基于Hi-C技术,系统的揭示了棉族(Gossypieae)内不同物种进化过程中染色体重排与各层级3D染色质结构动态变化之间的关系及其对基因表达的影响,为探究植物进化过程中染色体重排与三维染色质构型间的互作及对基因表达调控的作用提供了全新的研究视角。

为探究进化过程中染色体重排对基因组三维染色质结构的影响,本研究首先利用 Hi-C技术构建了二倍体棉花Gossypium arboreum、Gossypium raimondii以及棉属最近缘Gossypioides属内的Gossypioides kirkii物种的“高”分辨率染色质互作图谱;并利用比较基因组学方法,在G. arboreum vs. G. kirkii和G. raimondii vs. G. kirkii两组中分别鉴定得到了1452和964个共线性断裂位点(synteny breaks)。其中,与已发表Hi-C数据相比,本研究获得的棉花Gossypium arboreum和Gossypium raimondii的Hi-C染色质互作图谱在分辨率方面均有较大提升,而G. kirkii物种的Hi-C互作图谱更是业内首个棉属外类群物种的高分辨率染色质互作图谱(1 kb)。
通过对G. kirkii、G. arboreum和G. raimondii的全基因组互作图谱的比较发现, G. kirkii在全基因组范围内的互作情况与二倍体棉花G. arboreum和G. raimondii的互作模式均十分相似。此结果表明,虽然外类群G. kirkii物种与棉属物种分化距今已有5-10个百万年,G. kirkii基因组内发生了大规模的染色体重排事件,但全基因组互作仍然处于较为保守的状态。随后,通过对三个样本中CTs结构的比较发现,G. kirkii和G. raimondii之间具有更为相似的染色体相对位置关系。根据Wang等人的相关研究表明,转座子导致的基因组扩张与染色质构象的动态变化有关[4]。作者推测G. arboreum进化过程中特有的转座子扩增事件可能在其染色质构象改变的过程中发挥着重要作用。
已有研究表明,在物种进化过程中,共线性基因的染色质状态会发生一定程度的动态改变[4,5]。但是,目前植物中关于染色体重排是否会引发邻近基因A/B 染色质区室状态转换这一问题仍然是未知的。因此,作者利用在棉属外类群G. kirkii与二倍体棉花G. arboreum和G. raimondii在50 kb分辨率下鉴定得到的A/B染色质区室,分别统计了G. arboreum vs. G. kirkii和G. raimondii vs. G. kirkii两组synteny breaks位点在A/B染色质区室中的数量,结果表明,G. arboreum vs. G. kirkii和G. raimondii vs. G. kirkii两组synteny breaks位点均偏向发生在A染色质区室中(图1a)。随后,作者对进化过程中染色体重排对A/B染色质区室状态转换的影响进行了深入探究,结果表明,synteny breaks位点附近区域发生了更多的B to A状态转换(图1b, c)。综上,植物进化过程中染色体重排会影响附近区域A/B染色质区室的状态转换。
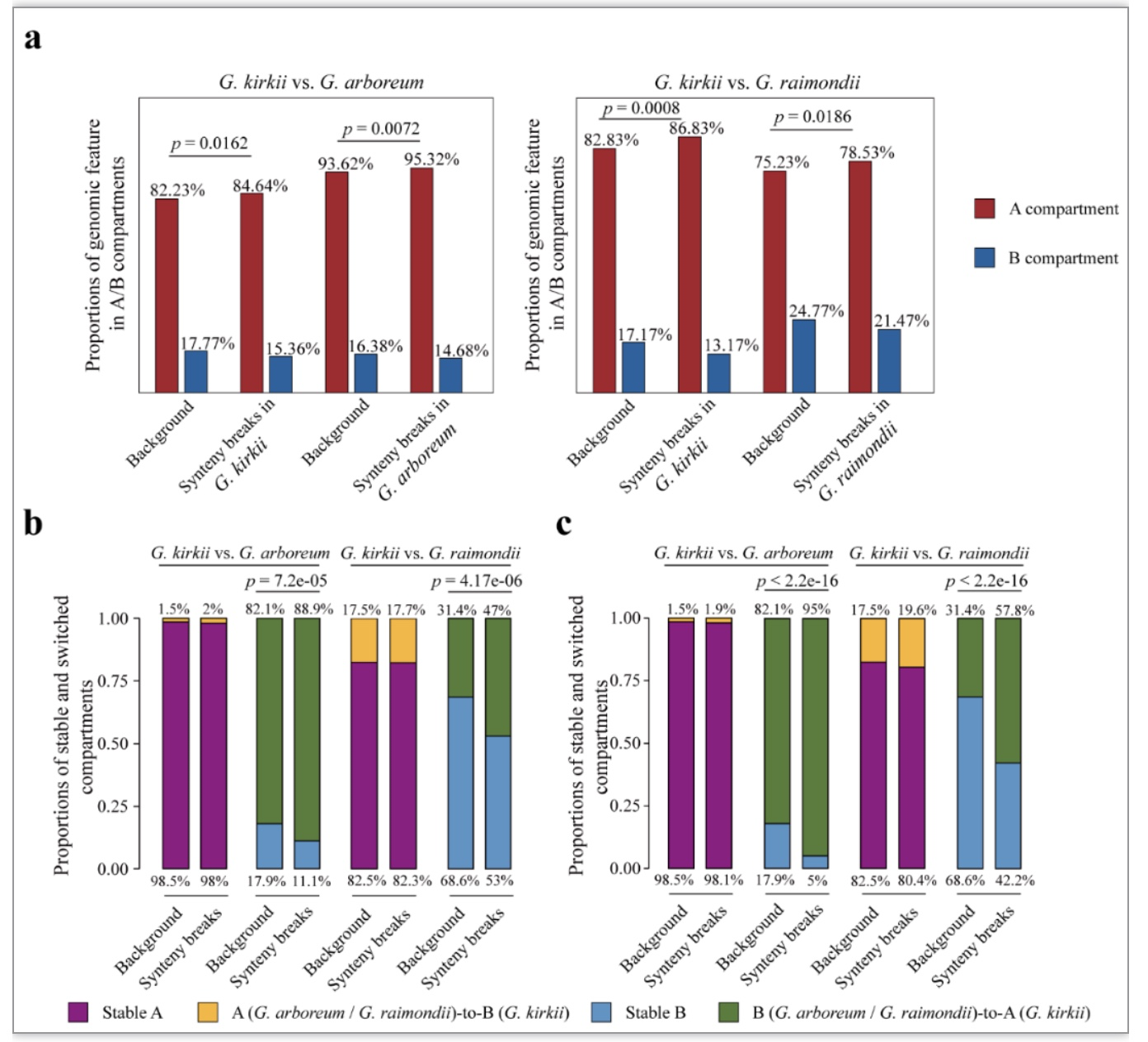
图1 Synteny breaks位点在A/B染色质区室的分布特征及其对A/B染色质区室状态转换的影响
(图源:Li et al., BMC BIOL, 2023)
TADs结构是动植物中一类更加精细的染色质结构单元。5 kb分辨率下,本研究分别在G. kirkii、G. arboreum和G. raimondii中鉴定到了4640、8466和5834个TADs结构。动物中研究发现,synteny breaks位点与TADs边界具有显著共定位的现象[6],这一现象促使作者在本研究中对synteny breaks位点与TADs结构之间的位置关系进行了深入探究。研究发现,synteny breaks位点显著富集于TADs边界(图2b)。随后,本研究分别表征了边界与synteny breaks位点共定位的此类TADs结构的大小和表观遗传修饰等特征。研究发现,(1)不同大小TADs结构边界内的表观遗传修饰和转录水平存在显著的差异;(2)不同物种之间,相同大小TADs结构的边界内的表观遗传修饰水平具有物种特异性;(3)TADs边界的开放性可能与富集synteny breaks位点相关,作者推测较低的甲基化水平、较高的染色质活性以及更高的转录活性,使得TADs边界具有更高的染色质脆性,而染色体的双链断裂倾向于发生在此类基因组区域(图2c-e)。
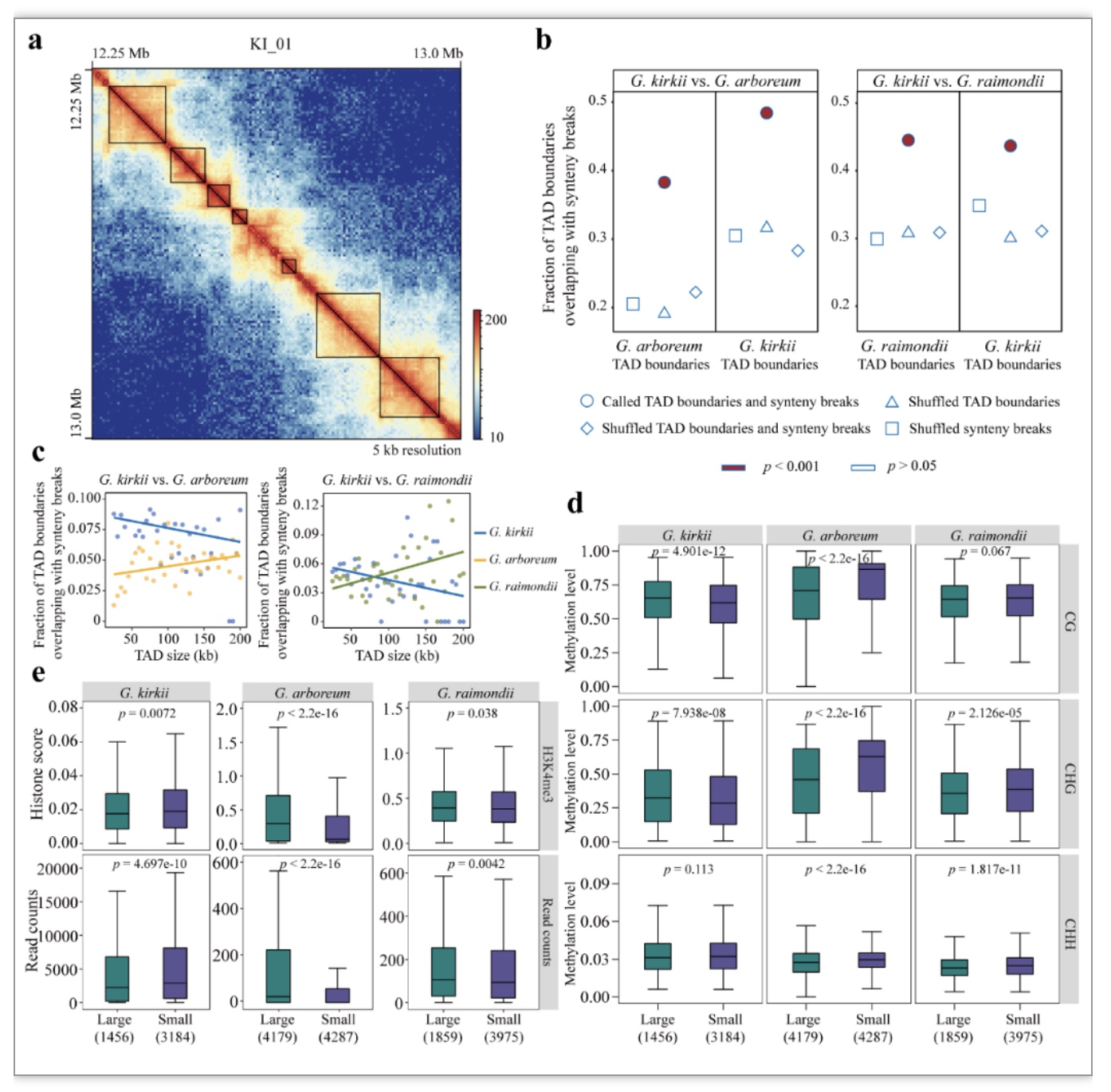
图2 Synteny breaks位点位点与TADs结构边界共定位
(图源:Li et al., BMC BIOL, 2023)
根据已有研究可知,进化过程中染色体重排可引发基因表达的改变,而动物中的研究发现,TADs结构同样对于调控基因表达至关重要[7]。因此,作者对synteny breaks位点附近基因的表达情况进行了分析。研究结果表明,进化过程中染色体重排所产生的synteny breaks位点可导致附近基因表达的动态改变(图3a)。随后,为探究进化过程中TADs结构对基因表达的影响,通过对种间保守TADs结构和重排TADs结构内基因表达的比较发现,TADs结构重排会导致其内部基因表达的改变(图3b)。为进一步证明保守的TADs结构可维持其内部基因表达这一结论。本研究就synteny breaks位点附近保守TADs结构内的表观遗传修饰和基因表达的情况进行了分析。研究发现,synteny breaks位点附近的保守TADs结构内部的DNA甲基化、组蛋白修饰及基因表达与基因组上其它保守TADs结构内部相比并无显著不同(图3c)。此结果进一步证明,进化过程中TADs结构的保守性对维持内部表观遗传修饰和基因表达的稳定性至关重要。综上,植物进化过程中染色体重排可引发基因表达的改变,但稳定的TADs结构可维持部分基因的稳定表达,而此类基因的稳定表达可能对植物正常的生长发育至关重要。
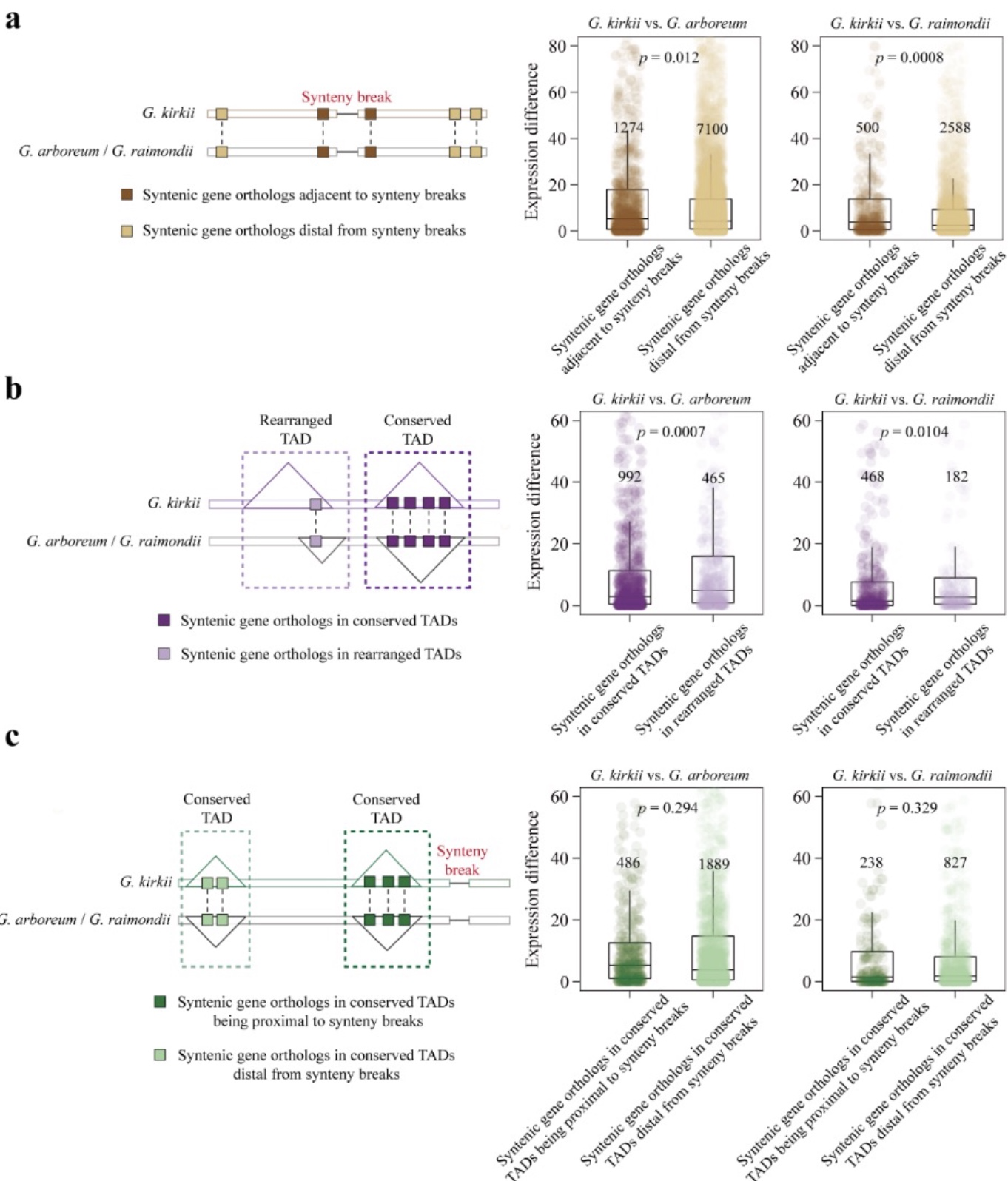
图3 TADs结构对基因表达的影响
(图源:Li et al., BMC BIOL, 2023)
鉴于已有研究发现,进化过程中来源于同一祖先染色体的基因组片段,在融合至不同染色体后仍然维持着祖先中的互作状态[6]。因此,作者对G. kirkii中的KI_2_4和KI_06号融合染色体的基因组片段之间在染色体内(cis interactions)的互作状态进行了探究。分析表明,来源于不同祖先染色体共线性区段间的顺式相互作用并未受到显著的抑制。随后,作者对来源与同一祖先和不同祖先染色体基因间的顺式相互作用进行了分析。研究发现,与重排事件发生前处于同一祖先染色体而在G. kirkii中仍处于同一染色体的基因相比,重排前位于不同染色体而在G. kirkii中处于同一染色体的基因之间的互作显著较弱(图4)。该结果表明,进化过程中的染色体重排会导致染色体区段间相互作用的改变。此外,不同染色体片段的融合可能会随着进化时间逐渐形成稳定的染色体环境,从而导致来源于不同祖先染色体的基因组区段之间的顺式互作或来源于同一祖先染色体的基因组区段之间的反式互作逐渐稳定至正常状态。
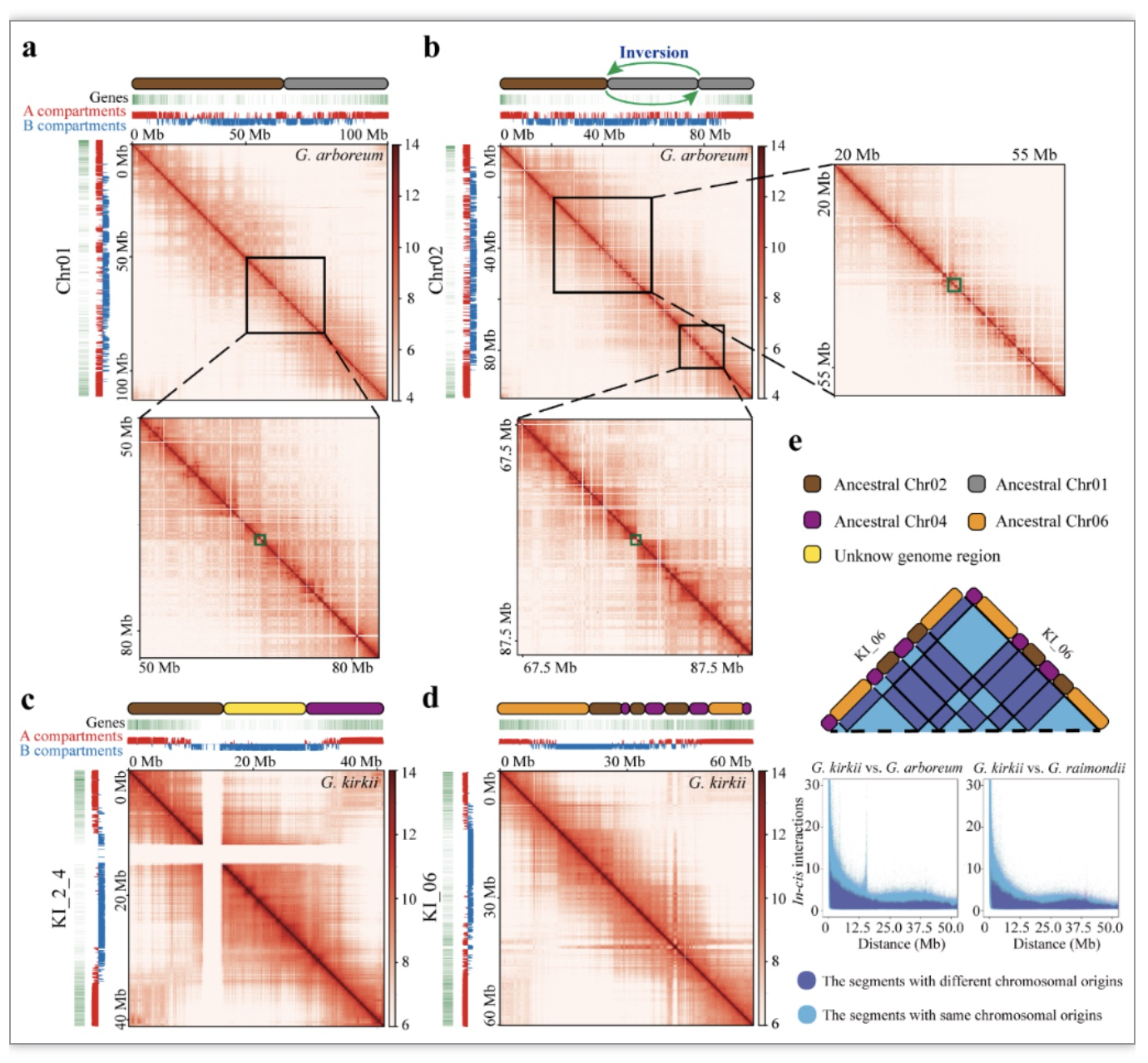
图4 融合染色体上共线性区段间的顺式互作
(图源:Li et al., BMC BIOL, 2023)

