类风湿性关节炎(rheumatoid arthritis,RA)以多关节炎症为主要病理表现,如果不进行适当的治疗往往会造成不可逆的关节结构损伤[1]。RA的全球发病率约为0.5%-1% [2-4],它会影响患者的身体功能,并给个人和社会带来巨大的负担[2, 5, 6]。及时且精准的治疗,从而迅速控制病情是RA治疗的关键。RA作为一种慢性骨关节炎症疾病,患者需要进行长时间的抗关节炎治疗,这也诱发了另一个问题的产生--RA耐药性,该问题往往导致药物治疗的失败。因此,要保证治疗的有效性就要深入探究RA耐药机制,进而解决耐药问题。该工作以在RA患者中检测到的p53突变点为研究对象,类风湿性关节炎患者成纤维样滑膜细胞(RAFLS)为研究载体。通过p53突变过表达RAFLS细胞模型的甲氨蝶呤细胞毒性,抗凋亡能力及迁移能力综合评估p53突变介导甲氨蝶呤耐药程度,由此建立了一个以p53突变为基础的甲氨蝶呤耐药平台及药物筛选平台,阐明了p53突变介导的甲氨蝶呤耐药反应的潜在机制。

该研究绘制了RA患者中p53基因的突变图谱(图1a),并且利用定点突变分子克隆技术建立了首個RA患者的p53突变体质粒文库。
一、MTX 治疗 RA 是否会因 p53 基因突变而减低药效?
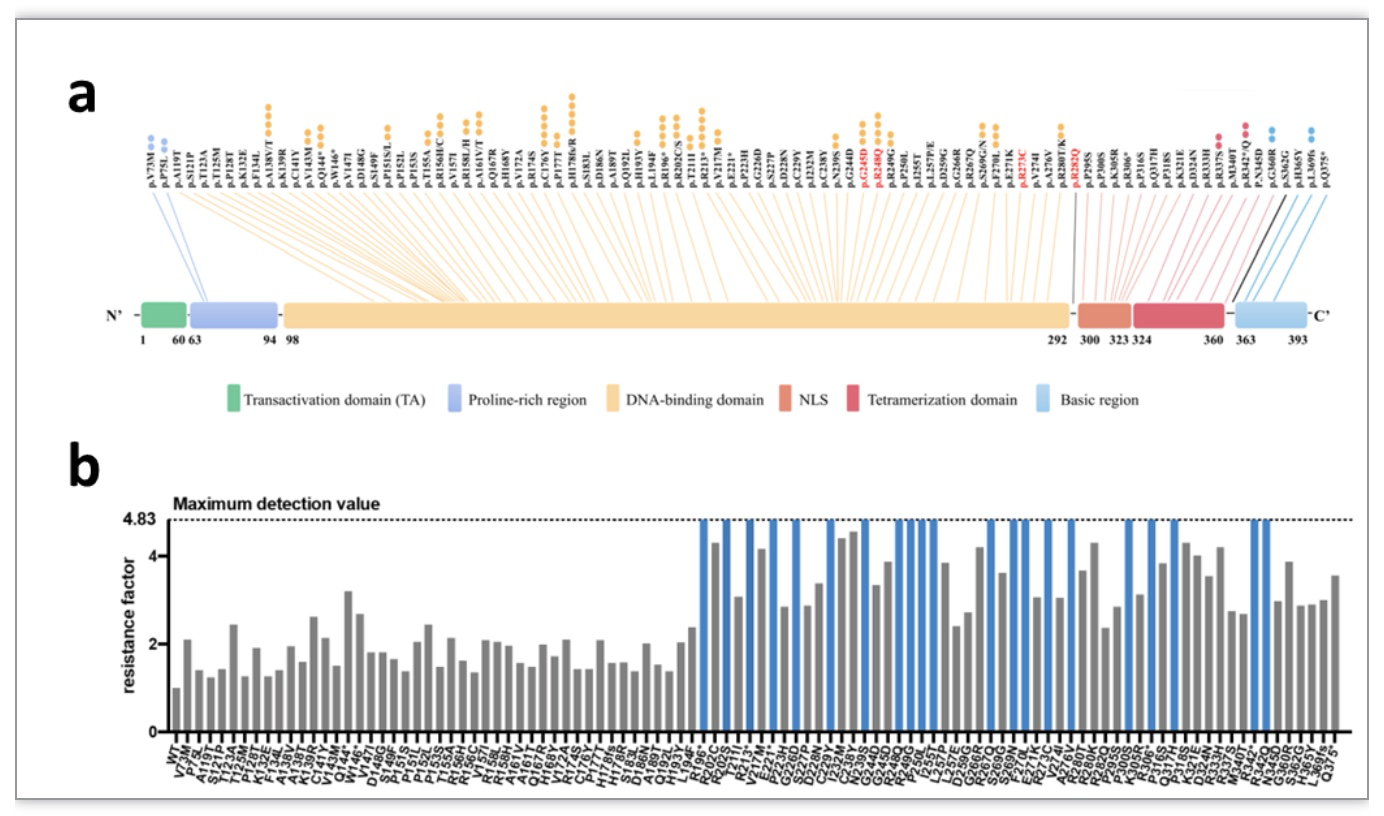
图1 RA患者p53突变的热点图及转染了p53突变基因的RAFLS中MTX的MTT测定
(图源:Qiu C. et al., Genes & Diseases, 2023)
二、具有 MTX 抗性表型的 p53 突变体是否会驱动 RAFLS 中的细胞凋亡抗性表型?
1. RT-PCR检测p53突变体过表达 RAFLS 中细胞凋亡标志物的表达
细胞凋亡标志物包括抗细胞凋亡的Bcl-2相关抗凋亡蛋白-1(Bcl-2 associated athanogene 1,BAG1)、细胞FLICE样抑制蛋白(cellular FLICE-Like inhibitory protein, cFLIP)、肿瘤坏死因子受体相关因子2(Tumor necrosis factor receptor-associated factor 2,TRAF2)和X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP),以及促凋亡的凋亡诱导因子(apoptosis inducing factor, AIF)、与Bcl-2相互作用的细胞死亡介质(Bcl-2-interacting mediator of cell death, BIM)、Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)和Bcl-2同源拮抗剂杀手蛋白(Bcl-2 homologous antagonist killer,Bak)。结果显示,部分 p53 基因突变导致抗凋亡蛋白的上调和促凋亡蛋白的下调,表明RAFLS细胞凋亡抗性表型(由至少三个受影响的凋亡标记定义)的发展是由这些突变驱动的。值得注意的是,在所有这些具有 MTX 抗性表型的突变中,R213* 和 R248Q 同时上调了抗凋亡蛋白并下调了促凋亡蛋白(图2)。
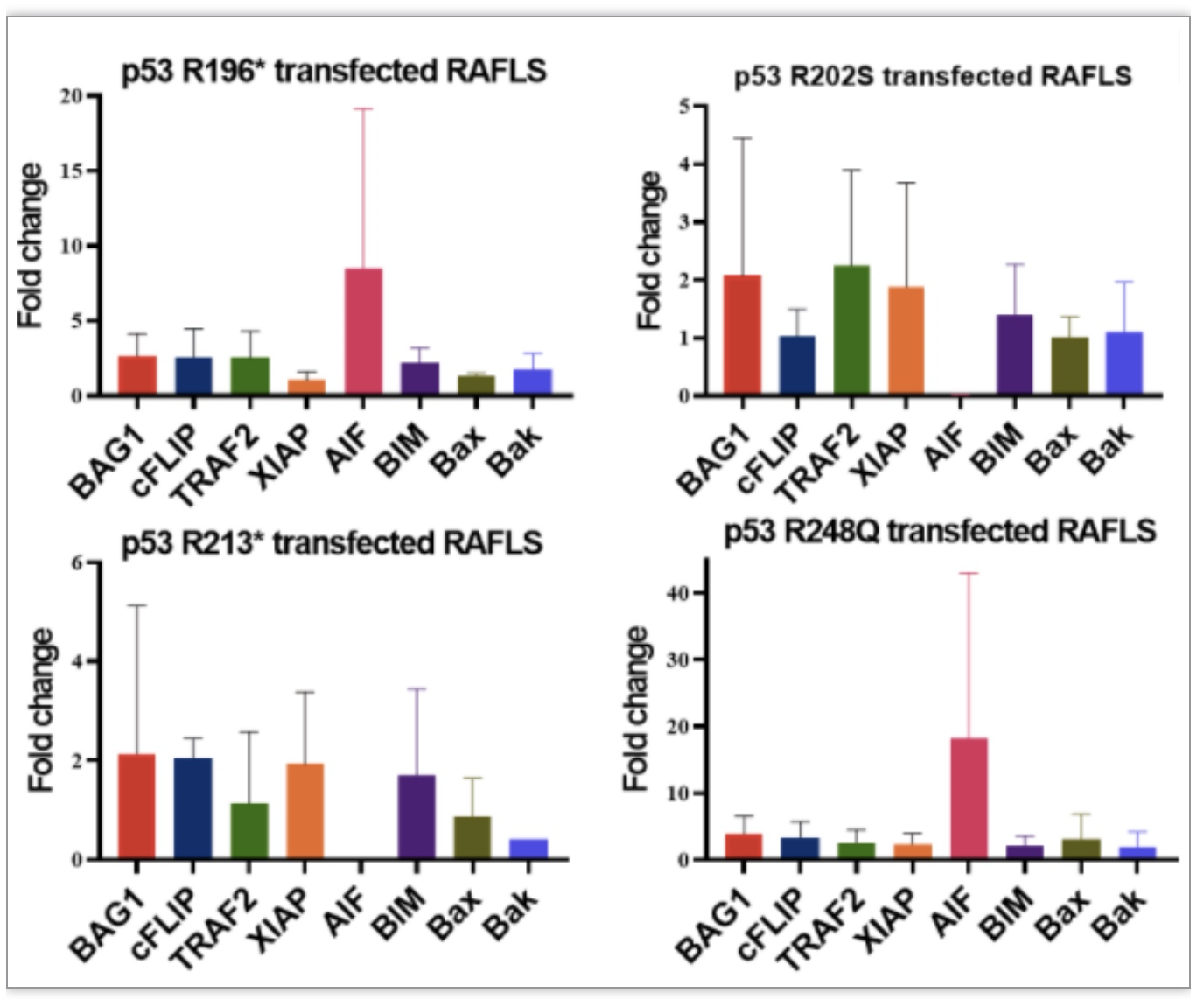
图2 实时荧光定量PCR分析转染RAFLS的p53突变体中凋亡相关标志物的表达水平
(图源:Qiu C. et al., Genes & Diseases, 2023)
2. 流式检测p53突变体过表达 RAFLS的凋亡细胞比例及caspase-3活性
为了进一步分析因过表达p53突变基因而具有极高MTX IC50(>100μM)的RAFLS是否表现出抗凋亡表型,作者分析了凋亡标记物膜联蛋白V/碘化丙啶(Annexin V-FITC/PI-PE)和 caspase-3 活性。结果表明,同樣在MTX的處理下, 与 p53 WT (正常基因) 相比,某些p53突变体具有较低的细胞凋亡百分比和caspase-3 凋亡活性(图3)。
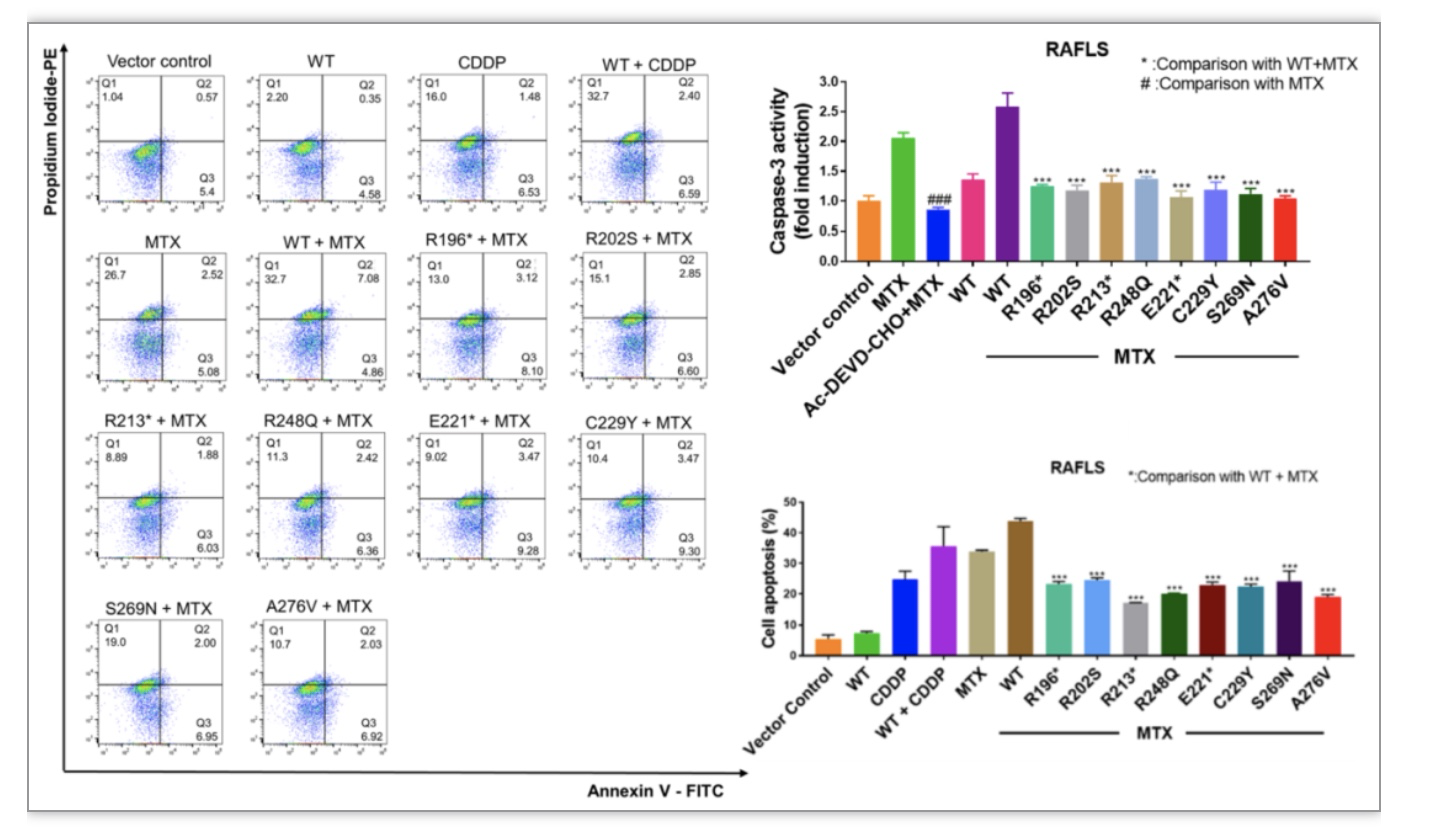
图3 通过膜联蛋白V-FITC/PI-PE染色和caspase-3凋亡活性测定法检测RAFLS在MTX处理下转染了p53突变体的抗凋亡表型。
(图源:Qiu C. et al., Genes & Diseases, 2023)
三、RA 相关的 p53 基因突变是否会促进 RAFLS 的细胞迁移?
1.RT-PCR检测p53突变体过表达 RAFLS 中细胞迁移标志物的表达
在癌症患者中p53突变体往往伴随着癌细胞迁移能力的增强,基于此作者检测了p53突变体过表达RAFLS中细胞迁移相关基因的表达情况,包括肌动蛋白相关蛋白2(Actin Related Protein 2,ACTR2)、细胞分裂周期蛋白42(Cell division cycle 42,CDC42)、丝切蛋白1(Cofilin-1,CFL1)、集落刺激因子1(Colony stimulating factor 1,CSF1), 皮层肌动蛋白(Cortactin,CTTN), 基质金属蛋白酶2 (Matrix metallopeptidase 2,MMP2), 膜突蛋白(Moesin,MSN)和BCAR1支架蛋白-Cas家族成员(BCAR1 scaffold protein-Cas family member,BCAR1)。
2.细胞划痕和transwell迁移分析来进行评估。
结果显示, 两个 p53突变体H193Y 和 R248Q,可能通过促-迁移蛋白的上调(大于 2 倍的增加)和抗-迁移蛋白的下调(减少0.5 倍),推动 RAFLS 迁移表型的发展(图4a)。此外,伤口愈合(图4b,图片表示转染RAFLS的p53突变体在24小时和48小时内的迁移活动)和transwell迁移测定结果表明(图4c,图片显示RAFLS在48h后的迁移情况),多个p53突变体能够在24小时或48小时內促进RAFLS的迁移、侵袭表型。
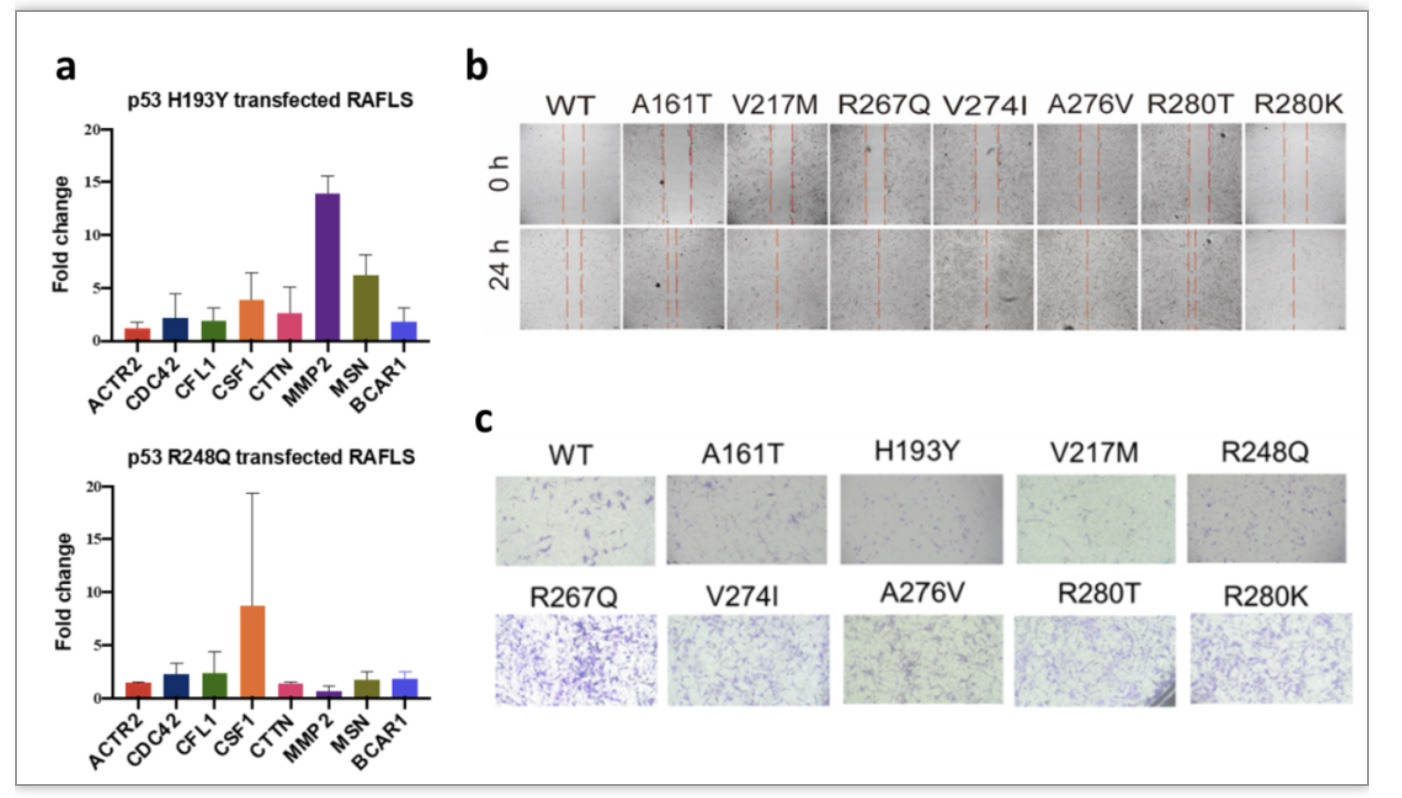
图4 实时PCR分析p53突变体转染RAFLS中迁移相关标记的表达水平,Wound Healing及transwell测定p53突变对RAFLS迁移能力的促进作用
(图源:Qiu C. et al., Genes & Diseases, 2023)
此外,使用能够绕过p53相关的复杂网络的药物,似乎可以用来克服耐药性问题。如雷公藤红素(Celastrol)能够通过操纵 RAFLS 中的 Ca2+ 信号激活自噬[8],并通过抑制转运蛋白和诱导 p53非依赖性细胞凋亡来克服癌细胞中的 MTX 抗性(未发表的数据)。
最后,该研究代表了一个新的p53概念进展和新的翻译后功能相关发现,这对于指导治疗由p53突变导致的甲氨蝶呤耐药的RA患者非常重要,并有利于进一步开发针对p53突变的抗关节炎药物。

