败血症是一种由致病微生物引发的免疫过度激活和氧化应激失调引起的全身性炎症综合征,最终发展为多器官功能障碍综合征,是重症监护病房患者死亡的主要原因,约占每年全球死亡人数的20%,已经被世界卫生组织确定为全球重点卫生问题[1]。焦亡 (炎症因子风暴) 和细胞凋亡是导致败血症高死亡率的两个最重要的因素。脂多糖 (Lipopolysaccharide,LPS)侵入机体后,激活NF-κB炎症通路,并诱导形成完整的、活跃的NLRP3炎性小体,激活焦亡途径并放大炎症反应[2]。炎症反应进一步刺激ROS的大量产生以及线粒体位点的钙离子超载,致使线粒体功能障碍和能量合成受阻,激活随后的线粒体凋亡从而加速器官衰竭[3]。烟酰胺腺嘌呤二核苷酸 (Nicotinamide adenine dinucleotide,NAD+) 参与维持线粒体功能,并且通过阻断典型和非典型的炎症小体途径来预防细胞焦亡,但因带负电荷性不易在细胞膜上扩散而限制了其生物活性[4]。钙离子螯合剂1,2-双 (2-氨基苯氧基) 乙烷-N,N,N`,N`-四乙酸四乙酸甲酯(BA-AM)在进入细胞后可被酯酶水解成为活性的钙离子螯合剂BA,缓解细胞内质网与线粒体钙超载,抑制线粒体介导的细胞凋亡,但其脂溶性限制了其应用[5]。该研究构建了HMPDA@BA/NAD+@LSA NPs纳米制剂,实现败血症发展进程中多项病理机制(如氧化应激、细胞能量耗竭、离子稳态失调、炎症等)的综合调控,抑制细胞凋亡和细胞焦亡,达到治疗败血症的目的。

研究人员制备了超小的中空介孔聚多巴胺纳米颗粒,粒径为60 nm左右,空腔直径和孔径分别为20.4 nm和11.0 nm。以HMPDA为载体,负载药物NAD+和BA-AM,并加以炎症靶向肽修饰,得到HMPDA@BA/NAD+@LSA NPs。该NPs能在水溶液中均匀分散,具有超高载药量(NAD+载药量为38.3%,BA-AM载药量为23.8%),并且可以在炎症酸性环境下迅速裂解从而实现药物的快速释放(图1)。

图1 NPs的制备过程及其表征
(图源:Yan Jiahui, et al. Advanced Science, 2023)
HMPDA@BA/NAD+@LSA NPs具有良好的生物相容性,在1 ~ 100 μg/mL浓度范围内(以BA-AM浓度为基础) 对AML-12细胞和HK-2细胞均没有明显的细胞毒性。并且该纳米颗粒可以补充细胞内NAD+库,提高细胞内的ATP含量,对细胞给予能量补充,进而提高细胞活力。此外,该纳米颗粒通过发挥两种药物和HMPDA的协同机制,将细胞内相对ROS水平降低至模型组的90.4%,Ca2+水平降低至模型组的50.3%,恢复到接近对照组的水平,从而降低细胞内氧化应激,恢复细胞内钙稳态以及线粒体功能,最终挽救受损细胞(存活率高达80%) (图2)。
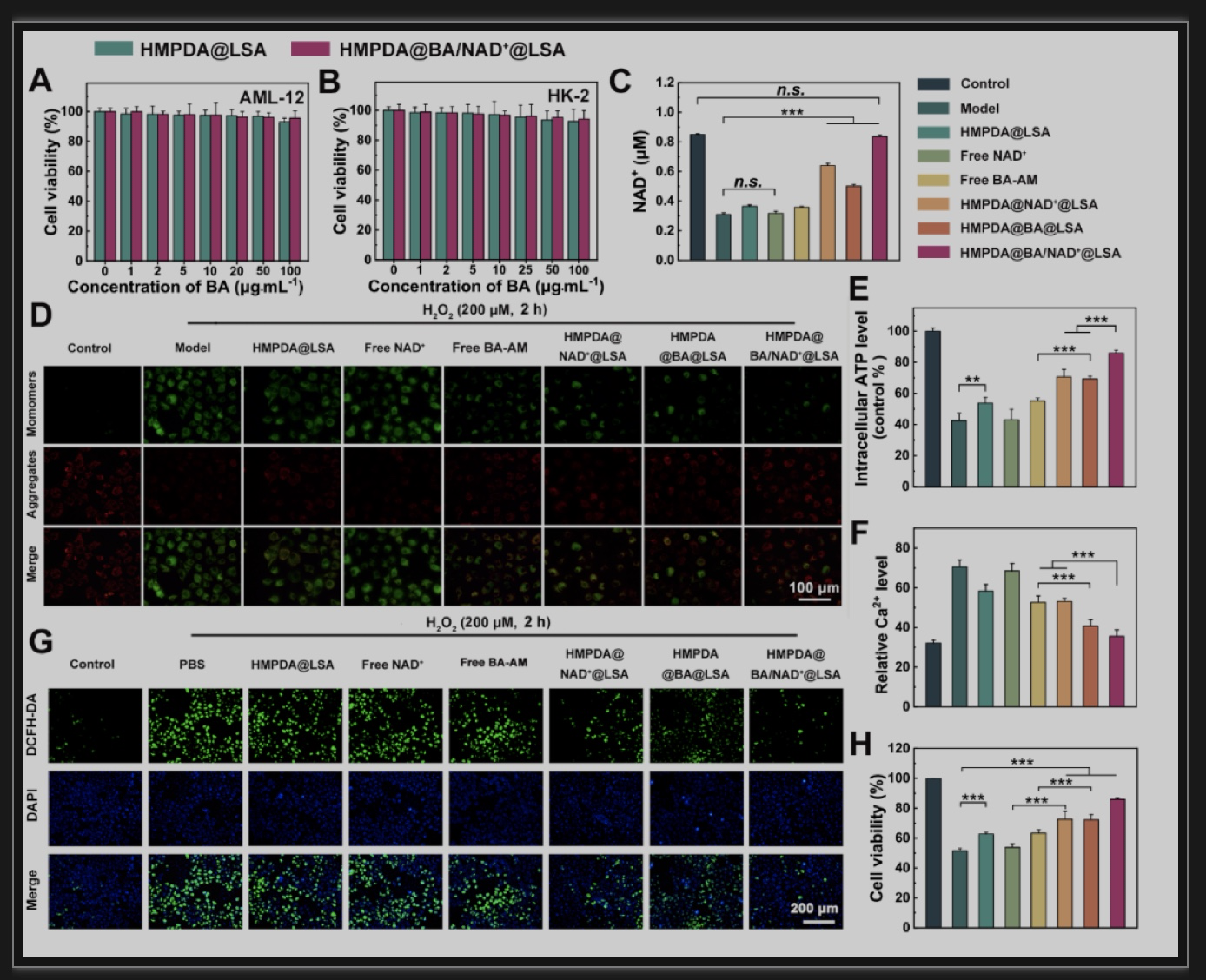
图2 NPs的体外治疗效果
(图源:Yan Jiahui, et al. Advanced Science, 2023)
HMPDA@BA/NAD+@LSA纳米制剂进入机体后通过特异性结合炎症部位高表达的DPEP1靶向到受损器官。在LPS诱导的败血症小鼠模型中,经HMPDA@BA/NAD+@LSA NPs治疗后,败血症小鼠的存活率从18.8%提升到68.8%,并且其器官水肿程度、肝功能、肾功能、组织氧化应激水平均显著改善,与正常小鼠相比无显著差异。此外,HMPDA@BA/NAD+@LSA NPs治疗组各脏器未见明显病理改变或凋亡(肝脏、肾脏、肺部TUNEL阳性凋亡率比例分别由52.1%、51.3%、59.5%下降至15.2%、13.4%、11.4%),说明该纳米制剂可有效抵抗细胞凋亡,防止脏器病理生理恶化(图3)。

图3 NPs对败血症小鼠的治疗效果
(图源:Yan Jiahui, et al. Advanced Science, 2023)
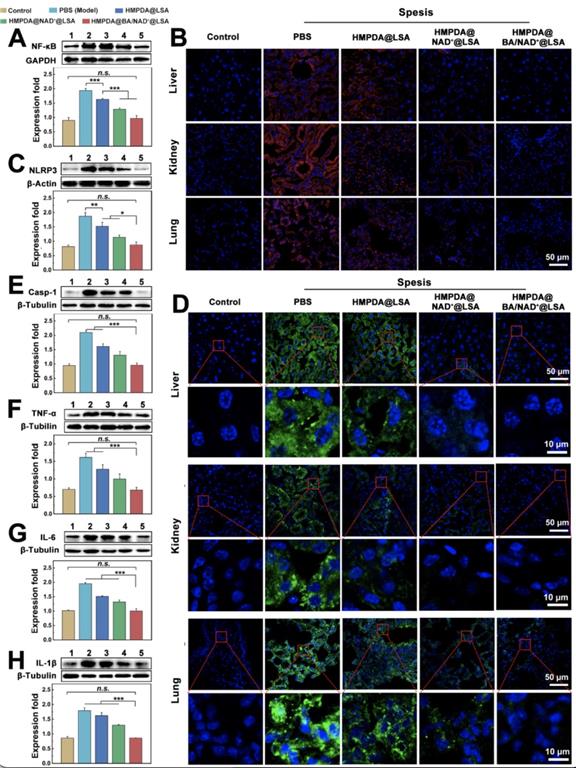
图4 NPs对细胞焦亡通路:NF-κB-NLRP3-ASC-Casp-1相关蛋白表达的影响
(图源:Yan Jiahui, et al. Advanced Science, 2023)
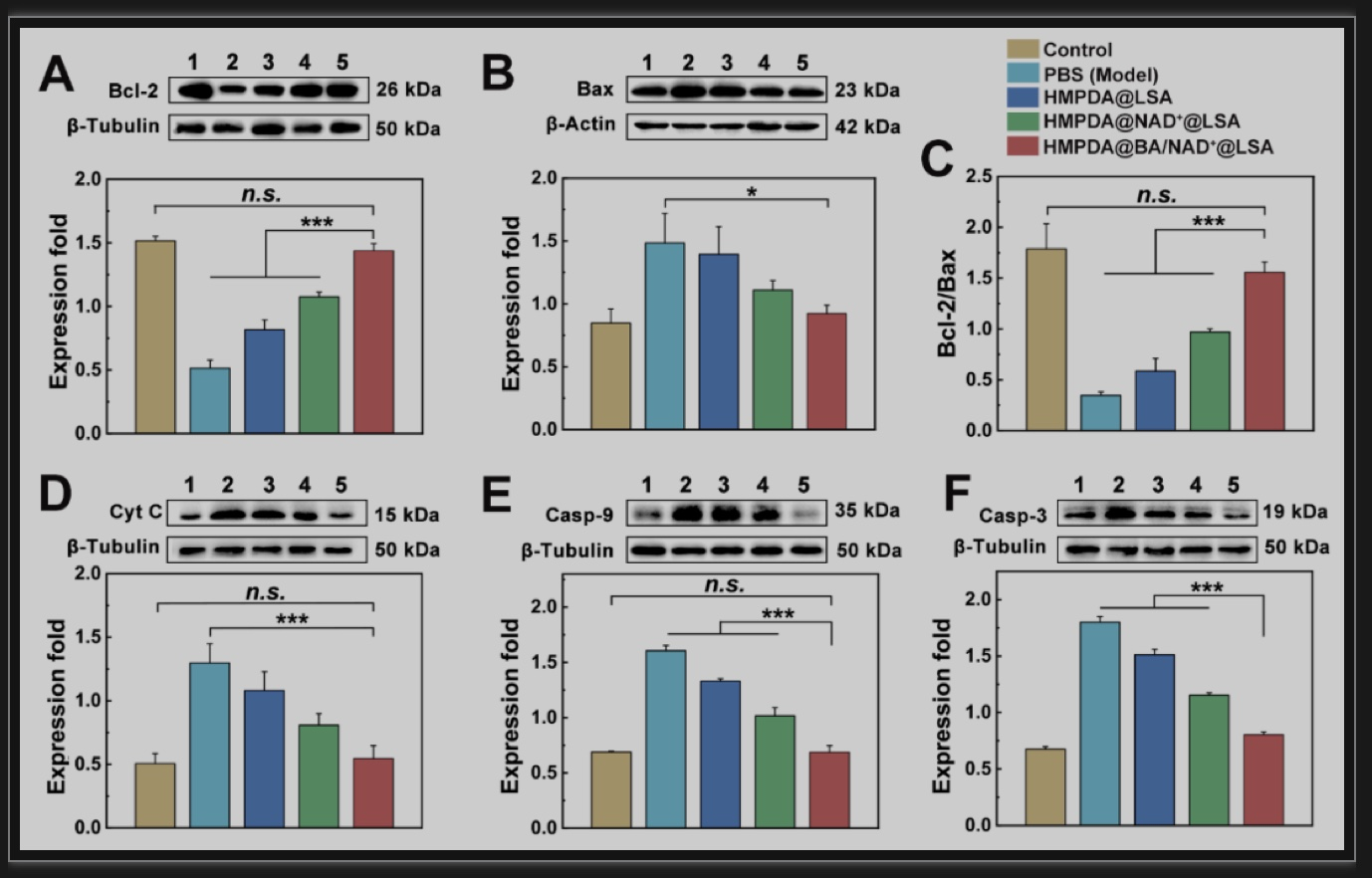
图5 NPs对线粒体凋亡通路:Bcl-2/Bax-Cyt-C-Casp-9-Casp-3相关蛋白表达的影响
(图源:Yan Jiahui, et al. Advanced Science, 2023)
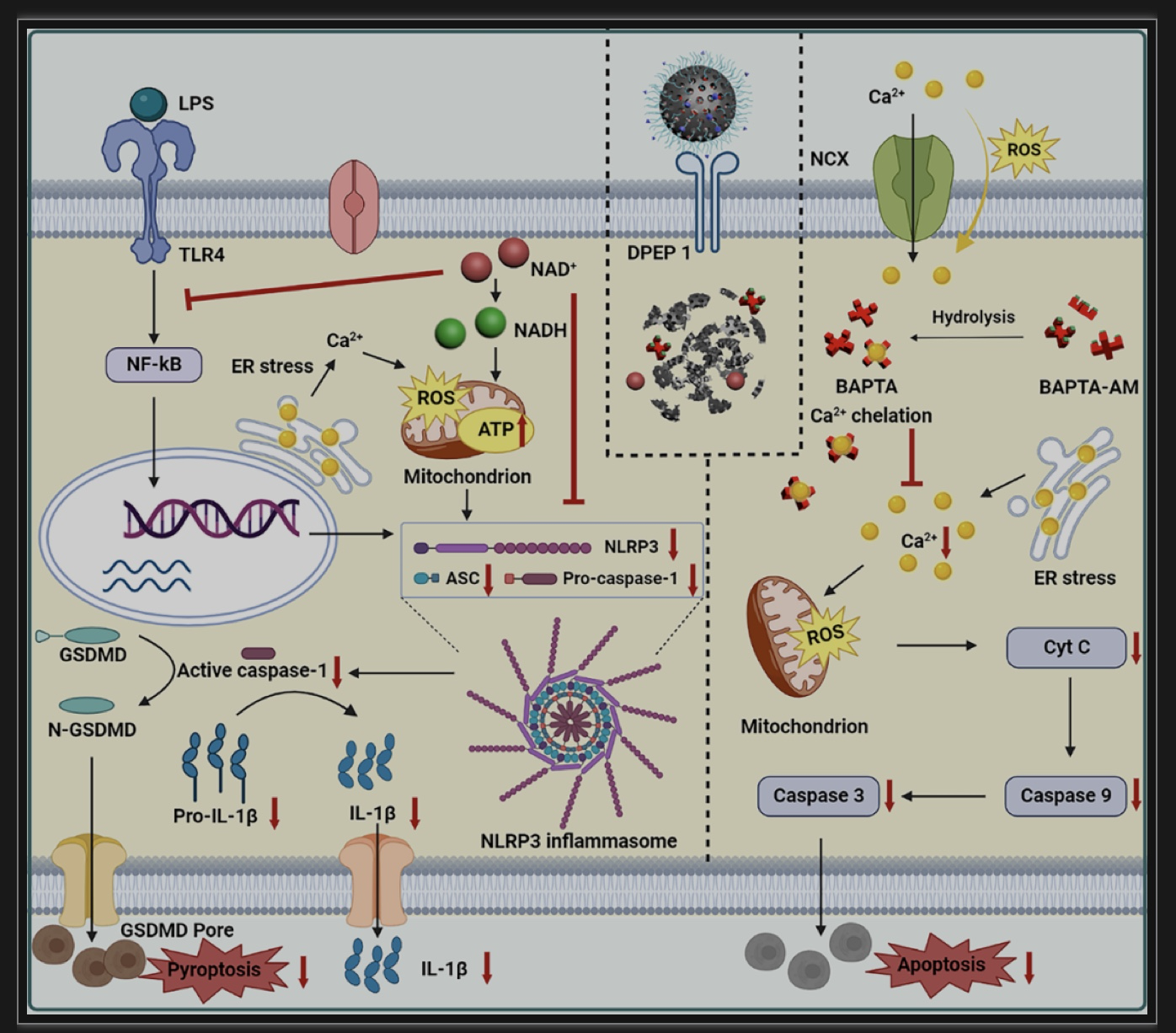
图6 HMPDA@BA/NAD+@LSA NPs的调节机制示意图
(图源:Yan Jiahui, et al. Advanced Science, 2023)

