前列腺癌是世界范围内男性发病率第二位的恶性肿瘤,严重威胁全球中老年男性健康。MYC作为功能强大的转录因子调控了多种生物学过程,并在多种肿瘤的发生发展过程中起到重要驱动作用[1]。已有众多研究报导了远端增强子通过染色质远程相互作用调节MYC基因的表达,但MYC本身对染色质三维构象的调控作用尚未充分阐明[2]。CTCF是重要的染色质三维结构组织者,与Cohesin复合物共同建立染色质环和拓扑关联结构域。CTCF通过将CTCF-CTCF染色质环内的增强子/启动子与外部调节元件隔离,或与其他转录因子共定位促进增强子-启动子相互作用最终调控基因的表达[3]。然而,MYC和CTCF这两个重要调控蛋白之间的功能联系仍不清楚。
该研究测定了多个前列腺癌细胞模型中的三维基因组结构数据,阐明了前列腺癌中转录因子MYC通过重塑CTCF介导的染色质结构调控前列腺癌的特异性基因转录的分子机制,对深入认识MYC在三维基因组结构中的作用及前列腺癌的精准治疗提供理论依据。

HiChIP(in situ Hi-C followed by chromatin immunoprecipitation)是一种以蛋白质为中心的高通量染色质构象分析技术,结合了染色质免疫共沉淀和染色质构象捕获技术的优势[4]。通过使用特异性抗体富集与转录因子或染色体相关蛋白结合的DNA片段,利用染色质构象捕获技术将富集的DNA片段与其在染色体上的相互作用联系起来,以深入解析染色质构象。HiChIP技术具有许多优点,包括高灵敏度、高分辨率、高特异性和高覆盖度,可以在较短的时间内生成大量的数据。研究人员利用HiChIP技术在前列腺癌中绘制了一系列特定蛋白(H3K27ac、CTCF、AR)介导的染色质互作图谱(图1)。通过整合分析HiChIP、ChIP-seq和RNA-seq数据,系统地表征了前列腺癌中各种基因组调控区域的相互作用。
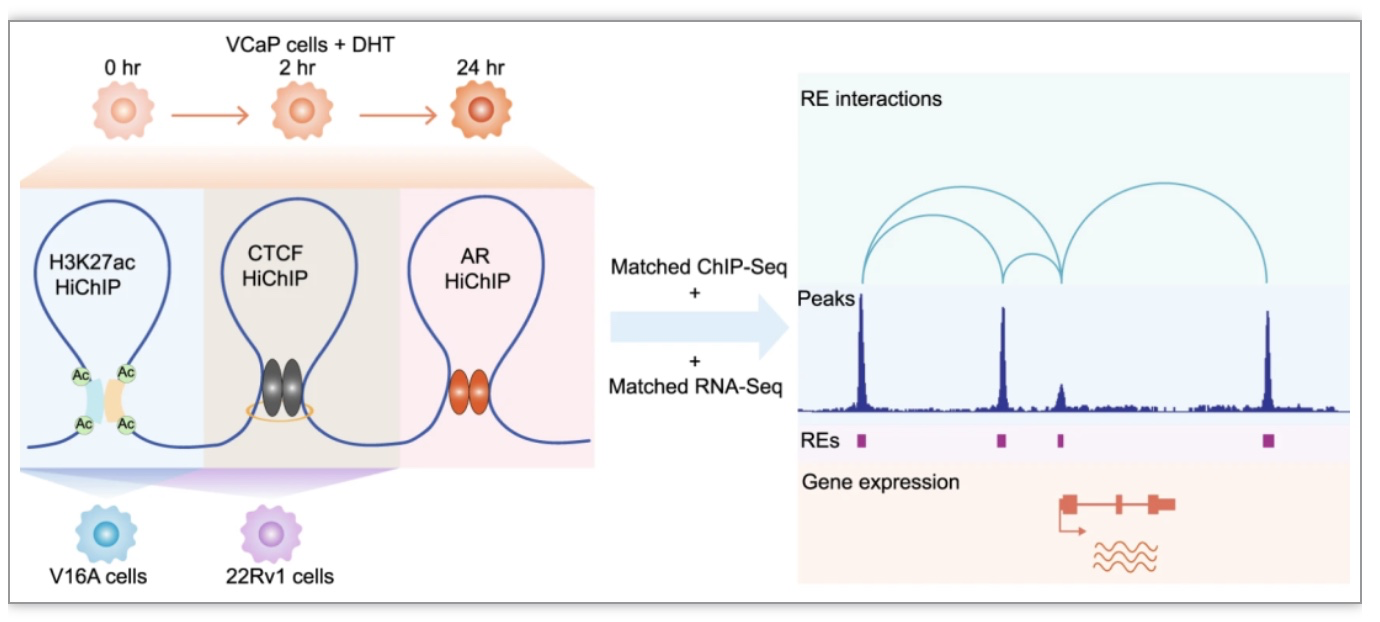
图1 前列腺癌细胞中HiChIP实验和分析概述
(图源:Wei, et al., Nature communications, 2023)
前列腺癌中MYC的8q24区域中包含许多CTCF介导的染色质环,但这些loop的具体功能并不明确。前期研究人员利用CRISPR技术敲除MYC基因上游10Kb的CTCF位点,发现MYC的表达显著上调。进一步通过dCas9-KRAB复合物靶向-10Kb CTCF位点,检测MYC的表达、MYC靶基因表达和细胞增殖的影响,确认此位点对MYC表达的促进作用。为深入分析-10Kb CTCF位点在染色质三维互作中的作用,研究者获得了22RV1细胞中H3K27ac和CTCF的HiChIP数据,发现-10Kb CTCF位点的缺失破坏了CTCF介导的染色质loop,引入新的H3K27ac相关loop将上游增强子连接到MYC启动子区域(图2)。
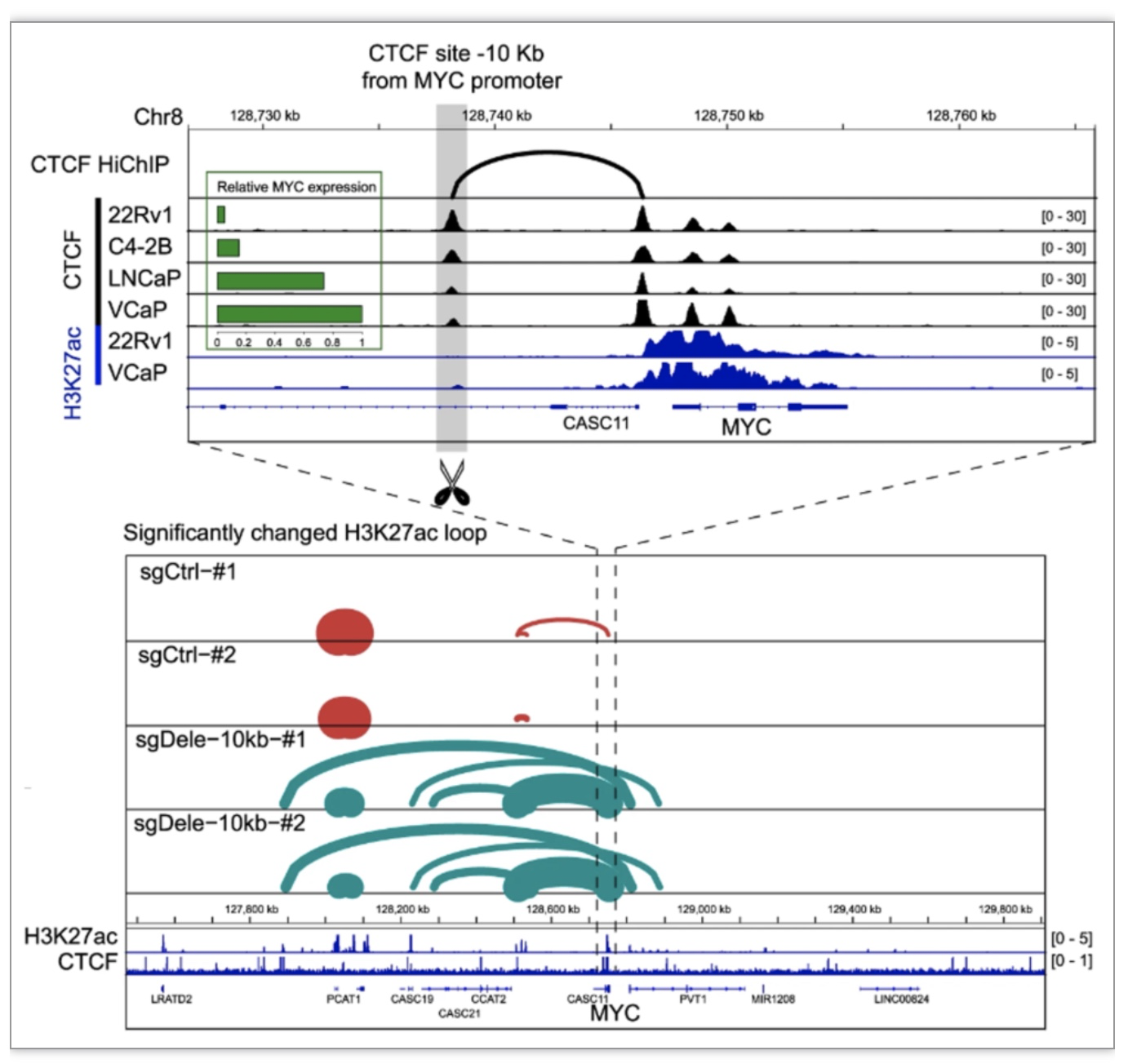
图2 -10Kb CTCF位点的缺失导致MYC区域H3K27ac loop的改变
(图源:Wei, et al., Nature communications, 2023)
为评估MYC对CTCF介导的三维染色质组织的影响,研究人员建立了MYC过表达的22RV1细胞系,并进行RNA-seq、MYC/CTCF/H3K27ac ChIP-Seq和CTCF/H3K27ac HiChIP分析。联合分析发现,MYC促进了CTCF在MYC/CTCF共同位点的染色质结合。随后,通过co-IP、GST-pulldown和Proximity Ligation Assay证实了CTCF和MYC之间存在相互作用(图3)。
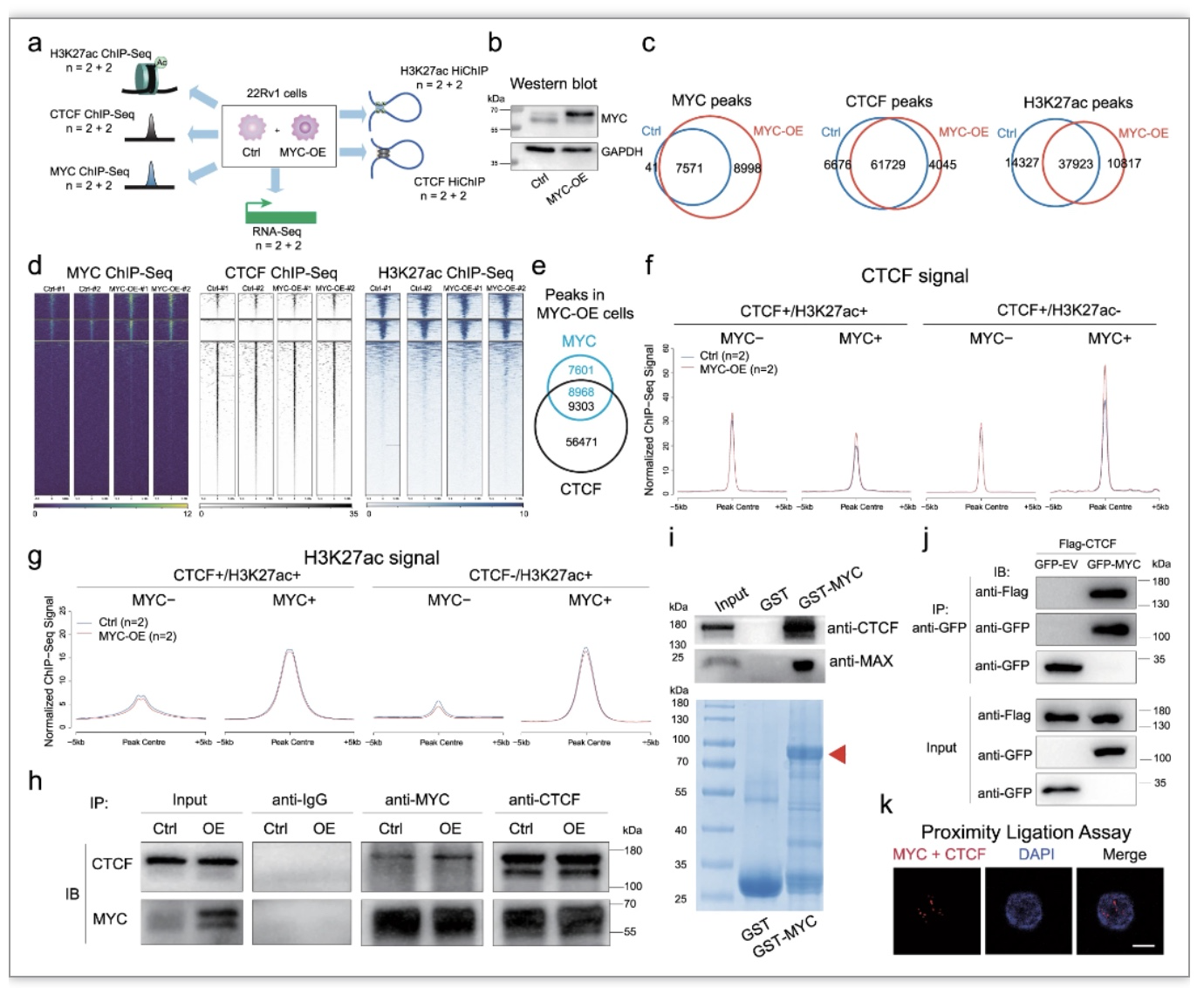
图3 MYC促进CTCF与染色质的结合
(图源:Wei, et al., Nature communications, 2023)
由于神经内分泌转分化在前列腺癌进展中起重要作用[5],研究者通过差异表达和基因集富集分析,发现MYC抑制部分神经内分泌相关基因的表达。结合CTCF/H3K27ac HiChIP数据,发现MYC可以阻断神经内分泌相关基因的增强子-启动子互作。这些数据表明,MYC与CTCF的相互作用促进了CTCF与染色质的结合,促进了CTCF-CTCF染色质环的形成,从而抑制神经内分泌基因的转录(图4)。
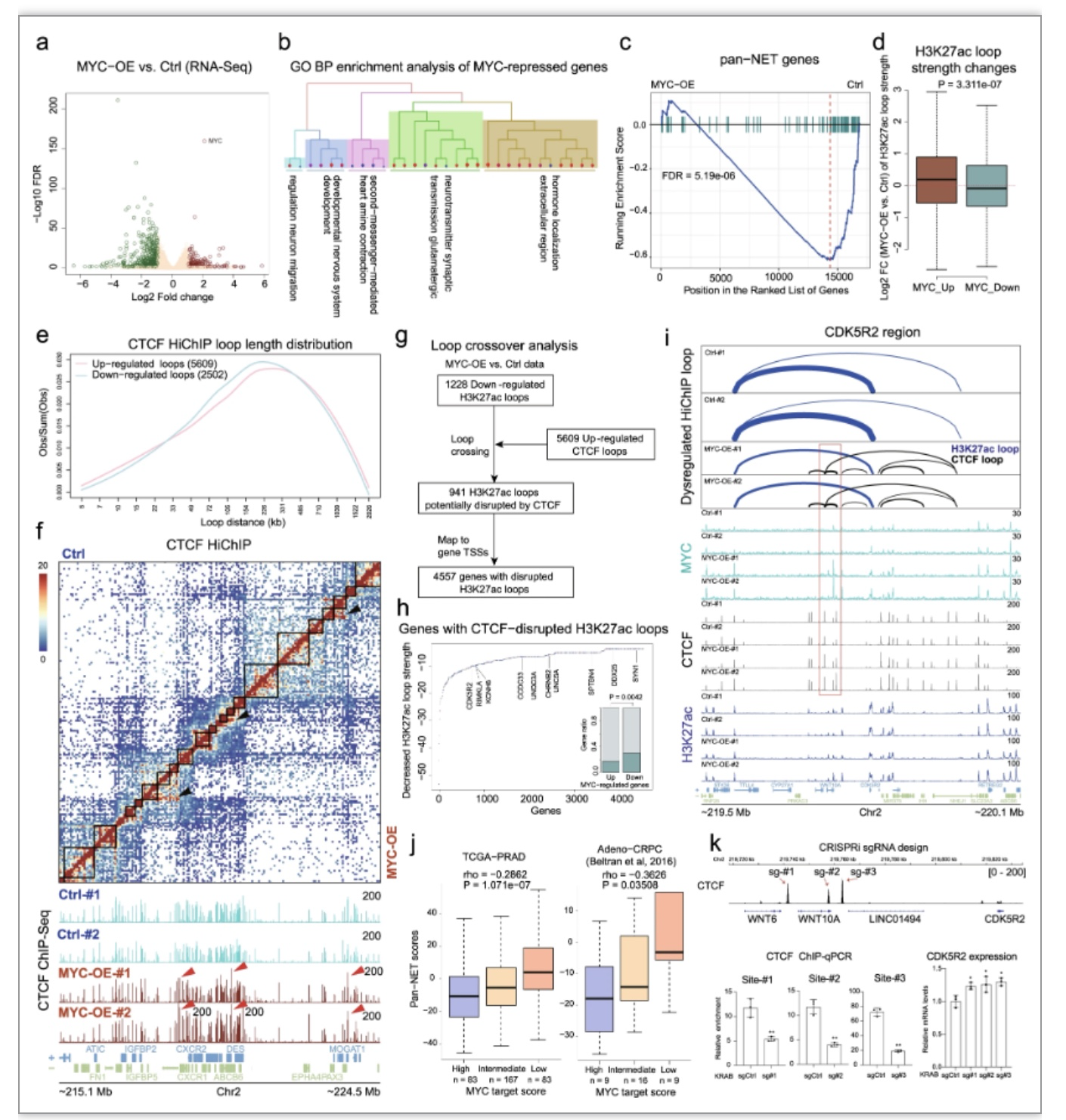
图4 MYC通过促进CTCF looping形成抑制神经内分泌基因的表达
(图源:Wei, et al., Nature communications, 2023)
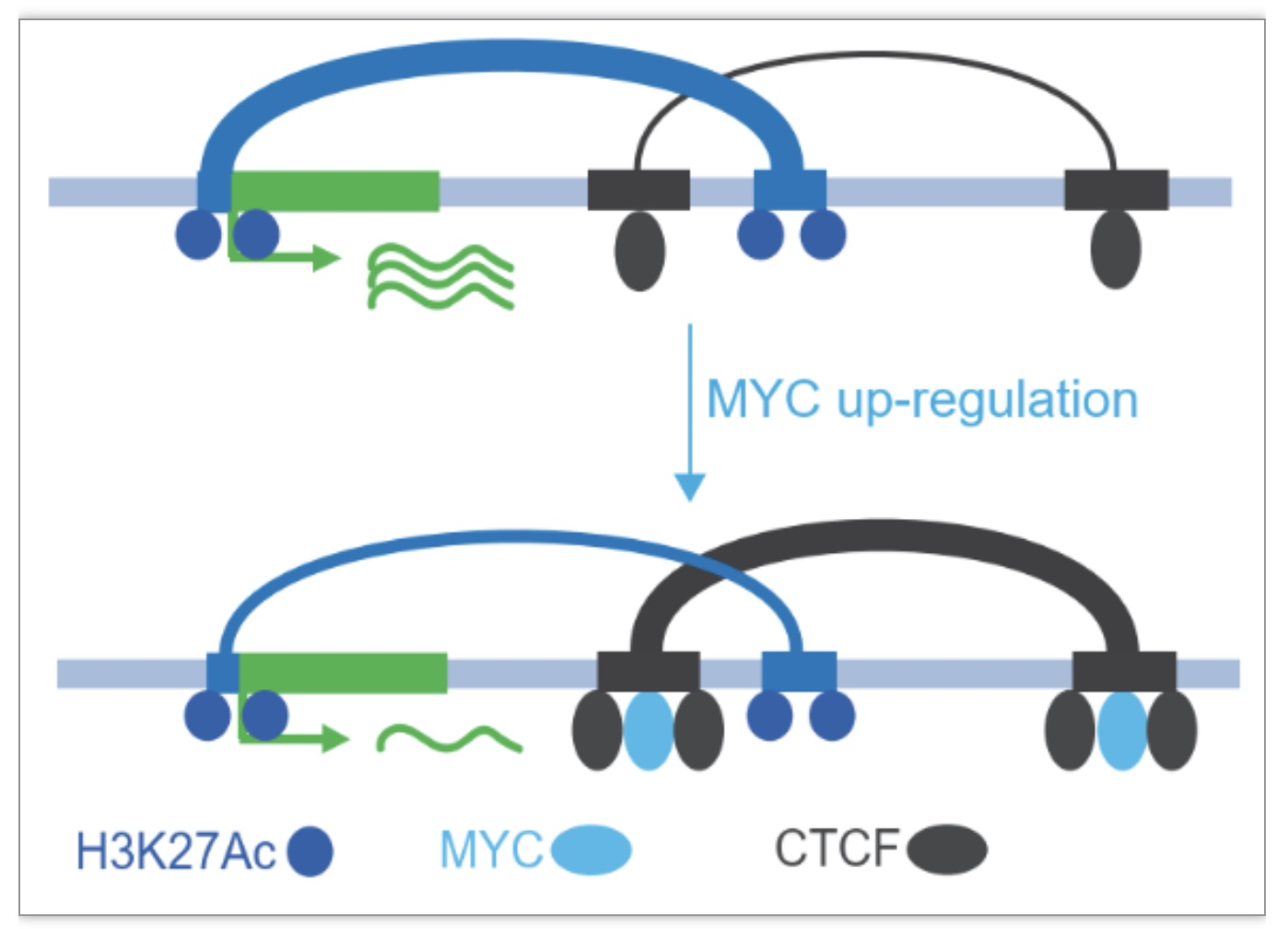
图5 MYC对前列腺癌染色质三维互作的调控模型
(图源:Wei, et al., Nature communications, 2023)

