细胞内各项生命活动均需要在特定的pH条件下完成,因此对细胞内pH稳态的精细调控是维持细胞功能的前提。酸分泌细胞向胞外分泌酸性物质执行特定功能,主要包括胃壁细胞和破骨细胞等。胃壁细胞向外分泌盐酸来维持胃器官的消化功能,而破骨细胞则通过分泌酸来产生破骨作用,维持骨稳态。酸性物质外排会导致细胞内环境的碱化。有报道指出2型阴离子交换蛋白(Anion Exchange protein 2, AE2)介导的HCO3-和Cl-对向运输,能够通过外排HCO3-来降低细胞内pH,维持酸分泌细胞的pH稳态。研究表明,AE2功能失调会造成胃酸缺乏、骨硬化、男性不育等病症。AE2是SLC4家族成员,由SLC4A2基因编码,同AE1(SLC4A1)和AE3(SLC4A3)一起被称作阴离子转运体。AE1-3均可介导电中性的阴离子跨膜运输。AE1和AE3仅在特定的组织中表达,而AE2为广泛表达的管家型基因,且功能实验表明AE2介导的阴离子交换对pH敏感,表现为酸性抑制和碱性激活的状态(图1a)。SLC4A家族的阴离子交换蛋白中,目前仅有AE1结构通过晶体学和冷冻电镜被解析,所报道的结构均处于外向开放构象。因此,已有的结构信息不足以阐述SLC4A家族阴离子交换蛋白在催化HCO3-和Cl-转运过程中的构象变化,而AE2响应pH变化介导转运的工作机理更不明确。
该研究首次报道了人源AE2蛋白高分辨率的全长结构,并结合多个构象的结构信息提出了AE2响应pH变化从而介导阴离子转运的工作模型,为帮助了解HCO3-和Cl-的跨膜转运机制奠定了结构基础。

该文章发现,人类AE2以同源二聚体形式存在,其跨膜结构域(TMD)和N末端细胞内结构域(NTD)均参与二聚体界面的形成(图1b)。不同于AE1和AE3,AE2在不结合底物离子的生理pH条件下呈现为内向开放的自抑制构象。C末端的环状结构(LoopCT)插入向内开放的底物腔室中,阻止底物离子的结合,并将TMD固定在内向开放构象。跨膜螺旋10和11之间的弯环扳机结构(LoopTM10-11)插入NTD二聚体之间,通过分子内和分子间的相互作用,稳定了NTD和TMD的相对位置。
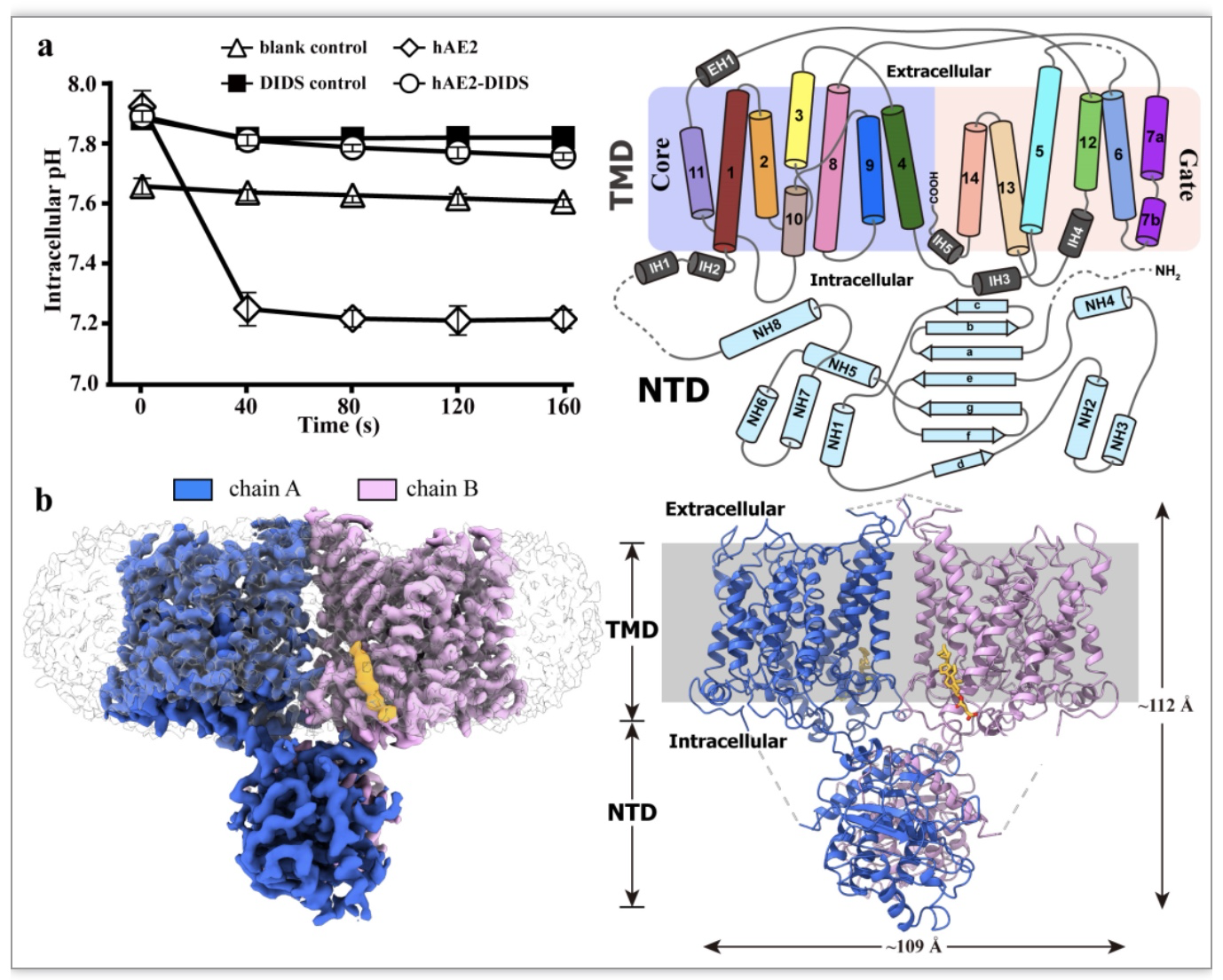
图1. AE2的pH调节活性与冷冻电镜三维结构。
(图源:Zhang, et al., Nature communications, 2023)
为模拟AE2响应细胞内碱化的开放工作过程,研究者还解析了碱性条件以及不同底物分子存在下的AE2蛋白结构(图2)。当将蛋白置于高pH条件时,AE2的NTD发生大规模变构而导致EM信号消失,仅AE2的TMD得到解析并以两种构象存在,分别为中间态构象和外向开放构象。其中AE2的NTD响应pH发生变化,释放LoopTM10-11,进而使得跨膜螺旋重排,内向开放的底物腔室缩小,形成中间态构象(图2c)。随着LoopTM10-11向膜侧抬起,跨膜区进一步重排,内向的底物腔室逐渐消失,外向的底物腔室打开,AE2转而进入外向开放构象,实施细胞内外的离子交换(图2c)。研究者进一步解析了AE2结合底物HCO3-和Cl-的高分辨率结构,结合细胞功能试验,描绘了底物离子的结合位点并指出了参与阴离子交换过程的关键氨基酸,为帮助理解AE2的转运机理提供了结构和理论的支撑。此外,AE2与广谱抑制剂DIDS的复合物结构也被解析,同AE1的抑制相似,DIDS结合在外向开放腔室中,通过与跨膜螺旋的赖氨酸形成共价键,产生不可逆的抑制效果。
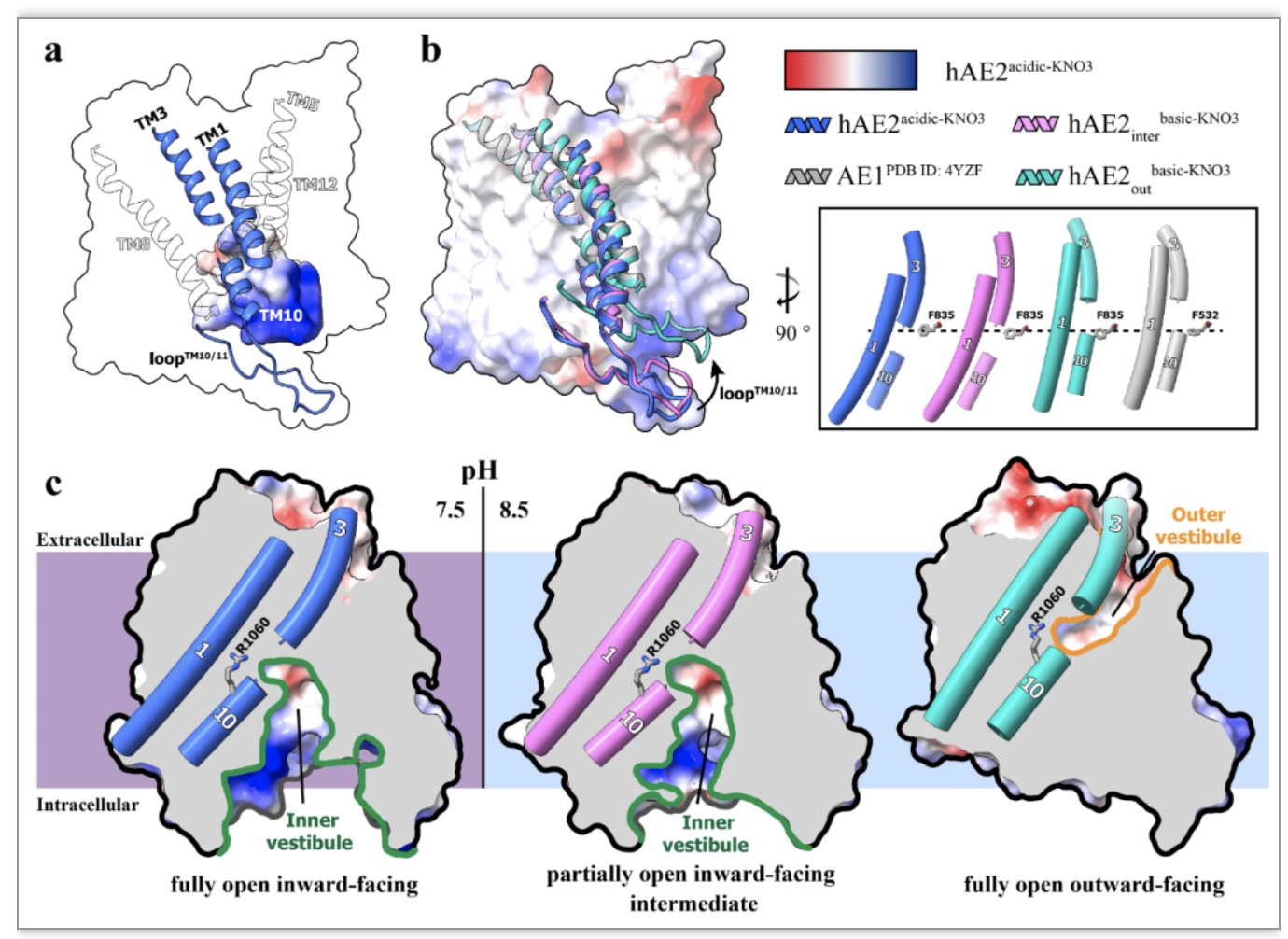
图2.AE2响应pH升高所产生的构象变化。
(图源:Zhang, et al., Nature communications, 2023)
综合解析的多个构象的结构信息,研究人员提出了AE2响应细胞内pH变化而介导HCO3-和Cl-的内外交换,最终维持细胞内pH稳态的工作模型(图3)。当细胞内pH升高时,AE2的自抑制状态解除,形成中间态构象;HCO3-结合到中间态构象的内部腔室,诱发AE2经历快速的构象变化,形成外向开放构象;此时碳酸氢根释放与氯离子摄入发生,促使AE2向内向构象变构,释放氯离子。该离子交换可持续循环进行,直至pH恢复至生理状态并导致AE2回归自抑制状态。
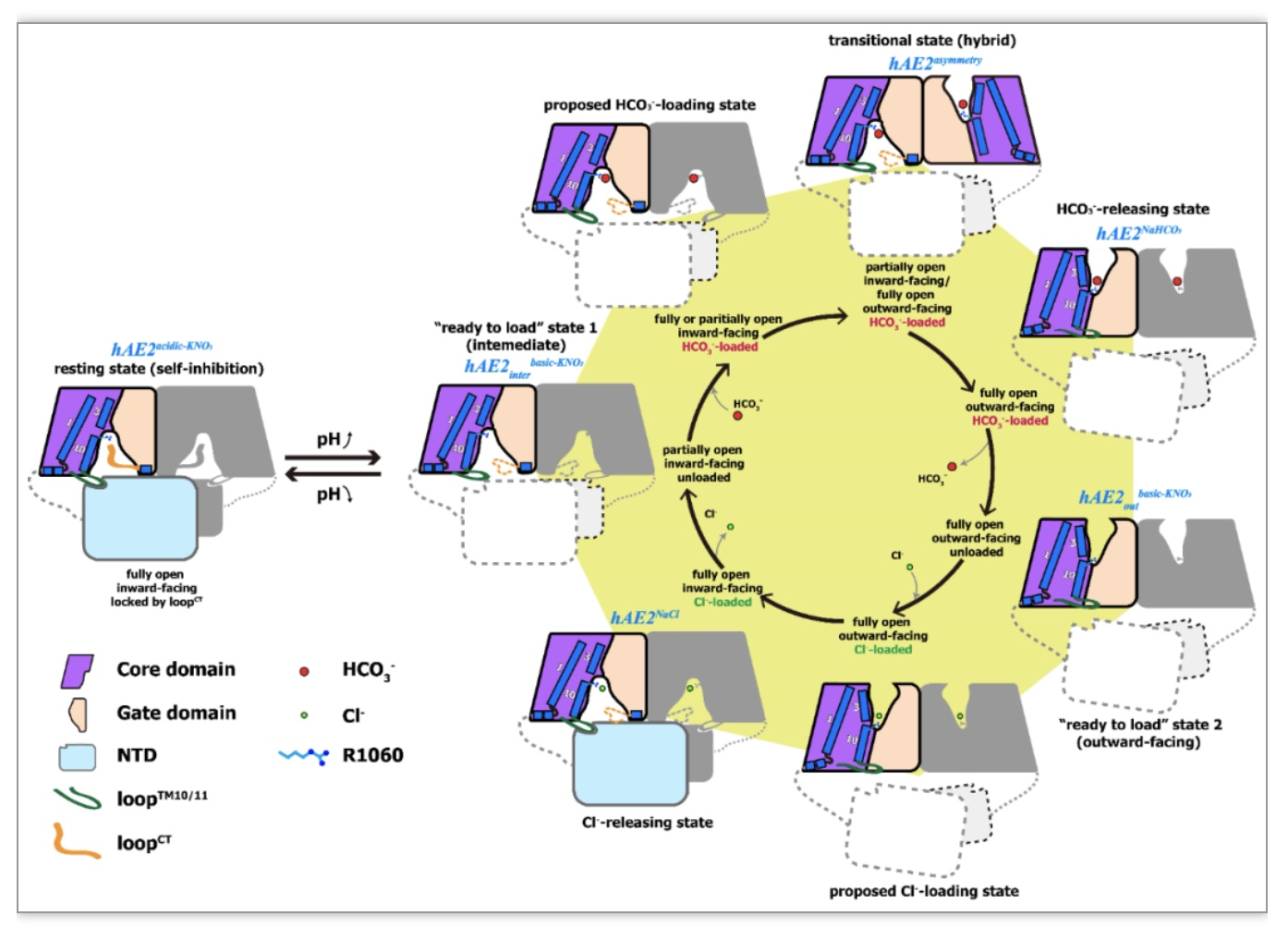
图3.基于多构象AE2冷冻电镜结构的AE2调节细胞内pH稳态工作模型
(图源:Zhang, et al., Nature communications, 2023)

