
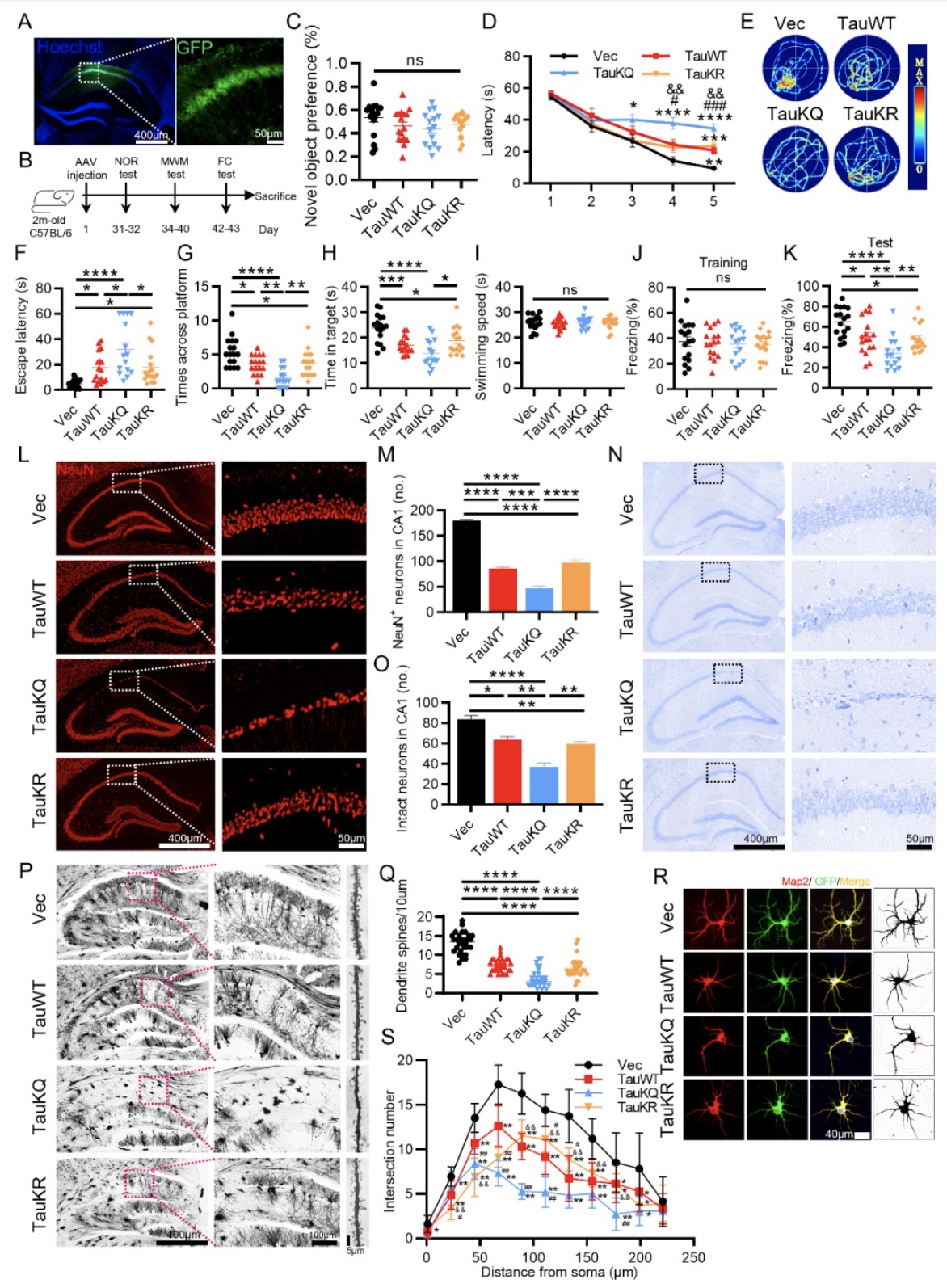
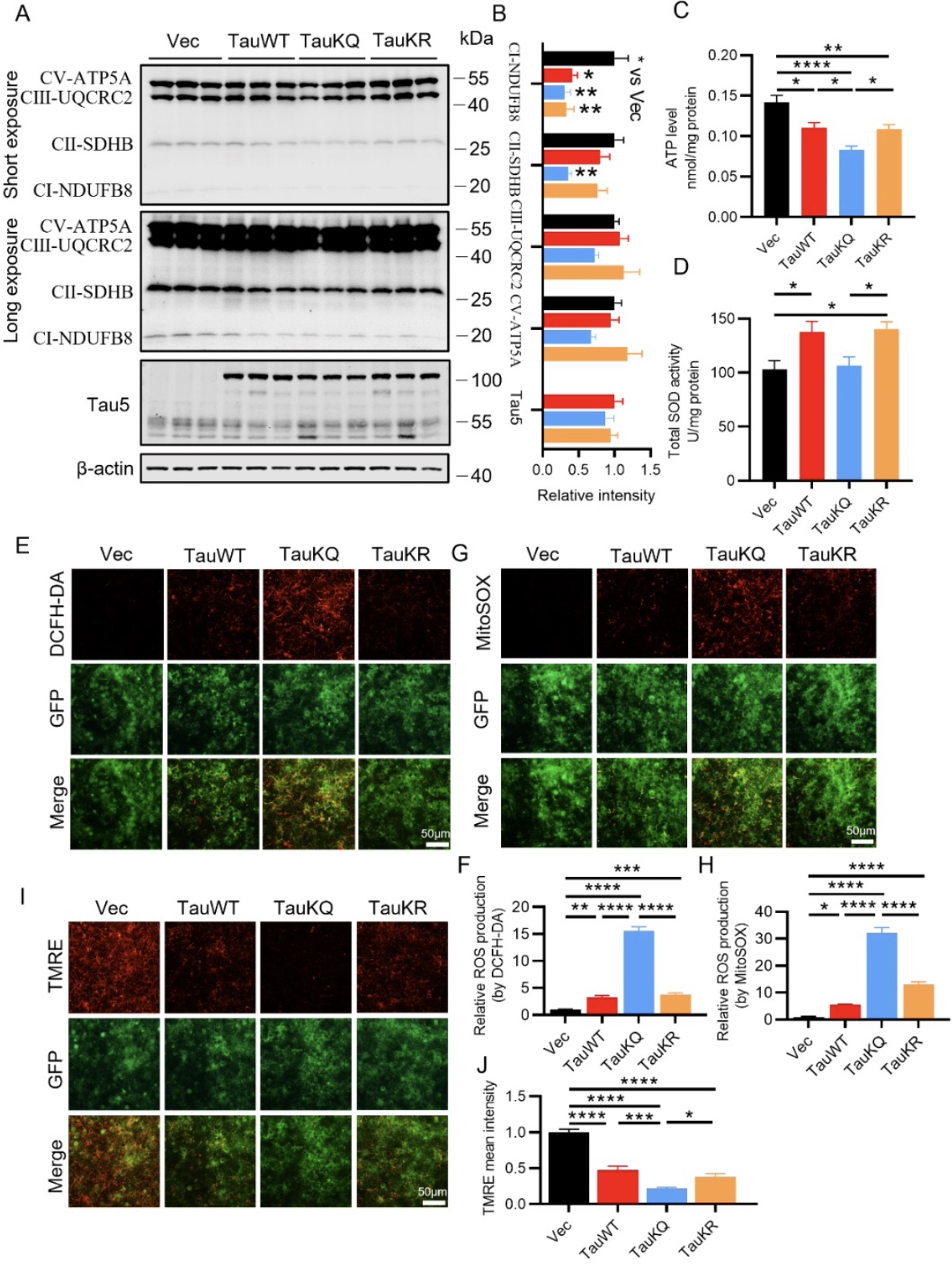
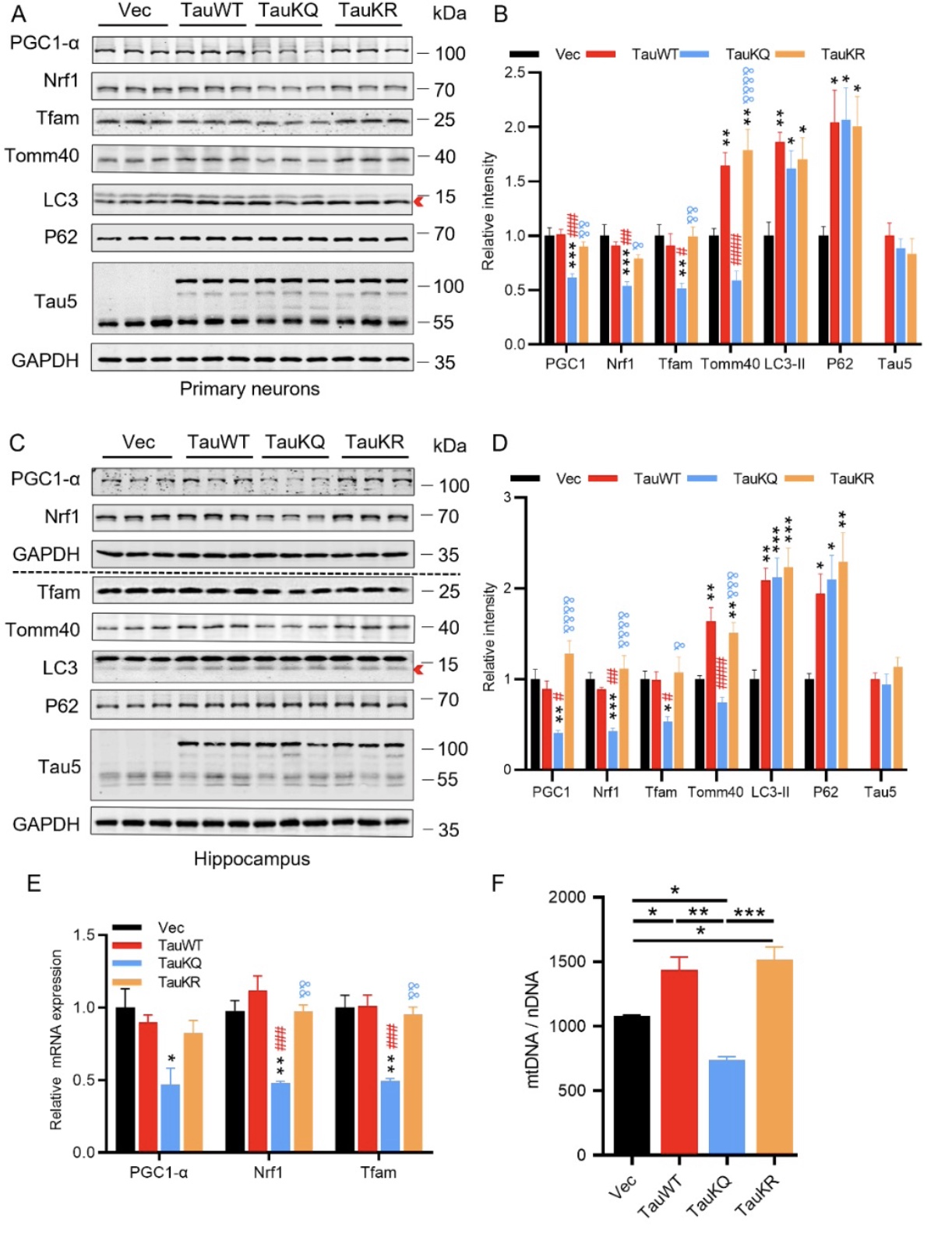

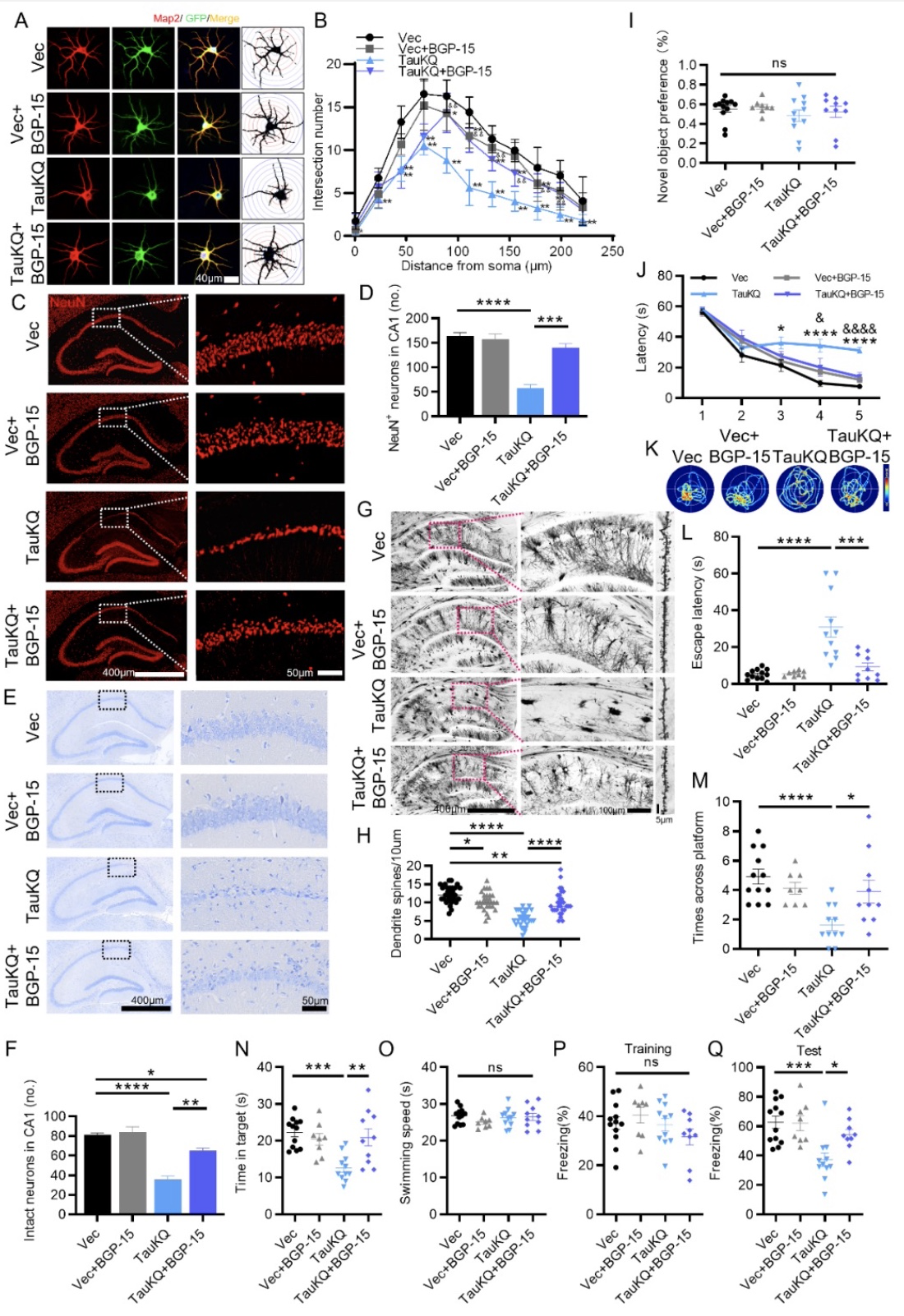
综上所述,该研究结合生物化学、细胞生物学及行为学等多种手段,揭示tau在K274/K281位点的乙酰化(TauKQ)具有比野生型tau和非乙酰化tau更严重的神经毒性。它通过减少线粒体的生物发生,扰乱线粒体的动态平衡,导致线粒体功能失调,从而加重认知功能障碍。作者还发现,BGP-15通过促进线粒体的生物发生和融合,逆转了TauKQ诱导的线粒体功能失调和认知障碍,证明了BGP-15在神经疾病模型中的潜在用途。本文不足之处是,虽然重组KQ突变体(赖氨酸残基被谷氨酰胺取代,作为乙酰赖氨酸的模拟物)和KR突变体(用精氨酸取代赖氨酸残基作为非乙酰化赖氨酸的模拟物)被广泛用于研究乙酰化的影响,但也存在一些局限性。首先,使用的突变tau是100%在这些Lys残基上被乙酰化或非乙酰化,考虑到PTMS的动态调节,这不符合生理规律。其次,当KQ突变体被用作乙酰化赖氨酸的模拟物时,可能会高估体内乙酰化的影响。例如,Ku70环上的赖氨酸残基的乙酰化并没有明显降低Ku对DNA的亲和力[6]。

