糖尿病及其并发症严重威胁着人类健康,已成为全球性的公共卫生问题。糖尿病并发症按不同靶器官划分,包括心血管系统、神经系统、肾脏、视网膜和肝脏等,而糖尿病显著增加了以上疾病的预后不良风险。近几十年来糖尿病并发症的研究进展丰富但缺乏对于糖尿病合并多系统血管病变的整体研究。
糖尿病并发症的病理机制在血管层面具有高度共性,因此该文提出糖尿病泛血管病变(Diabetic Panvascular Diseases,DPD)的定义,即糖尿病患者广泛血管(涵盖心、脑、肾、眼、外周等大血管和微血管)出现以动脉粥样硬化为共同病理特征,以心脑血管事件为主要结局,积极干预代谢异常有助于改善预后的一种临床综合征。并以此概念为基础,梳理了相关分子机制及治疗进展,以期促进基于多学科联合的糖尿病泛血管疾病管理体系的建立。
作者总结了泛血管病变的概念以及糖尿病与泛血管病变的关系,介绍了各靶器官(心、脑、肾、视网膜及外周)血管病变的表现、治疗进展,梳理了糖尿病泛血管病变间的时序关系以及泛血管病变共同的分子机制及信号通路,首次提出了糖尿病泛血管疾病的理念及防治策略。

糖尿病血管病变常被分为大血管病变和微血管病变。由于血流动力学、血管结构及受累细胞的不同,大、微血管病变病理表现存在差异。大血管病变以动脉粥样硬化为主,表现为巨噬细胞泡沫化、内皮细胞损伤以及平滑肌细胞损伤。微血管病变包括初级小动脉和小静脉之间血管内皮损伤、血管基底膜增厚、微血栓形成、血小板和红细胞粘连聚集、微循环障碍。另一方面,能量代谢状态的差异,以及不同靶器官的器官特异性生长因子或细胞因子也是造成血管病变差异的重要因素。多数靶器官(心、脑、外周血管)同时受到糖尿病大血管病变和微血管病变的影响;视网膜和肾脏主要受微血管病变的影响(图1)。
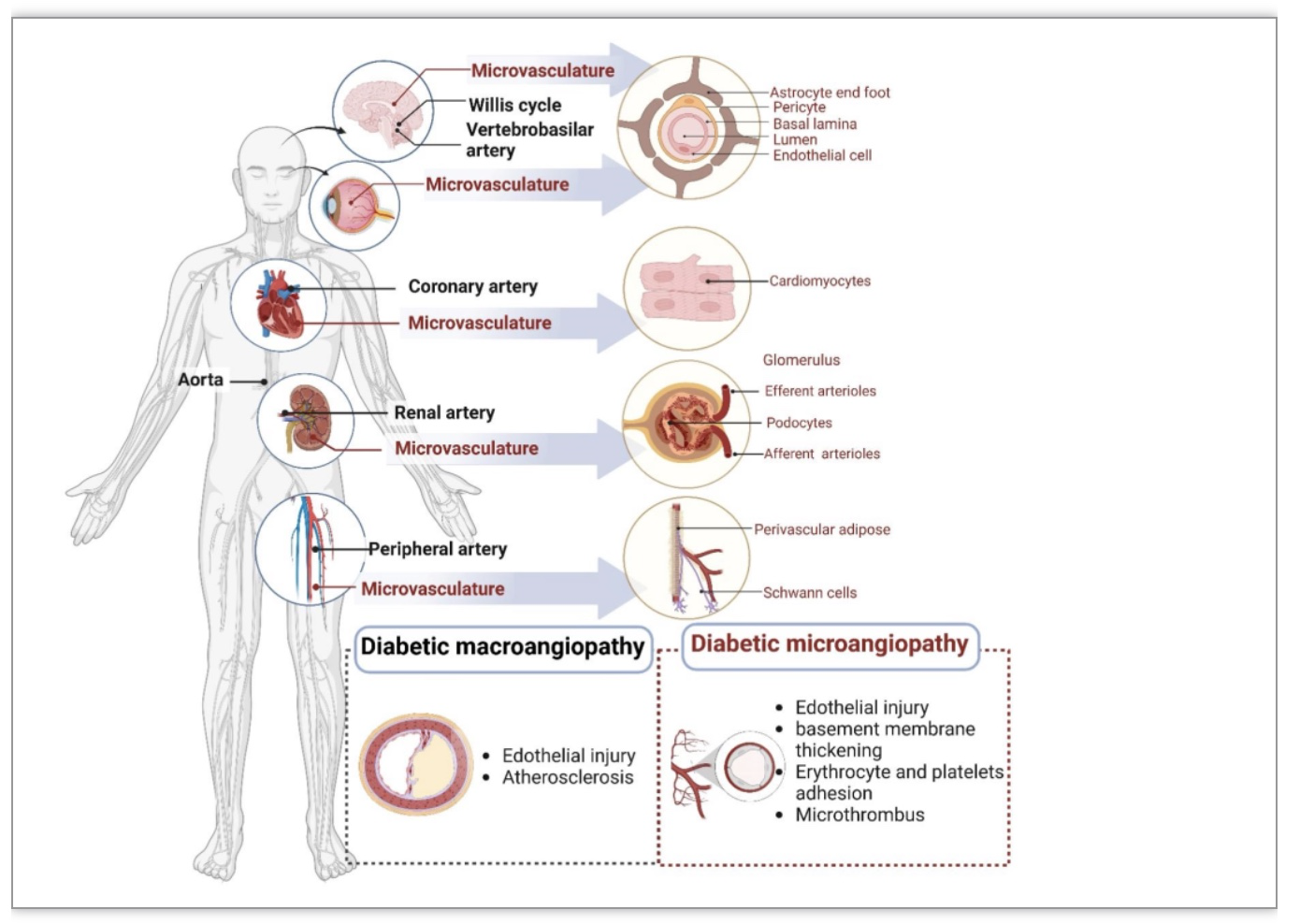
图1. 糖尿病泛血管病变示意图
(图源:Li YW, et al. STTT, 2023)
糖尿病心脏病(Diabetic heart disease, DHD)包括糖尿病继发的各种心血管疾病,如冠状动脉疾病和心肌病等(图2)。在临床中,二者经常合并出现并导致心血管疾病患者的不良结果和死亡风险。影响DHD的最主要病变是与动脉粥样硬化及心肌病变,前者主要涉及高糖对巨噬细胞、内皮细胞的影响。糖尿病促进心肌病变的机制在近年备受关注,尤其是因心脏代谢异常、糖/脂毒性以及线粒体功能异常引起的氧化应激、炎症、晚期糖基化终产物(AGEs)增加。较为独特的是,心肌能量和氧需求高,脂肪酸β氧化和葡萄糖有氧氧化是正常心脏代谢能量的主要来源,糖脂代谢异常可以影响心肌的脂肪酸氧化过程,促进内质网应激、氧化应激、自噬、凋亡和炎症,引起心室重构。糖尿病心血管患者基本药物治疗包括抗血小板治疗、降胆固醇治疗、RAAS抑制剂、抗心肌缺血治疗。新型降糖药物(钠-葡萄糖共转运蛋白-2(SGLT-2)抑制剂、胰高血糖素样肽-1(GLP-1)受体激动剂、二肽基肽酶Ⅳ(DPP4)抑制剂等)在糖尿病心血管疾病中的作用备受关注。
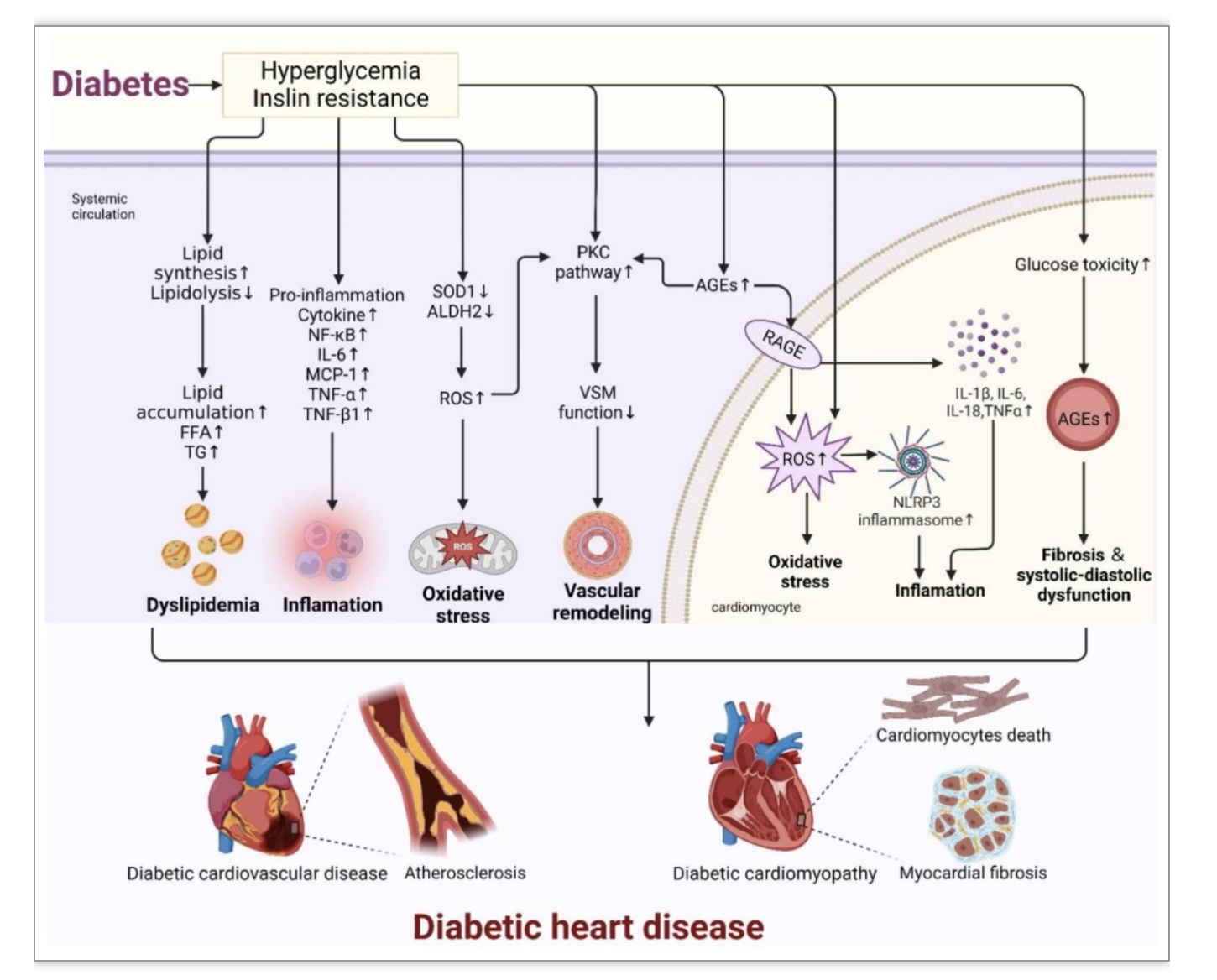
图2. 糖尿病心脏病机制图
(图源:Li YW, et al. STTT, 2023)
糖尿病可损伤包括脑大血管及微血管在内的多级血管、破坏血脑屏障的完整性、促进神经退行性变,造成糖尿病脑病(Diabetic encephalopathy, DE)(图3)。糖尿病状态下脑血管内皮生长因子(VEGF)和内皮素一氧化氮合酶(eNOS)的表达降低,损害大脑动脉内皮功能,导致血管自我调节反应降低,血小板聚集障碍和炎症可减少脑血流量。以上因素导致糖尿病大、微血管病变的相互影响。中枢神经系统高度依赖葡萄糖提供能量,糖尿病可引起颅内能量代谢失衡,促进病变发展。同时,高血糖刺激炎症信号和自适应信号,加速颅内内质网应激和线粒体功能障碍。此外,谷氨酸是中枢神经系统中关键的兴奋性神经递质,谷氨酸受体在DE中影响神经元功能和突触可塑性。治疗上,二甲双胍、吡格列酮及GLP-1受体激动剂等可进入血脑屏障,在DE的治疗中较为重要。在非降糖药物中,磷酸二酯酶III型抑制剂西洛他唑能改善氧化应激,调节脑血管损伤。N-甲基-D-天冬氨酸(NMDA)受体激动剂、神经营养因子、线粒体功能调节剂也在开发中。
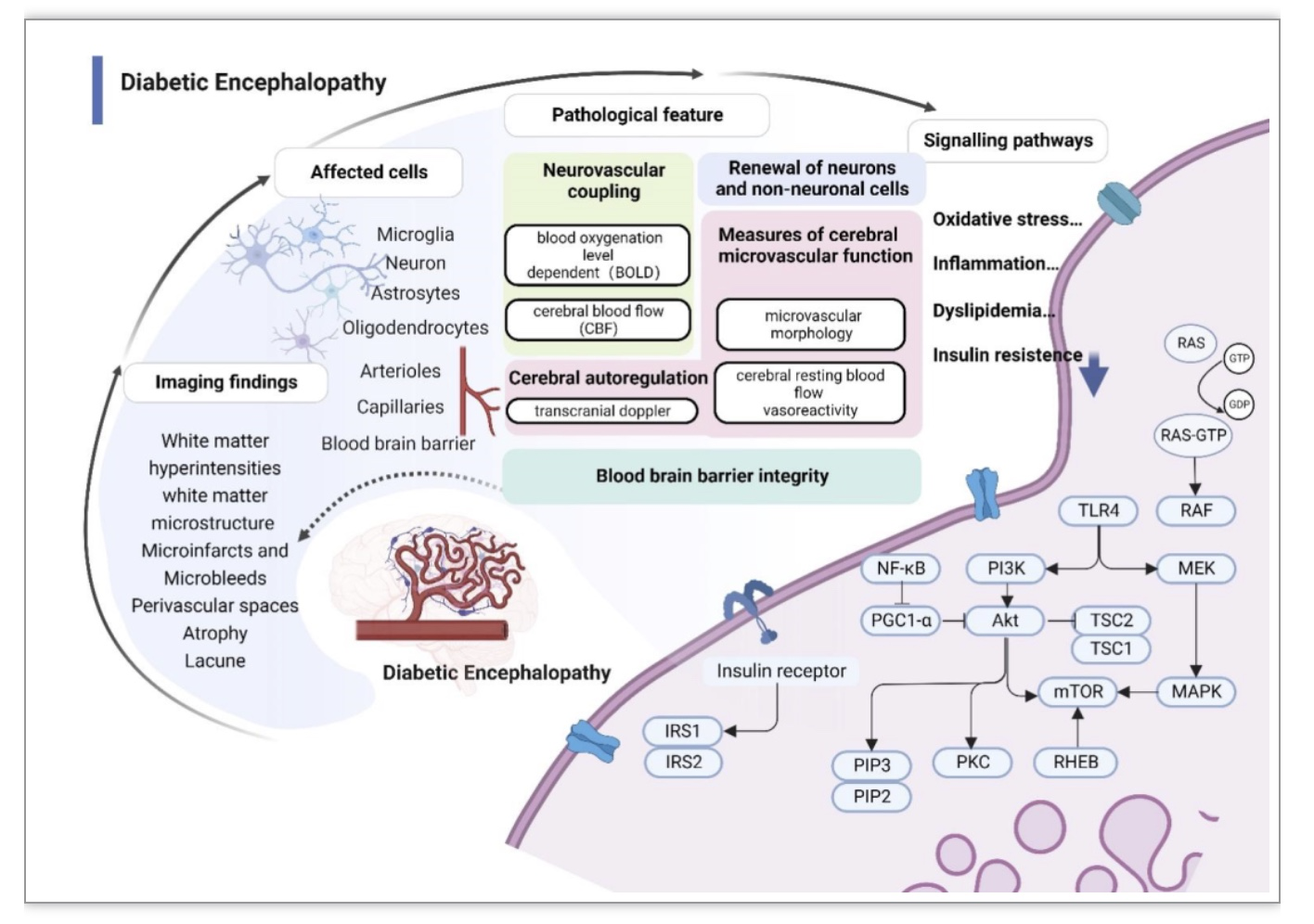
图3. 糖尿病脑病机制图
(图源:Li YW, et al. STTT, 2023)
3.糖尿病肾病
糖尿病肾病(Diabetic kidney disease, DKD)是以肾小球肥大、基底膜增厚和肾脏血管内皮细胞损伤等为特征的微血管并发症(图4)。肾脏血管系统复杂,包括肾动脉及其分支、肾小球和肾小管周围毛细血管网络等,是维持肾功能正常的基础。新型DKD生物标志物包括TNF-α受体、细胞间黏附分子1(ICAM-1),内皮抑素(Endostatin)、和肽素(Copeptin)、肾损伤分子 1 (KIM-1)、单核细胞趋化蛋白 1 (MCP-1)、中性粒细胞明胶酶相关脂质运载蛋白等。DKD疾病进展机制包括促血管生成因子和抗血管生成因子之间的失衡等。例如高血糖通过RAAS介导的血管紧张素Ⅱ增加可升高肾小球毛细血管压力,损伤血管。内皮生长因子A(VEGFA)、炎症介质(趋化因子、细胞因子和黏附分子)等也是DKD中重要的分子机制。目前针对DKD的治疗主要为控制血糖、血压及阻断RAAS。JAK蛋白酪氨酸激酶家族抑制剂Baricitinib、血管黏附蛋白-1(VAP-1)抑制剂ASP8232、肠道菌群以及中医药黄葵胶囊等在未来DKD治疗中具有重要作用。多靶点、多药物联合治疗在未来有希望延缓甚至逆转DKD的进展。
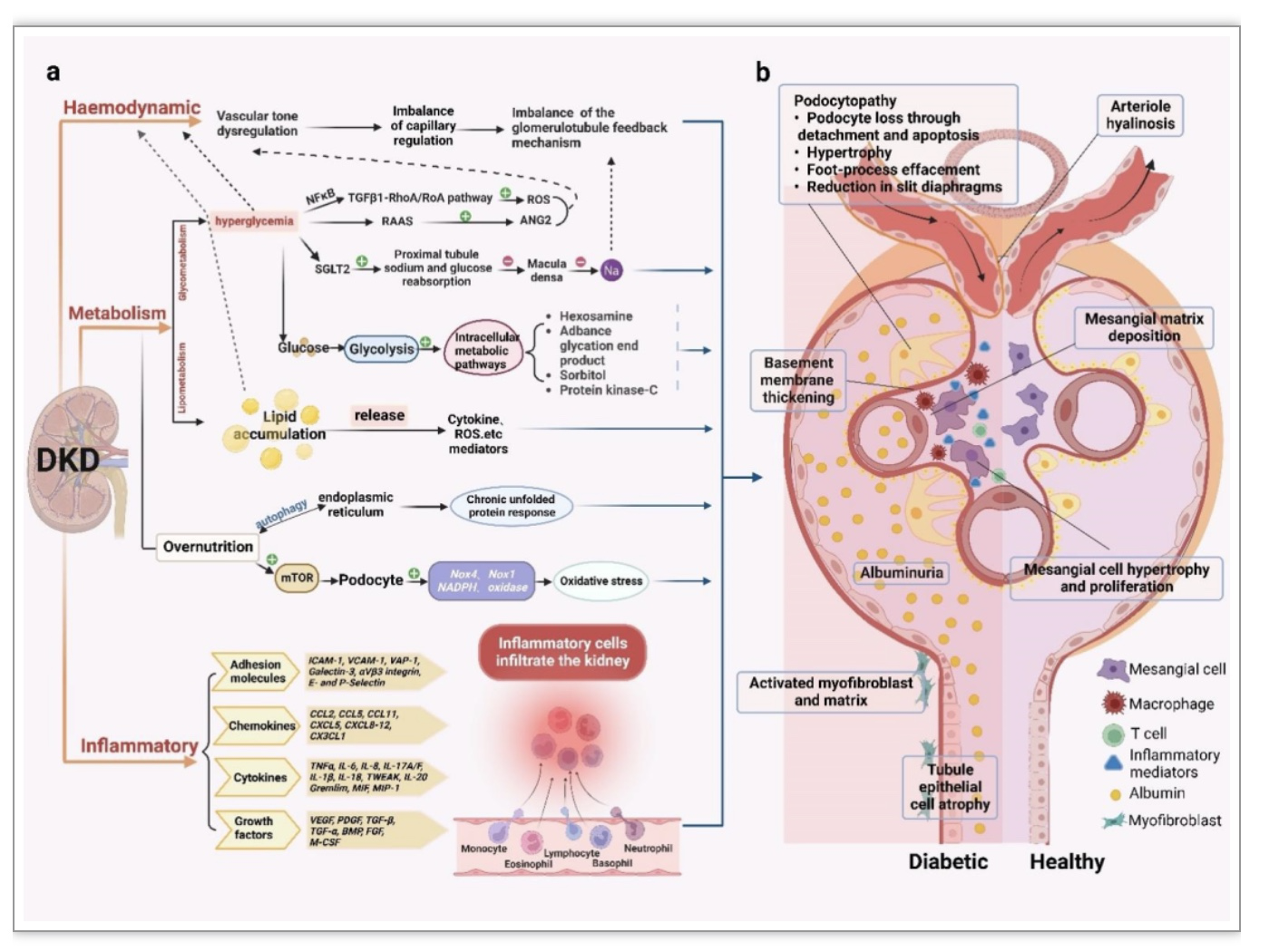
图4. 糖尿病肾病机制图
(图源:Li YW, et al. STTT, 2023)
4.糖尿病视网膜病
糖尿病视网膜病变(Diabetic retinopathy, DR)是由于慢性高血糖引起的全身代谢障碍在眼部的表现,是糖尿病最常见的微血管并发症之一。组学、人工智能的发展,其在疾病的风险评估、早期诊断和治疗方面发挥了重要作用。例如同型半胱氨酸(Hcy)、VEGF、视黄醇结合蛋白3(RBP3)、miRNA(miR-146a、miR-21、miR-34a、miR-125a-5p)是DR潜在的生物标记物。同时利用图像识别和深度学习的方法对视网膜切片进行识别,可识别神经节细胞和神经纤维层的变化,用于诊断早期视网膜病变;基于人工智能的方法定量评价DR,发现DR与神经递质异常密切相关。高血糖可促进炎症反应、氧化应激反应、AGEs增加、VEGF增加,使视网膜通透性增加,视网膜血流动力学发生改变,导致视网膜渗漏,发展为DR。目前DR治疗以激光光凝治疗和玻璃体注射抗体药物为主。除降糖药物外,雷珠单抗、阿柏西普、非诺贝特等药物对DR的治疗作用也在被积极探索中。
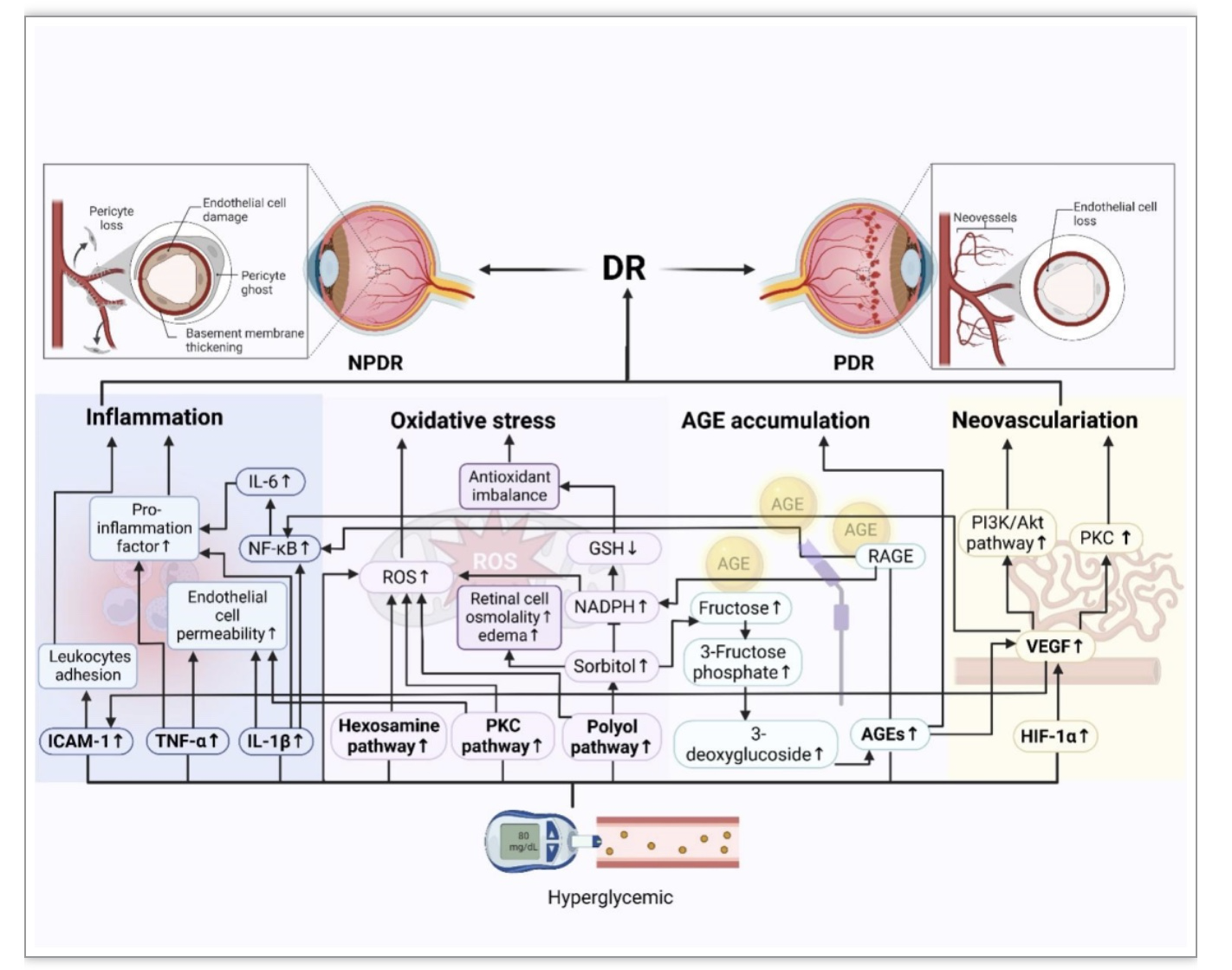
图5. 糖尿病视网膜病变机制图
(图源:Li YW, et al. STTT, 2023)
5.糖尿病外周血管病
糖尿病外周血管病(Diabetic peripheral vasculopathy, DPVD)常被忽视,却是2型糖尿病患者最重要和最常见的血管并发症之一。DPVD包括大、微血管病变,病理机制与其他血管病变高度重叠。IL-6、超敏C反应蛋白、脂蛋白相关磷脂酶A2、高分子量脂联素生物标记物等可提示DHD以及DPVD风险。能量代谢异常、炎症、氧化应激、胰岛素抵抗、AGEs、VEGF以及糖代谢的多元醇途径、己糖胺途径和蛋白激酶C(PKC)途径激活均参与DPVD进展。护理和生活方式控制在DPVD治疗中占有重要地位,与其他血管病变的预防措施有较大差异。正常血糖或接近正常的血糖控制是一个首要的治疗目标,新型降糖药物(SGLT-2抑制剂、GLP-1受体激动剂、DPP4抑制剂)的使用可能较传统降糖药物有更多血管获益。
在糖尿病小鼠(C57BL/6)中,在糖尿病病程4-20周时出现微血管病变,不同器官的微血管病变多集中在8-10周出现;小鼠糖尿病大血管病变不能通过糖尿病造模后自发形成,一般在糖尿病模型上予以特殊饮食控制或血管闭塞。因此目前缺乏同期制造糖尿病大、微血管病变模型并观察DPDs的研究(图6)。
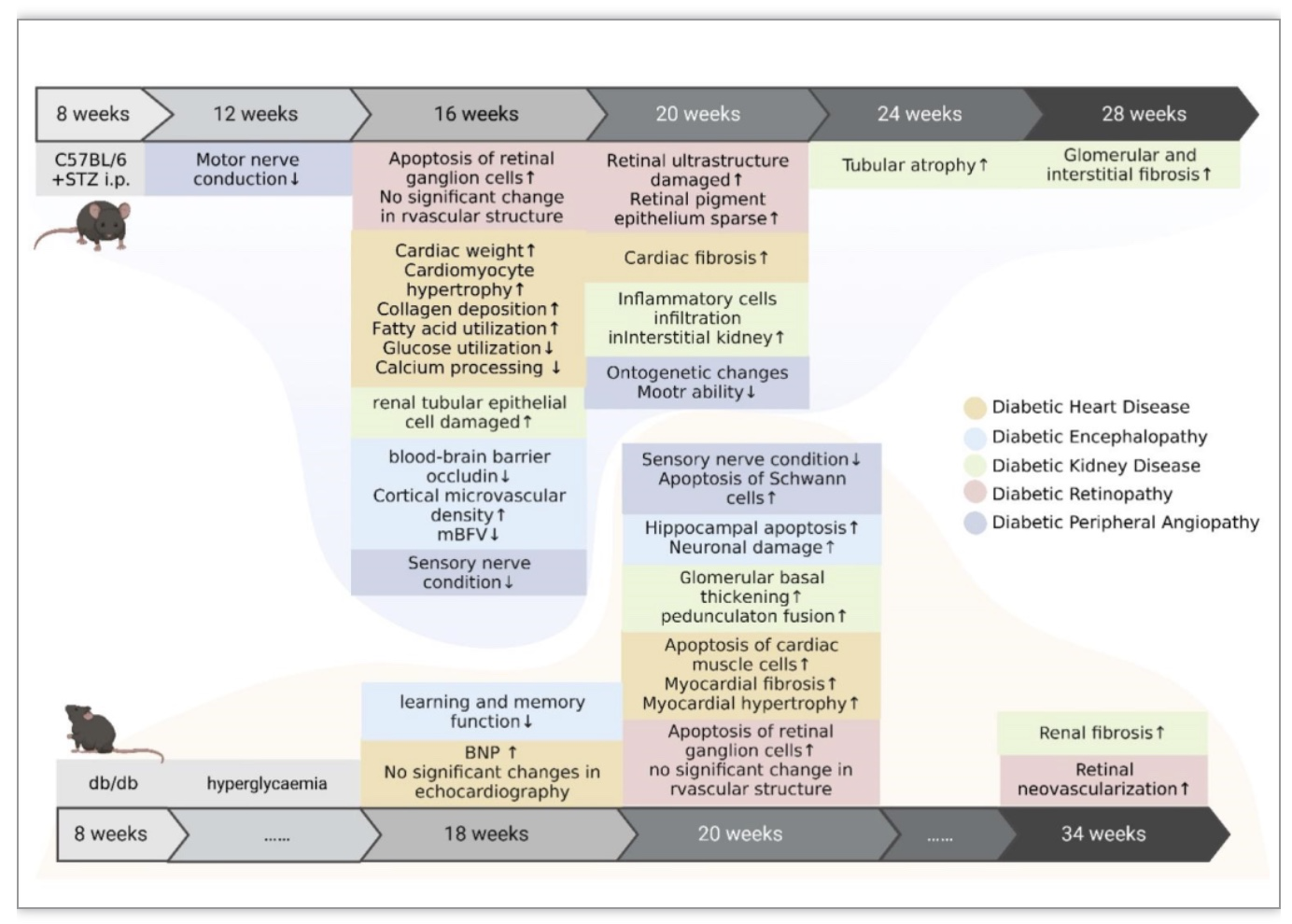
图6. 模型动物中糖尿病泛血管病变时间进程
(图源:Li YW, et al. STTT, 2023)
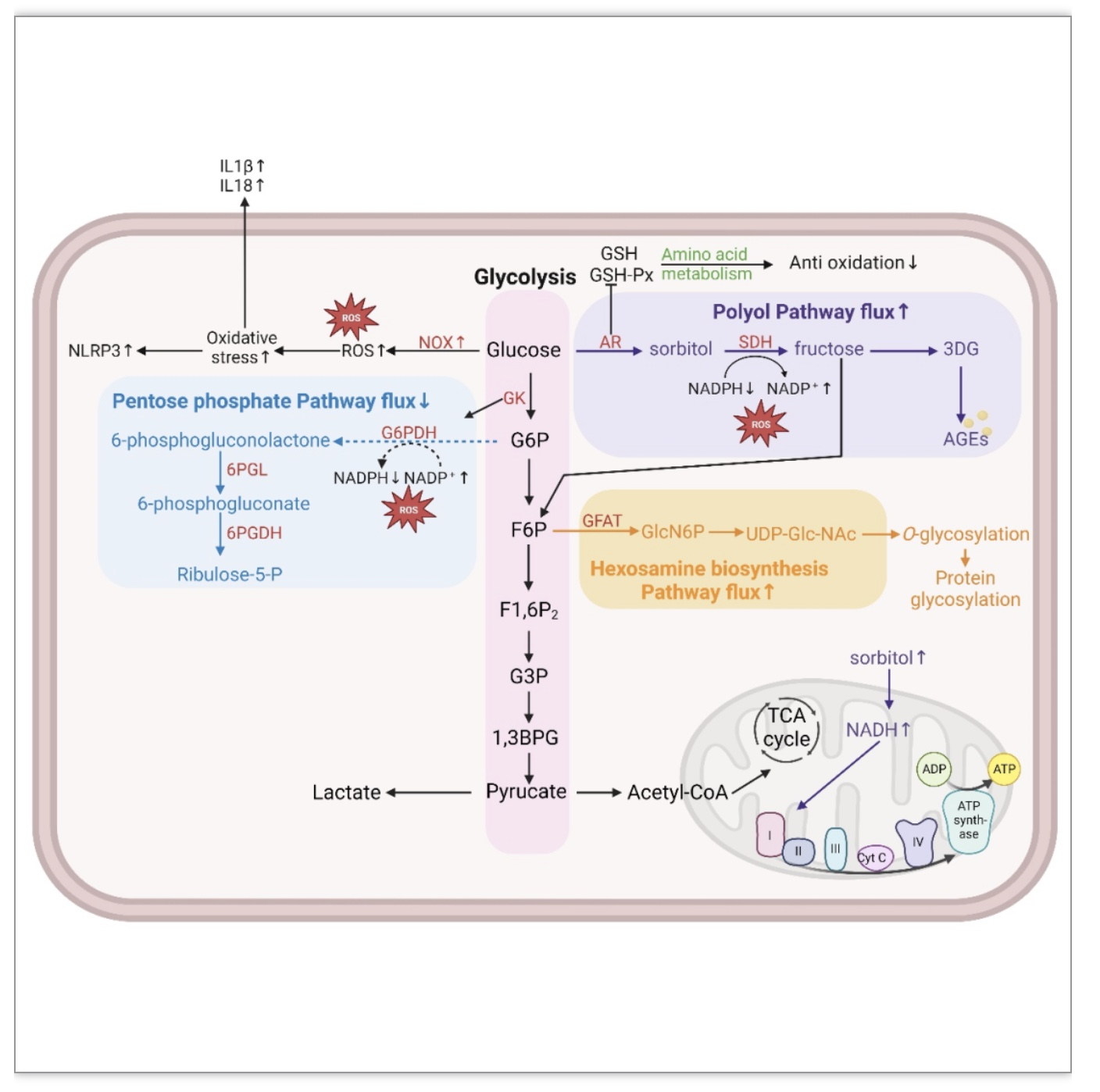
图7. DPDs中的细胞糖代谢通路
(图源:Li YW, et al. STTT, 2023)
DPDs研究面临若干挑战。不同学科对糖尿病及血管病变的管理各有侧重,也很难同时关注不同器官血管病变的特点。在同一新技术下可能产生大量科研结果的冗余,同一分子或信号通路在不同器官、不同病变时期中发挥的作用差异仍不明。在未来,一方面应该积极开发新的技术方法,丰富糖尿病泛血管病变的实验证据,如利用干细胞诱导分化技术构建人体“血管类器官”模型,或开展多组学研究等。另一方面应积极开展新的交叉学科综合防治模式,促进医疗机构、科研机构、学术组织之间交叉合作,减少科研成果、新技术与临床应用之间的鸿沟。各级医疗机构间交叉合作,充分整合初级诊疗与上级诊疗的资源;医生、护理人员与患者间交叉合作,保证患者的个性化诊疗;以及临床不同学科之间的交叉合作。中医药在糖尿病泛血管病变的防治中也表现出极大的潜力,期待未来建立具有中国特色的糖尿病泛血管疾病的综合防治体系,促进合作、加快临床转化,提升对重大慢病的整体防控能力。

