该工作解析了结核分枝杆菌特异性海藻糖转运体LpqY-SugABC处于前移位状态的冷冻电镜结构和底物结合蛋白LpqY与海藻糖及其五种衍生物的高分辨率晶体结构。结合底物促进的ATPase活性实验,该成果系统阐明了LpqY-SugABC识别底物的结构基础,并提出了干预LpqY-SugABC构象转变的抑制剂设计策略,为海藻糖衍生物在结核病领域的应用奠定了重要的基础。

结核病是由结核分枝杆菌感染引起的一类严重危害人类健康和公共卫生安全的传染性疾病,每年造成百万人的死亡和近千万人的感染。近年来耐药结核病出现和传播,加上COVID-19的大流行,使得当前结核病的防治难度仍然十分严峻。因此,亟需阐明与结核分枝杆菌感染和致病密切相关的关键蛋白质复合物的功能机制,为抗结核新药和新型检测技术的研发提供理论基础和科学依据。
复杂且致密的细胞壁是结核分枝杆菌的典型特征,它是病原体抵抗环境压力、免受抗生素杀伤和逃避宿主免疫反应的天然屏障。海藻糖在结核分枝杆菌细胞壁的合成中扮演关键的角色,它是分枝菌酸(细胞壁核心成分)合成前体海藻糖单分枝菌酸酯(trehalose monomycolate,TMM)和参与免疫逃逸重要糖脂索状因子(trehalose dimycolate,TDM)以及硫脂(sulfolipid-1, SL-1;sulfoglycolipids,SGLs)等的核心骨架。结核分枝杆菌除通过自身合成关键营养源海藻糖外,还可以直接摄取环境中的海藻糖,而ABC 内向转运系统 LpqY-SugABC是其摄取的唯一通道。先前,饶子和/张兵团队解析了耻垢分枝杆菌LpqY-SugABC四种不同功能状态的冷冻电镜结构,揭示了海藻糖跨膜转运的交替访问机制(Liu et al., Science Advance, 2020)。然而,对于病原体中该转运体如何特异性识别海藻糖及其衍生物的认识仍然不是很清楚。
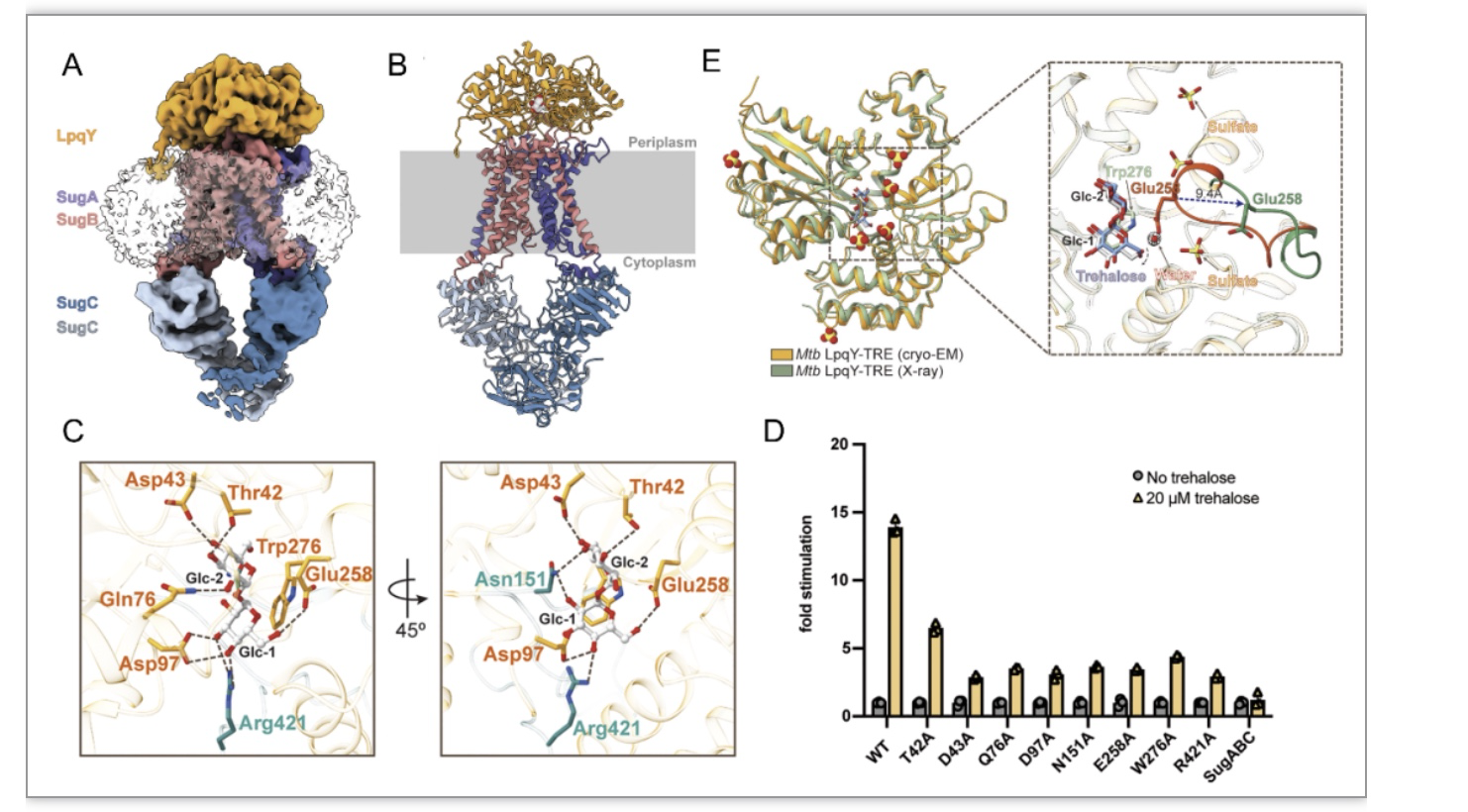
在本工作中,研究团队运用单颗粒冷冻电镜技术首次解析了结核分枝杆菌LpqY-SugABC结合海藻糖的冷冻电镜结构(图1A和1B)。复合物结构揭示了结核分枝杆菌LpqY中海藻糖的精确结合位点,分析发现海藻糖通过广泛的氢键网络被牢牢的锁在结合口袋中,且海藻糖中所有的羟基都参与氢键的形成(图1C)。底物刺激的ATPase活性分析,进一步明确了LpqY结合口袋中参与海藻糖识别和结合的关键氨基酸(图1D)。有趣的是,研究团队还解析了单独LpqY与海藻糖高分辨率的晶体结构,相较于冷冻电镜结构,由于晶体结构中位于底物结合口袋附近结合了结晶池液中的硫酸根离子,导致该结构中参与海藻糖配位的258位天冬氨酸所在的Loop发生了较大的构象变化(图1E),结果海藻糖中毗邻该Loop的一个葡萄糖部分的6位羟基具有更大自由度,发生了约80°的旋转,这也暗示该位置可能具有容纳更大官能团的潜力。
图1. 结核分枝杆菌LpqY-SugABC结合海藻糖的三维结构。(A)LpqY-SugABC结合海藻糖的电子密度图;(B)LpqY-SugABC结合海藻糖结构的卡通图;(C)LpqY中海藻糖的结合位点;(D)LpqY中底物结合位点突变对ATPase活性的影响。
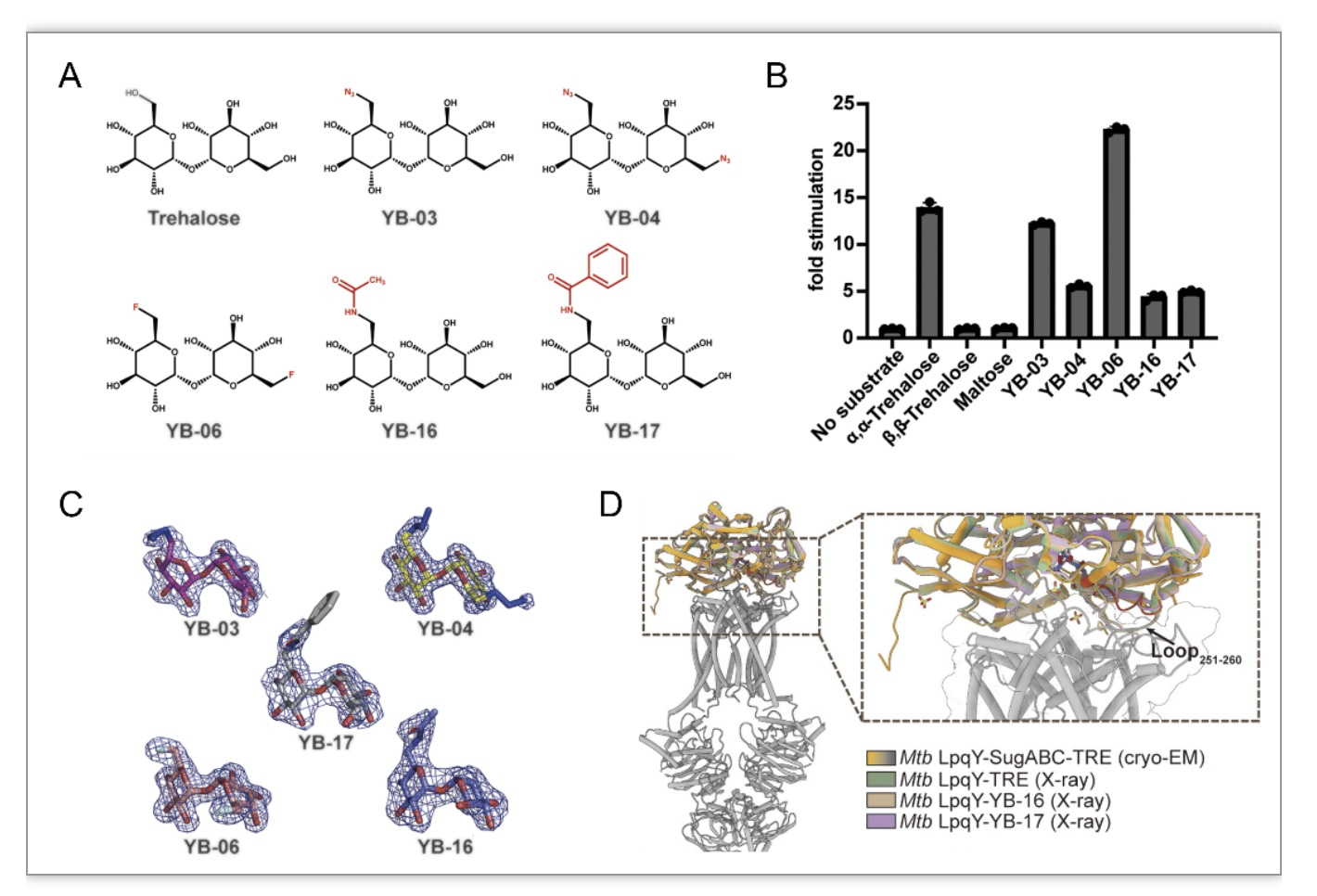
随后研究团队合成了多个海藻糖衍生物(图2A),进一步探究LpqY-SugABC对它们的识别和结合。研究结果表明,随着葡萄糖部分单6位羟基替换成其它更大的官能团后,虽然增加了化合物与LpqY的亲和力,但对LpqY-SugABC的ATPase活性的刺激却反而降低(图2B)。衍生物与LpqY的晶体结构表明(图2C),替换的官能团都位于258位天冬氨酸所在的Loop附近,从而诱导该Loop呈现出类似硫酸根离子存在的构象。通过与结合海藻糖的LpqY-SugABC冷冻电镜的结构比较,推测LpqY中258位天冬氨酸所在的Loop的构象变化会影响转运周期中前移位状态LpqY-SugABC的稳定,继而影响后续底物的转运(图2D)。值得注意的是,结核分枝杆菌中重要糖脂合成都是从葡萄糖部分的6位羟基上起始的。因此,基于6位羟基设计的海藻糖衍生物具有阻断LpqY-SugABC功能或影响某些重要糖脂合成的潜力。
图2. 结核分枝杆菌LpqY-SugABC对海藻糖衍生物的识别和结合。(A)设计和合成的海藻糖衍生物的化学结构;(B)海藻糖衍生物对LpqY-SugABC ATPase活性的影响;(C)晶体结构中海藻糖衍生物的密度;(D)LpqY晶体结构与电镜结构的比较。
总之,这项工作首次阐明了结核分枝杆菌LpqY-SugABC识别海藻糖及其衍生物的分子机制,揭示了LpqY可塑性的底物结合口袋,为海藻糖类抑制剂的设计奠定了重要的结构基础。