人类基因组中将近50%的序列为转座子,其中长散布元件LINE-1转座子占比最高,在人类基因组中有>50万个拷贝。LINE-1是人类基因组中唯一具有自主转座活性的转座子,经由转录-逆转录完成转座周期,可破坏或影响插入位点基因结构和表达,影响细胞功能与命运,与生物进化息息相关[1-3]。然而近年来,研究人员发现肿瘤细胞中常出现LINE-1表达失调或异常转座事件,可能与肿瘤发生发展有关。已知衰老、炎症等生理因素可诱发LINE-1表达失调,近期研究提示,病毒感染可能是转座子表达失调的一种新型病理因素,是否与病毒感染相关肿瘤疾病有关至今不清。

Epstein-Barr virus(EBV)是一种双链DNA致癌病毒,EBV感染与多种淋巴瘤、鼻咽癌和部分胃癌相关,其中最常见的EBV相关肿瘤是EBV相关的胃癌(EBVaGC)。EBVaGC是一种具有独特分子特征的临床胃癌亚型,约占所有胃癌病例的10%,然而EBV感染对该亚型胃癌发生发展的作用机制仍不清楚。研究人员以EBVaGC作为EBV感染相关肿瘤模型,研究EBV感染对LINE-1转座子表达的影响。该研究首先比较了EBVaGC与EBV阴性胃癌(EBVnGC)的RNA-seq数据,发现LINE-1在EBVaGC中总体转录下调。进一步对逐个LINE-1拷贝的表达分析发现,进化年龄偏年轻、序列长度为全长的LINE-1亚群被显著抑制,表明EBVaGC中具有转座潜力的LINE-1亚群被选择性地抑制。
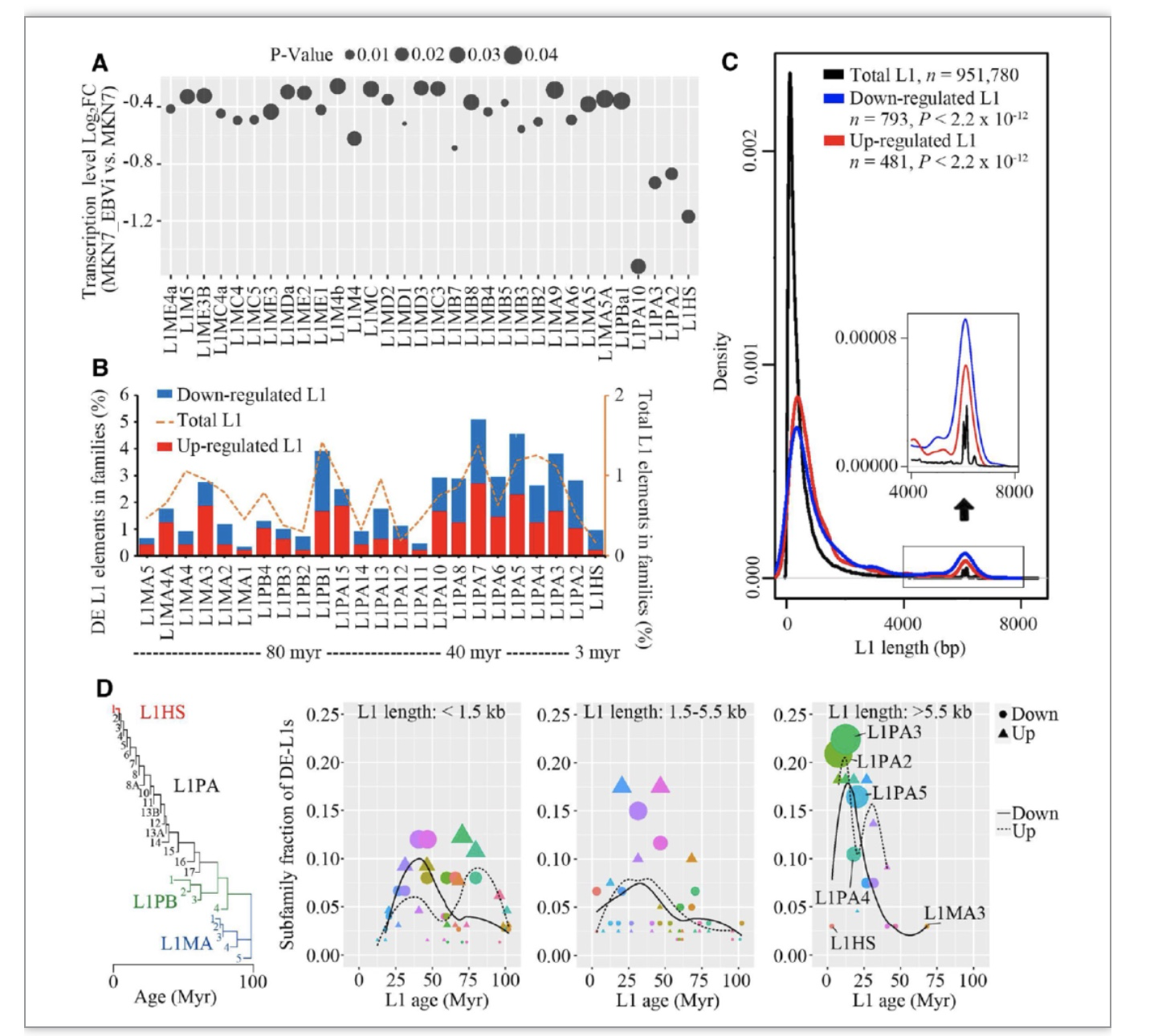
图1. 年轻全长的LINE-1亚群转录被选择性地抑制
(图源:Zhang, et al., Nucleic acids research, 2023)
为了探讨LINE-1表达受抑制的分子机制,研究人员进一步分析了LINE-1上的组蛋白修饰,发现年轻全长的LINE-1上抑制性组蛋白H3K9me3修饰水平显著升高,尤其是被人类沉默复合物(HUSH)核心蛋白TASOR绑定的LINE-1亚群。HUSH是一种新型表观遗传复合体,由TASOR、MPP8和PPHLN1三个蛋白组成,近期研究发现HUSH特异性地抑制人类细胞基因组中转座子LINE-1的表达,尤其是位于内含子区域、进化年龄偏年轻、序列长度为全长的LINE-1,HUSH招募组蛋白甲基转移酶SETDB1对这些LINE-1上的组蛋白进行H3K9me3修饰,致使转座子沉默。为了证实HUSH复合物在EBVaGC这种特殊肿瘤类型中的作用,研究人员在天然EBV感染的胃癌细胞系SNU-719中,利用siRNA抑制MPP8、PPHLN1或TASOR表达,发现皆能促进LINE-1表达,表明HUSH复合物很可能参与EBVaGC中LINE-1的H3K9me3修饰并且抑制LINE-1表达。
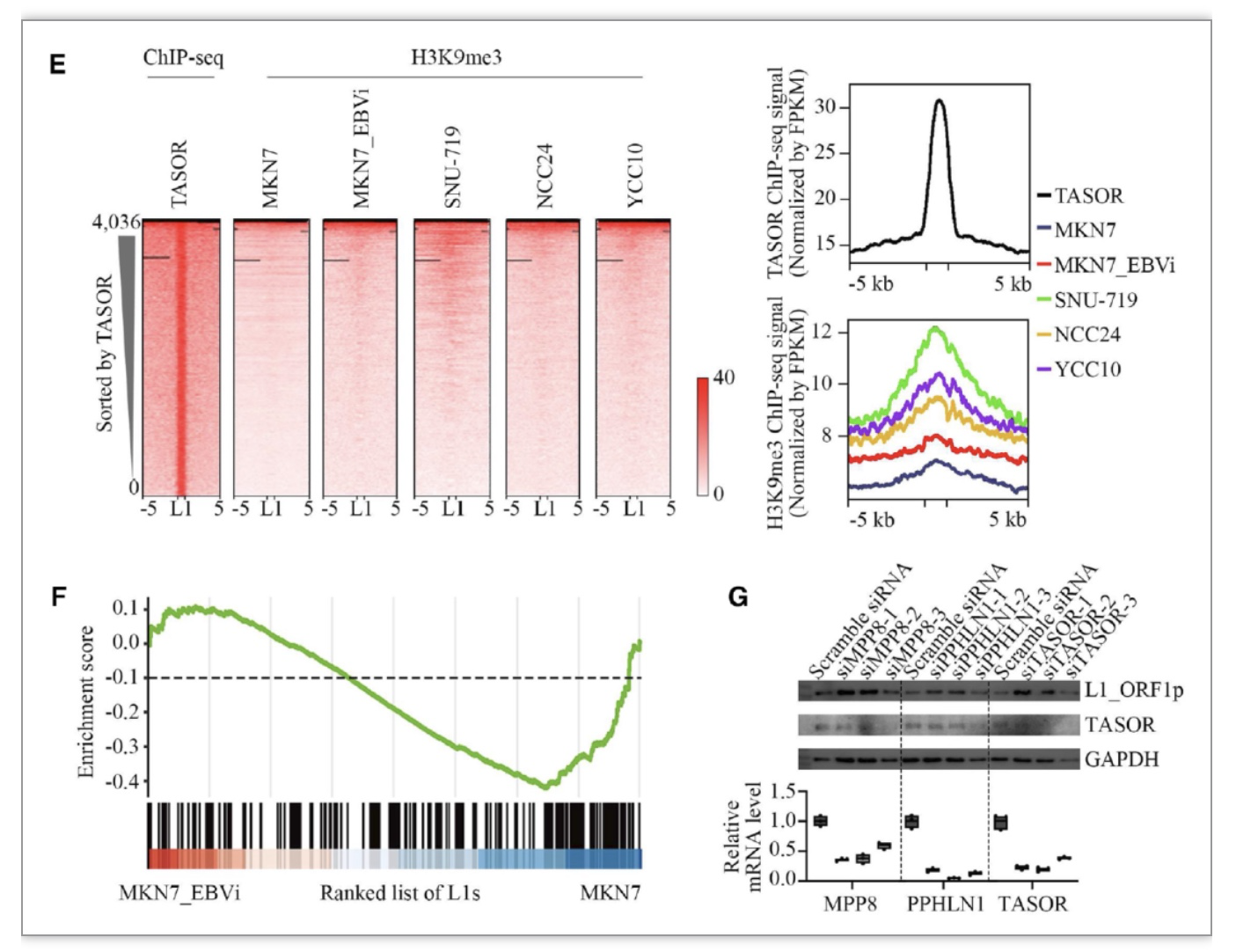
图2. HUSH复合物介导EBVaGC中LINE-1的H3K9me3修饰及LINE-1表达抑制
(图源:Zhang, et al., Nucleic acids research, 2023)
随后研究人员分析了EBVaGC中HUSH复合物各组分表达情况,发现相较EBVnGC,核心蛋白TASOR在EBVaGC中呈现高表达,并利用多组学数据交叉分析,结合ChIP-seq和HiC-seq数据对TASOR编码基因区的组蛋白修饰和基因组三维构象进行分析,发现EBVaGC中TASOR启动子与增强子之间相互作用增强,最后结合4C-seq数据分析了EBV病毒基因组与宿主基因组相互作用位点,发现EBV基因组黏附于TASOR基因编码区附近,提示EBV-宿主基因组相互作用可能是导致TASOR基因编码区三维空间构象改变及TASOR表达增强的诱因。
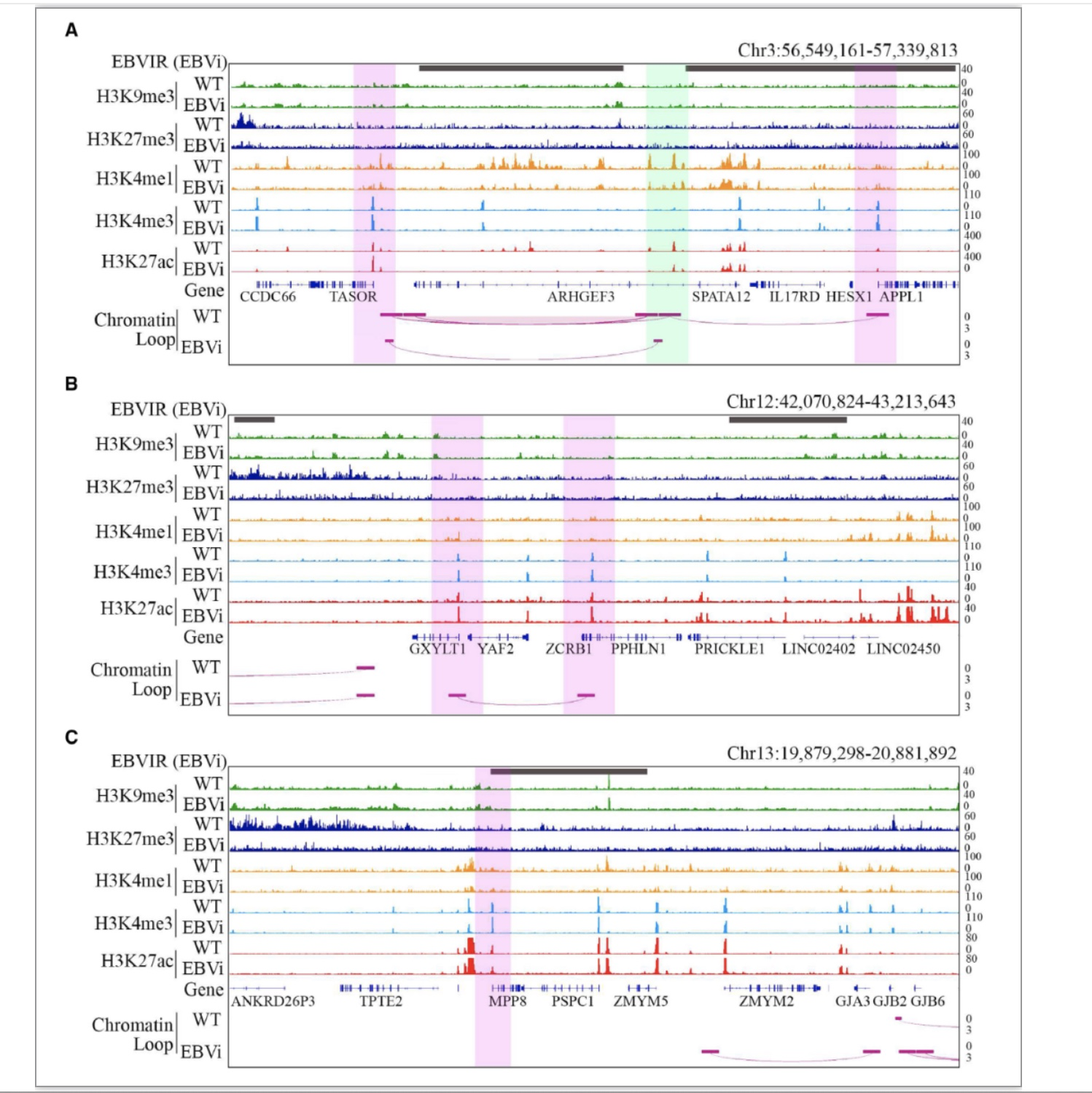
图3. HUSH复合物组成蛋白编码区组蛋白修饰及基因组三维构象分析
(图源:Zhang, et al., Nucleic acids research, 2023)
通过上述分析,该研究得出以下结论,EBVaGC中病毒基因组黏附于HUSH复合物核心蛋白TASOR基因编码区附近,导致TASOR增强子和启动子之间相互作用增强,引发TASOR高表达,促进HUSH复合物形成,在内含子区年轻全长的LINE-1上沉积,抑制LINE-1转座子表达。这些结果说明EBV可以通过和宿主基因组的相互作用影响宿主细胞中转座子调控因子的表达,从而影响转座子表达。
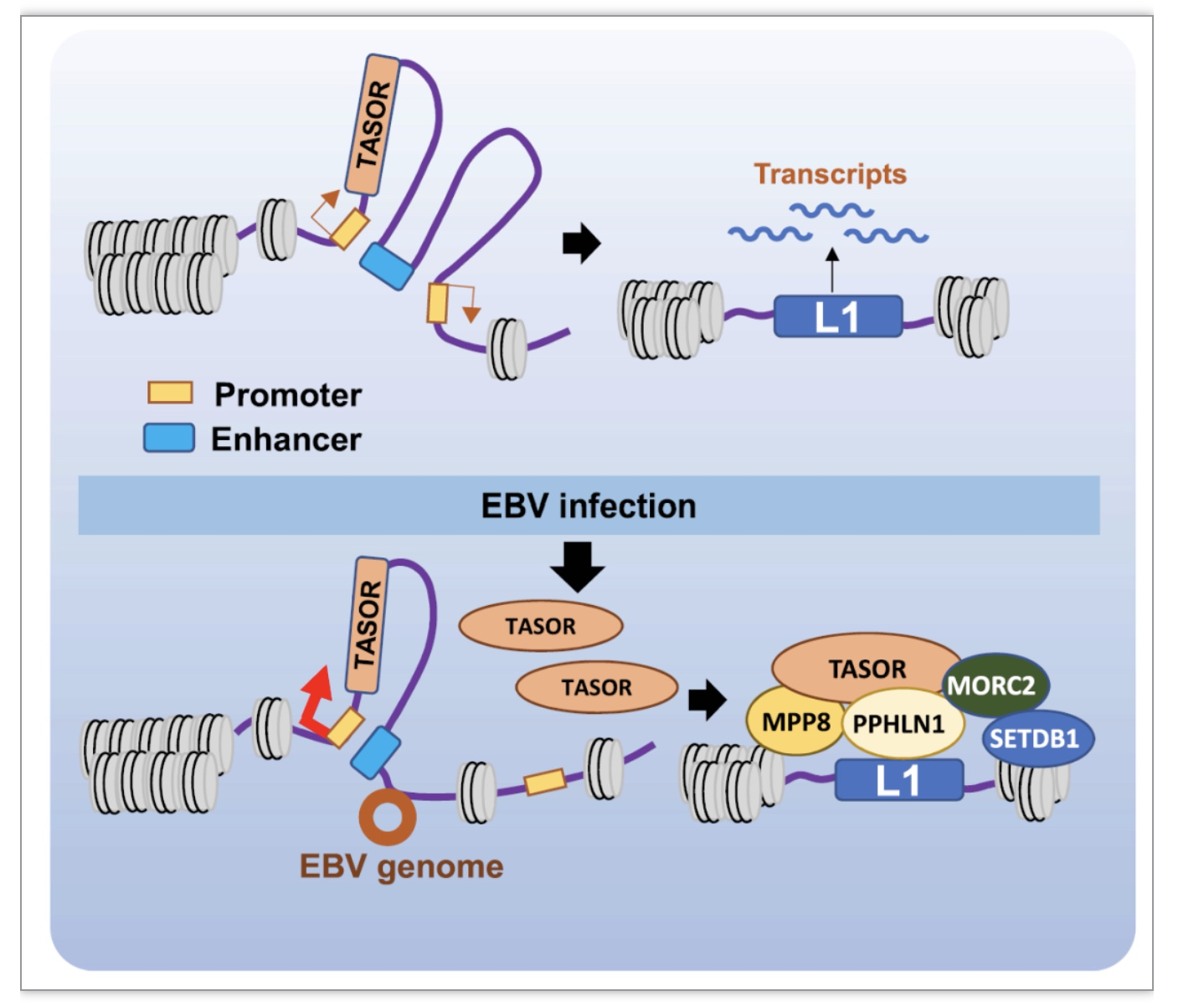
图4. EBV病毒-宿主基因组相互作用影响LINE-1表达的分子机制
(图源:Zhang, et al., Nucleic acids research, 2023)

