临近诱导(induced proximity)在近年来被认识到是调控细胞进程的核心原则。其中,化学诱导临近(chemically induced proximity,CIP)或化学诱导二聚化(chemically induced dimerization,CID)是基于临近诱导原理而开发出来的最重要的调控细胞进程的技术之一,CIP/CID方法利用可穿膜的双功能化学小分子诱导两个蛋白临近互作进而调控细胞进程,这种方法已经被广泛应用于调控细胞信号级联、蛋白的降解、基因的表达和编辑,乃至应用于细胞治疗[1-2]。现今广泛应用的CIP系统主要有雷帕霉素(rapamycin,Rap)系统、脱落酸系统((+)-abscisic acid,ABA)、赤霉素(GA3AM)系统等等,CID系统包括以TMP-Cl为骨架的二聚化系统等[3,4]。例如,最为经典的rapamycin临近诱导体系利用Rap能同时结合FKBP12和FRB两个蛋白域而形成FKBP12∙Rap∙FRB三元复合物,将融合了FKBP12和FRB的蛋白拉到临近位置,进而激活相应的细胞进程。
由于CIP/CID体系不可避免地需要对靶标蛋白融合配体结合标签,对细胞遗传修饰,CIP/CID难以直接调控无配体识别的内源靶标,也难以发展成为药物,该临近诱导技术的发展遇到了严重的瓶颈。
该研究提出了以小分子偶联纳米抗体(SNACIP)作为新一代的CIP分子来实现临近诱导,解决了自上世纪90年代微管成核现象被发现以来,近30年未能开发出通过靶向微管成核过程抑制肿瘤增生药物的难题。


CIP临近诱导技术的新突破:SNACIP
为了解决传统CIP体系无法直接调控内源蛋白或无配体结合的靶标这一类难题,研究人员将CIP临近诱导技术、纳米抗体化学工程化技术、以及环状跨膜肽非内吞递送体系这三个近年来不同领域的创新性突破交叉融合,设计出小分子偶联纳米抗体临近诱导体系,即SNACIP(small molecule-nanobody conjugateinduced proximity)调控体系。其中纳米抗体是一种源于骆驼科的仅含有单链重链可变区的最小抗原识别片段(VHH),能直接结合内源靶标。此外,纳米抗体相对于传统抗体有更小的分子量,约15 kDa左右,因此具有更好的跨膜性。与小分子相比,纳米抗体具有很好的特异性和高亲和力。因此利用纳米抗体作为CIP分子的模块之一,可以扩展传统CIP的应用范围到直接调控内源靶标,以及无配体识别的靶标。另一方面,将小分子配体跟纳米抗体相偶联就可以实现临近诱导。但由于小分子偶联纳米抗体本身并不能很好地穿膜,研究人员通过二硫键引入环状跨膜肽,以实现非内吞快速跨膜(图1a)。这样SNACIP诱导剂进入细胞之后,二硫键在胞内还原性条件下被切断,释放掉环状跨膜肽,剩下的小分子偶联纳米抗体就可以在胞内诱导蛋白的临近互作,从而调控细胞进程,譬如信号转导等等(图1b)。
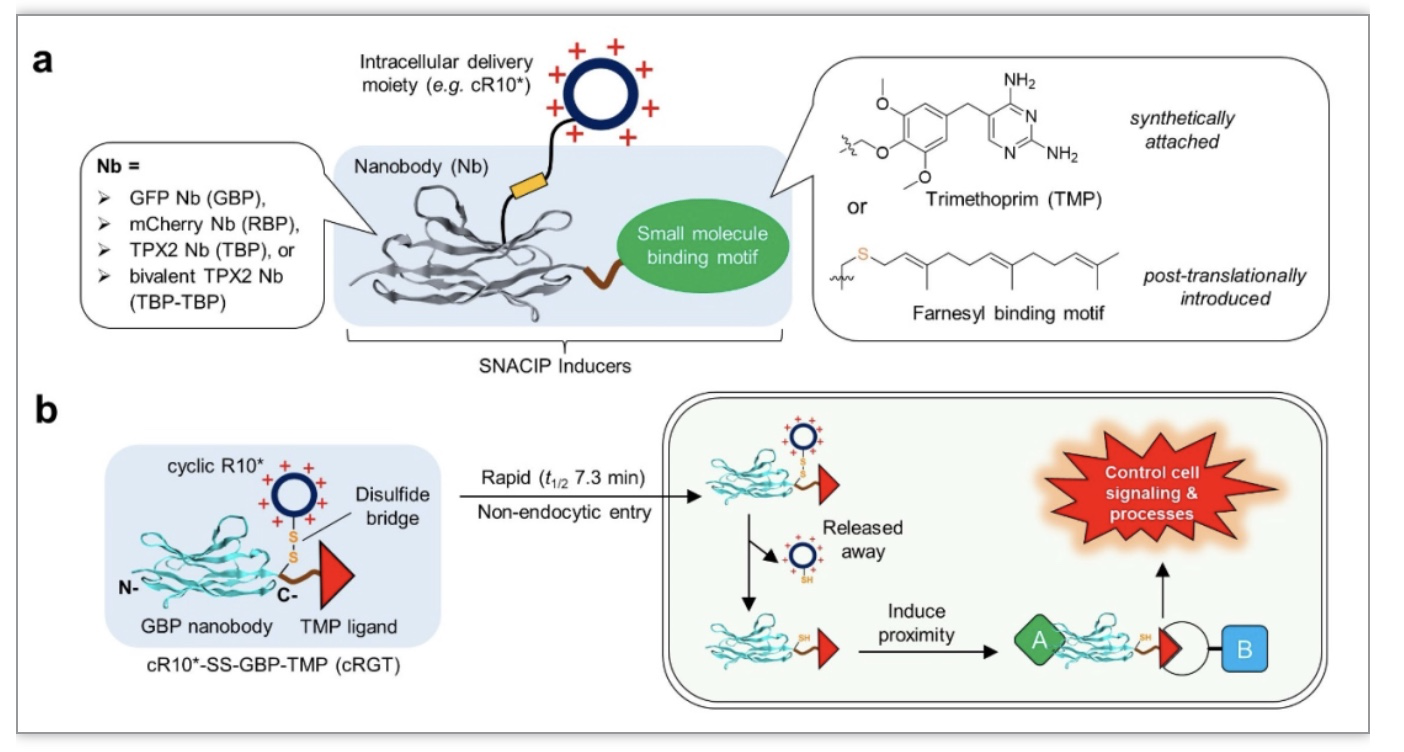
图1. SNACIP分子的结构元素以及其工作原理示意图
(图源:Sun, et al., Nat Commun, 2023)
由于环状跨膜肽的非内吞胞内递送是SNACIP成功的关键,研究人员首先研究了SNACIP分子跨膜的方式和机理。研究人员设计了一种新型的环状十精氨酸跨膜肽(cyclic decaarginine,cR10*),其N-端含有一个半胱氨酸,通过五聚甘氨酸 (Gly)5与cR10*相连(图2a),这个名叫Cys-cR10*的环状跨膜肽可以通过其N-端的半胱氨酸残基连在小分子偶联纳米抗体上。研究人员将一个SNACIP分子用荧光素标记,通过共聚焦显微镜发现SNACIP分子以非内吞的形式快速进入细胞(图2b-c)。研究也发现,进入细胞的SNACIP分子与内含体没有共定位,即便在内吞抑制剂丹酰尸胺或氯丙嗪的存在下,SNACIP分子也能快速进细胞,更进一步证明了SNACIP分子以非内吞的方式快速跨膜进入细胞。
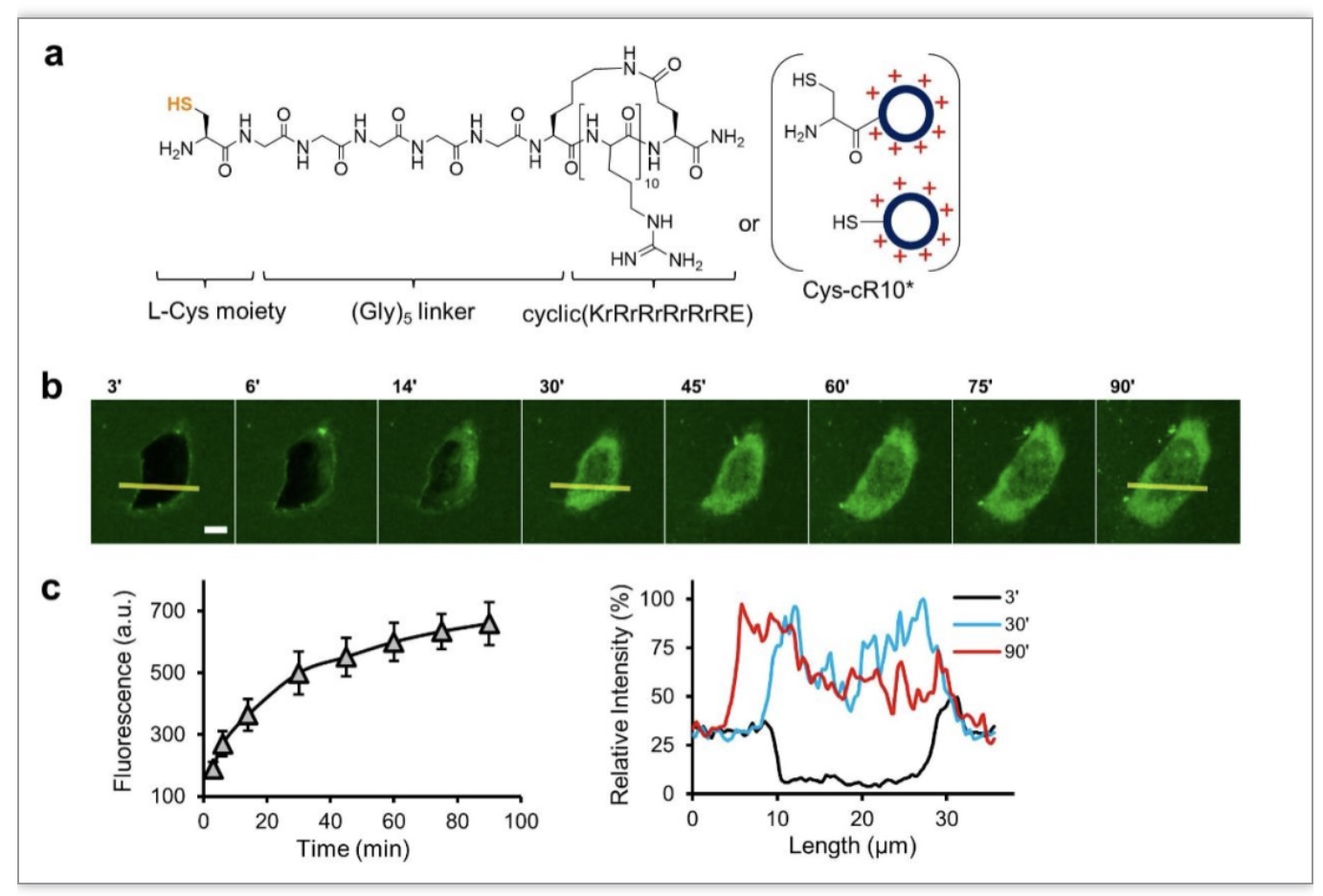
图2.环状跨膜肽cR10*的化学结构式及其以非内吞的方式高效胞内递送SNACIP
(图源:Sun, et al., Nat Commun, 2023)
在本论文中,研究人员设计了通用型的SNACIP分子cR10*-SS-GBP-TMP(cRGT),将EGFP的纳米抗体GBP(green fluorescent protein binding protein)与eDHFR的小分子配体甲氧苄啶trimethoprim(TMP)进行偶联,之后连接cR10*。cRGT跨膜后可以诱导EGFP和eDHFR所融合蛋白的临近互作。共表达了EGFP-mito(线粒体膜定位)和mCherry-eDHFR(胞浆分布)的细胞经过cRGT处理后,可以将胞浆中的mCherry-eDHFR定位到线粒体表面,形成EGFP∙GBP-TMP∙eDHFR三元复合物,说明cRGT可以诱导胞内EGFP和eDHFR的临近互作;再加入eDHFR的可逆抑制剂TMP后,这种临近效果消失,证明了cRGT还可以利用TMP进行可逆调控(图3a)。研究人员又进一步通过移位测试(translocation assay),即诱导胞质中mCherry所融合的蛋白定位到线粒体的程度作为衡量标准,将cRGT和雷帕霉素(Rap)、脱落酸(ABA)和赤霉素(GA3AM)这三种最先进的CIP体系进行比较,发现cRGT以剂量依赖的方式将mCherry所融合的蛋白定位到线粒体上,不会像Rap那样发生钩型效应(hook effect)、具有比ABA和GA3AM更大的动态范围,且能进行快速可逆调控(GA3AM难以可逆),显示了cRGT优越于其它CIP体系的特征(图3b)。

图3. cRGT能可逆的、剂量依赖的方式、高动态范围地诱导胞内二聚化,比其它CIP体系更具有优势
(图源:Sun, et al., Nat Commun, 2023)
铁死亡(Ferroptosis )作为一种铁依赖性的,区别于细胞凋亡、细胞坏死、细胞自噬的新型的细胞程序性死亡方式,是现今的生物学和生物医学领域的研究热点。靶向调控铁死亡也被认为可以解决肿瘤治疗中耐药性的问题[5]。在本实验中,研究人员通过cRGT诱导抗氧化的核心酶——谷胱甘肽过氧化物酶(GPX4)到过氧化物酶体临近区域而失活,诱导产生铁死亡,可以看到线粒体和细胞形态迅速变得异常(图4)。这提供了一种新的通过铁死亡通路而诱导癌细胞死亡的新方案。
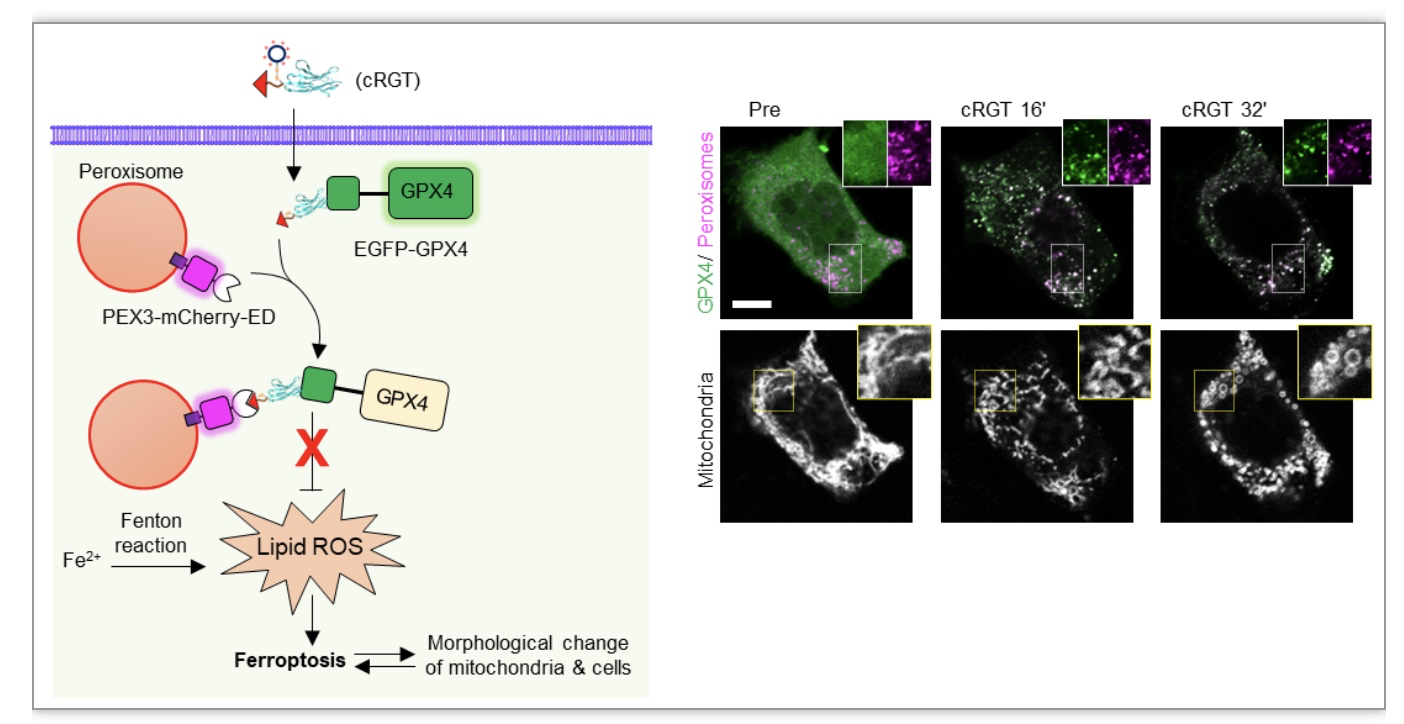
图4. cRGT通过诱导GPX4与过氧化物酶体的临近而快速激活铁死亡
(图源:Sun, et al., Nat Commun, 2023)
微管成核过程对于纺锤体组装乃至细胞分裂至关重要,微管成核的失调也与多种疾病相关[6,7]。尽管现在有很多微管靶向试剂(microtubule targetingagents, MTAs)用于癌症的治疗,但是还没有一种试剂可以直接靶向和抑制微管成核过程。微管成核过程涉及胞内多个巨大的蛋白复合物和多个固有无序蛋白因子,这成了传统的药物设计和开发的主要限制因素,因为小分子药物难以合理设计,而抗体等生物大分子又难以跨膜。TPX2作为微管成核过程中重要的调控因子,在诸多癌细胞中过量表达,被认为是癌症治疗很有前景的候选靶标,但由于TPX2是典型的固有无序蛋白,尚无特异性结合配体,大大限制了相关药物的开发。陈西课题组通过噬菌体展示筛选出的人源TPX2的纳米抗体TBP(TPX2 binding protein),设计了靶向TPX2的SNACIP分子,在活体层面有效抑制了肿瘤增生 (图5)。因此,靶向TPX2的SNACIPs成为了首个直接作用于微管成核来治疗疾病的药物,证明了SNACIP在药物开发和转化应用上的广泛前景。
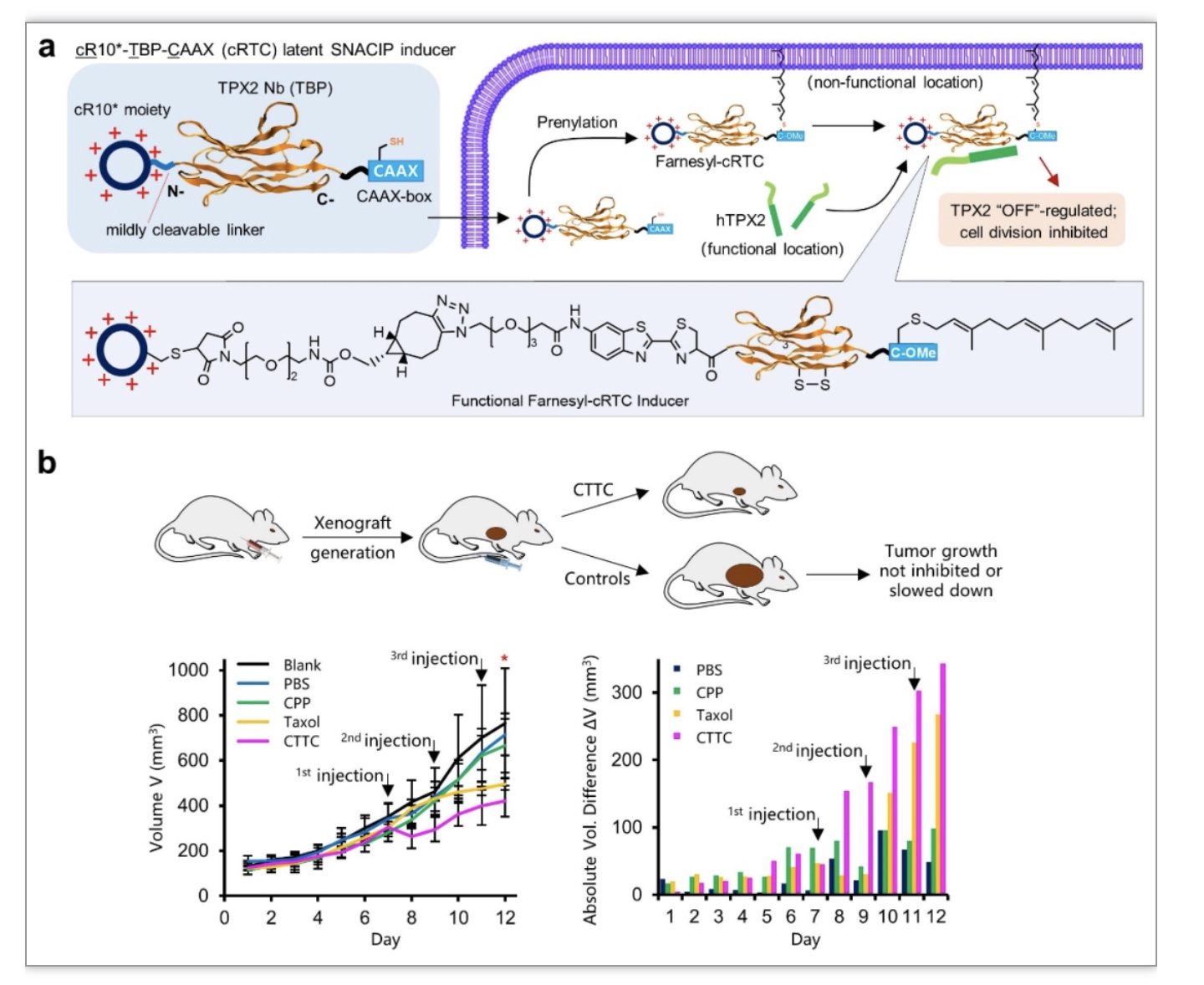
图5. 靶向TPX2的SNACIPs分子可以有效抑制肝癌肿瘤的增生
(图源:Sun, et al., Nat Commun, 2023)

