1975 年,Kohler 和 Milstein 发明了杂交瘤技术,使单克隆抗体得以大规模制备,极大地推动了抗体的发展及应用。1986年美国FDA批准了第一个单克隆抗体OKT3(muromonab-CD3),再到1997、1998年两个真正意义上的抗体重磅药物美罗华(利妥昔单抗)和赫赛汀(曲妥珠单抗)上市,抗体药物时代随之到来。在抗体药物发展的36年中,其中一半以上的药物是在2014年以后获批(图1),足见近10年来抗体药物发展的火热程度 [1]。
抗体的发展经历了从鼠源、嵌合抗体、人源化抗体、全人源化抗体的阶段,目前所研发或生产抗体以人源化和全人源化抗体为主。近年来,抗体药物技术不断更新迭代,从最初的单克隆抗体衍生出了新的技术平台,包括双特异性抗体、抗体偶联药物等。因此,抗体经历了从野生型单克隆抗体到重组抗体的转变,基因工程技术的发展使得这一转变得以成功实施并产生一些优于野生型抗体的重组抗体。基因工程技术提供了操纵抗体基因的能力,使其可以产生所需的抗体框架、抗体结构,便于应用突变筛选技术获得高亲和力、高度人源化的抗体,可以易于操控抗体的ADCC\CDC\ADCP效应、半衰期、翻译后修饰等,并能允许加入标签和融合蛋白来协助抗体的纯化、检测及增加新的功能如增加半衰期、增强抗肿瘤活性等。
重组抗体的表达需结合抗体的结构、抗体的应用、抗体的生物活性等选择合适的表达宿主,抗体药物发展早期,杂交瘤细胞、Sp2/0、NS0、HT1080、PER.C6、CAP等细胞使用较为常见 [2],随着抗体药物的发展及对表达系统的深入研究,CHO细胞逐渐取代其他哺乳动物表达系统成为主流表达细胞,对于片段抗体的表达,更为经济及快速的表达系统如E.coli及酵母也是较为常见的表达系统(图1)。
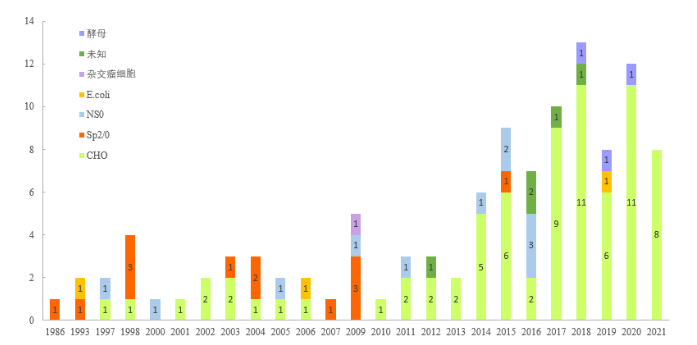
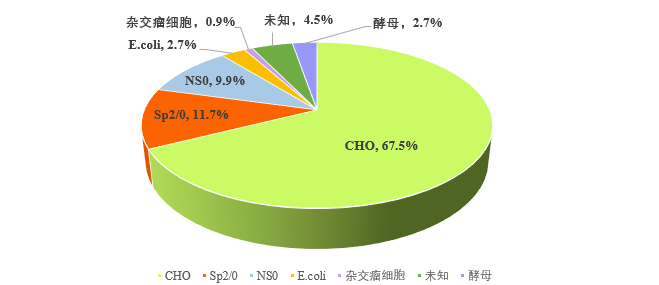
图1. 1986年-2021年FDA上市抗体药物表达系统。上图,FDA上市抗体药物使用表达系统统计;下图,各表达系统使用占比情况
2
HEK293和CHO真核表达系统差异
抗体药物研发前期阶段,HEK293和CHO细胞常用于抗体的瞬时表达以用于快速筛选高亲和力、人源化抗体,HEK293常用悬浮细胞系包括expi293、Freestyle293、HEK293-6E,CHO常用悬浮细胞系包括expiCHO、CHO-K1、CHO-3E7、CHO-DG44,目前瞬时转染表达抗体最常用的细胞系为expi293和expiCHO。HEK293和CHO虽同为哺乳动物细胞,其在抗体表达水平、抗体电荷水平、翻译后修饰等方面均有所差异,表达系统的选择需根据具体实验需求进行。在抗体表达水平方面,研究发现expiCHO表达量优于expi293(表1),但expiCHO表达需要时间更久(8-14天),expi293表达只需要4-6天,更久的表达时间虽然能提高抗体表达量,但抗体的纯度会更差(表2),因此,需要在抗体表达量、抗体纯度、抗体表达时间之间做出平衡 [3]。在抗体电荷水平方面,研究发现expi293和expiCHO所表达蛋白,其电荷特性有差异(图2)[4]。电荷异构体可能影响抗体的稳定性、药效、免疫原性和药代动力学,当电荷变异超过一个pH单位时,会影响药物的组织分布及药代动力学,增加正电荷会提高药物的组织停滞、降低血液清除,降低正电荷会减少药物的组织停滞、提高药物的全身清除 [5]。在翻译后修饰方面,CHO与HEK293生产的蛋白在糖结构的大小和数量、唾液酸的数量有所差异,CHO生产的蛋白比HEK293具有更多的亚型,且所有亚型的酸性更强,HEK293能同时表达2,3唾液酸转移酶和2,6唾液酸转移酶,而CHO只表达2,3唾液酸转移酶(图3)[6]。糖基化影响抗体折叠、稳定性、溶解性、生物活性、药物代谢、免疫原性等各方面,表达系统的选择需根据实验需求而定。
表1. 14个蛋白在expi293(转染后第4天细胞上清)、expiCHO(转染后第14天细胞上清)细胞中瞬时表达情况
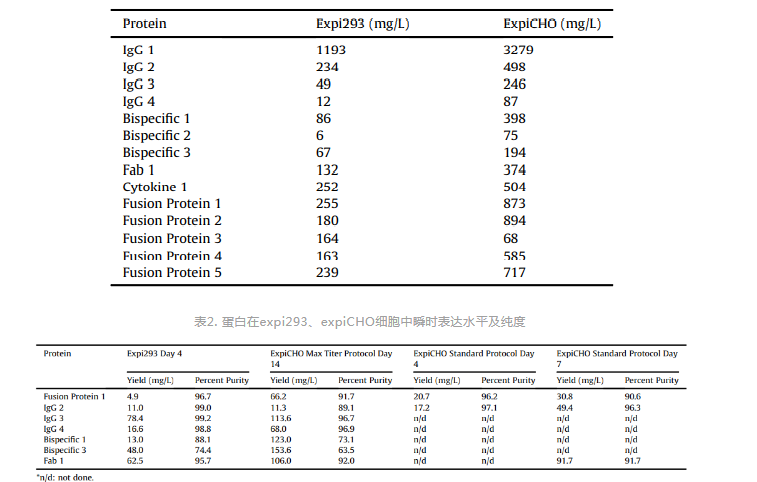
表2. 蛋白在expi293、expiCHO细胞中瞬时表达水平及纯度
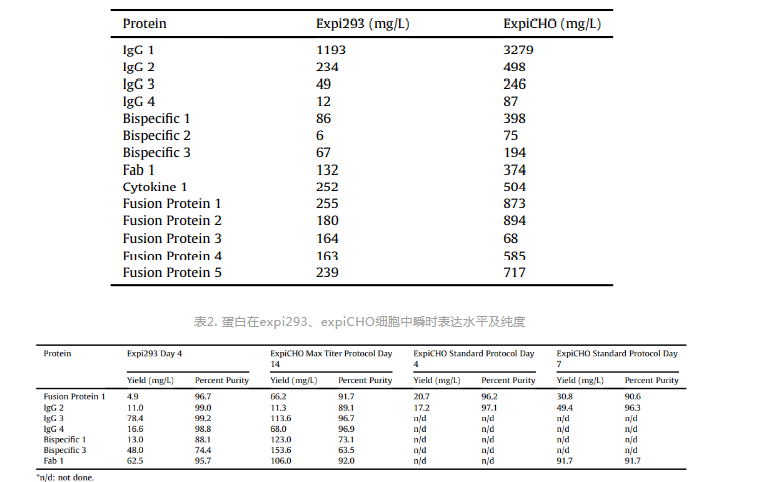
图2. 糖蛋白A在expi293瞬转(a)、expiCHO瞬转(b)、CHO稳转(c)细胞中电荷特性
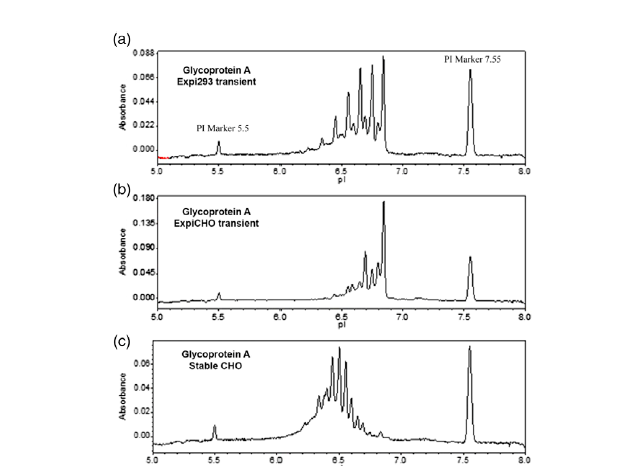
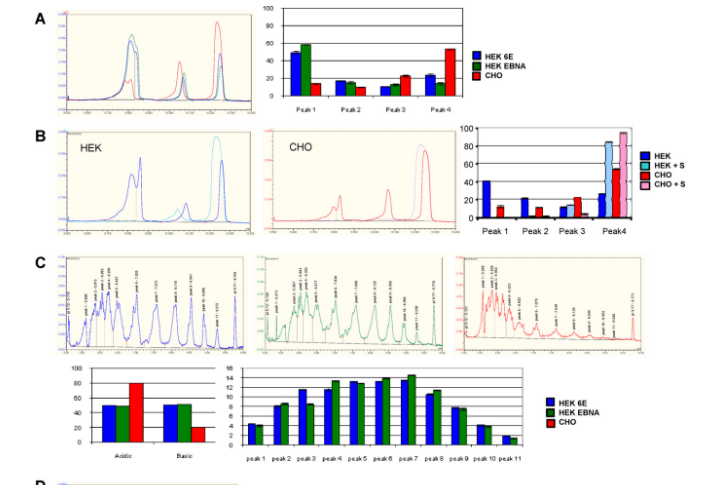
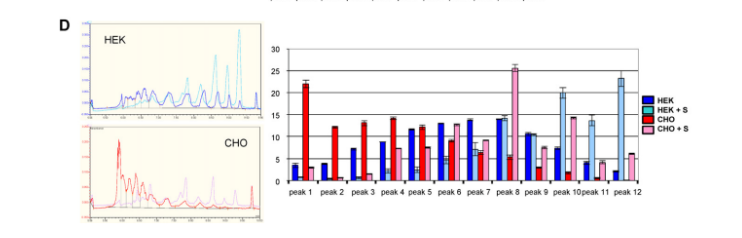
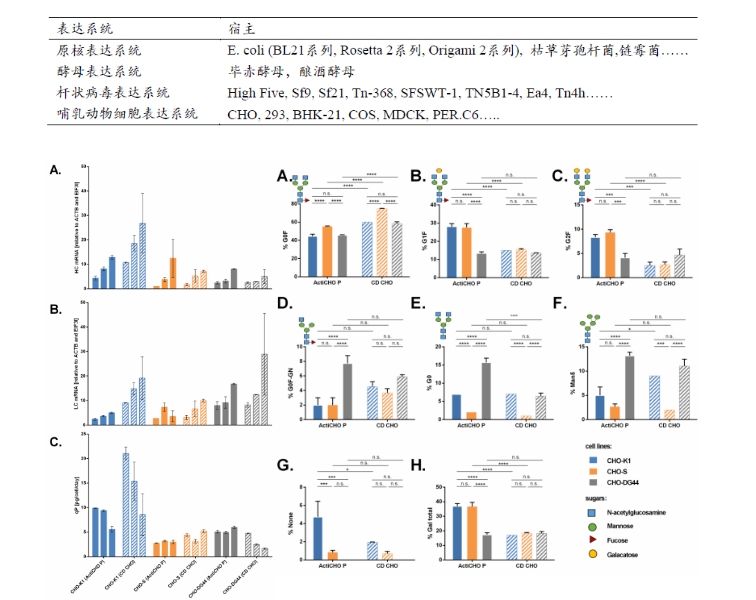
图3. 等电聚焦毛细管电泳分析CHO、HEK-EBNA、HEK-6E细胞表达蛋白糖基化亚型。A. 蛋白1在CHO(红色)、HEK-EBNA(绿色)、HEK-6E(蓝色)细胞中的糖型分析及定量;B. HEK与CHO细胞表达蛋白1经唾液酸酶处理(+S)前(暗色)与处理后(亮色)糖型分析;C. 蛋白4在CHO(红色)、HEK-EBNA(绿色)、HEK-6E(蓝色)细胞中的糖型分析及定量;D. HEK与CHO细胞表达蛋白4经唾液酸酶处理(+S)前(暗色)与处理后(亮色)糖型分析。
3
真核表达系统优化策略
抗体表达涉及质粒DNA进入细胞、mRNA转录、mRNA翻译、抗体转运、抗体分泌等多个步骤,抗体具有复杂的结构及翻译后修饰机制,需要复杂的细胞器完成抗体的正确表达、翻译、折叠、加工。基因水平、细胞水平、细胞培养水平、分子水平等各方面条件优化对抗体的表达均有影响。
3.1 表达系统及表达宿主的选择
选择合适的表达宿主是获得最佳抗体表达的第一步,一系列的原核和真核系统均适合于抗体表达(表3),哺乳动物细胞CHO、HEK293,因其具有较低的免疫原性、有效的蛋白折叠及较完整的翻译后修饰能力,是治疗性抗体表达的首选宿主。对于不带Fc的片段抗体,由于其功能的发挥与糖基化程度无关,大肠杆菌、酵母表达系统由于其表达水平高、成本低、培养优化条件简单、表达速度快等优势,是片段抗体表达常用的宿主。
通过克隆筛选及基因突变,CHO细胞包括CHO-DXB11,CHO-K1, CHO-DG44, 和CHO-S等多个谱系,尽管它们来源于同一个祖先,但它们基因组有着不同的基因缺失及突变,也有不同的生物进程。不同的细胞株对不同的培养基、培养条件适应性有所差异,它们在抗体的表达水平、修饰水平也有差异(图4)[7],因此,谨慎选择抗体表达所用细胞株对于抗体的后期开发及验证至关重要。
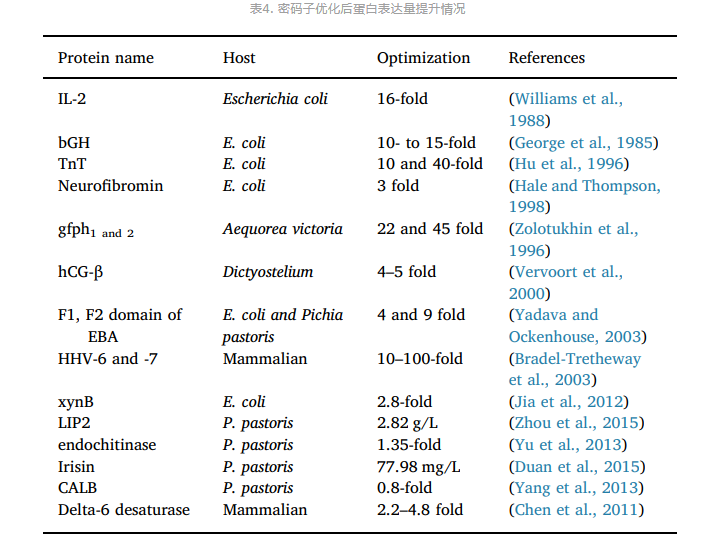
表3. 蛋白表达常用宿主
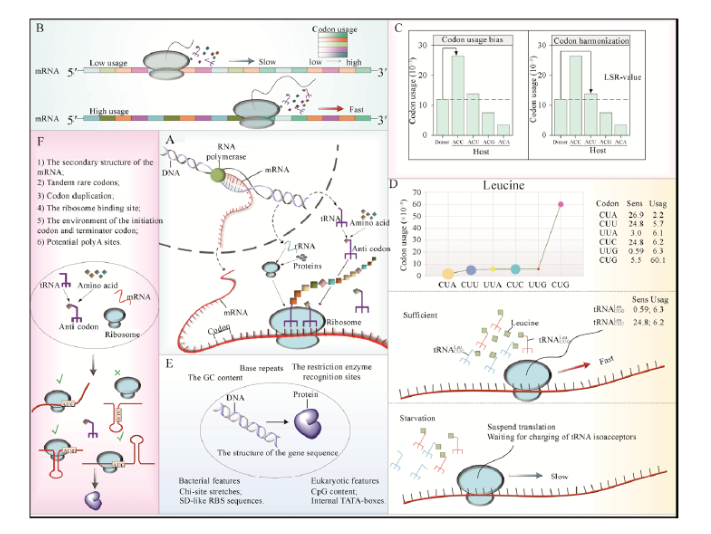
图4. CHO-K1, CHO-DG44, 和CHO-S细胞在抗体表达及糖基化修饰上的差异。左图,CHO-K1, CHO-DG44, 和CHO-S细胞在ActiCHO P、CD CHO培养基中重链(A)、轻链(B)、细胞特异性抗体 (C) 产量; 右图,CHO-K1, CHO-DG44, 和CHO-S细胞在ActiCHO P、CD CHO培养基中重链糖基化分布,(A) G0F占比, (B) G1F占比, (C) G2F占比, (D) G0F-Gn占比, (E) G0占比, (F) Man5占比, (G)非糖基化占比, (H)总糖基化占比。
3.2 密码子优化
密码子优化是实现异源蛋白高效表达的重要技术手段,密码子偏好性策略适用性广,能用于大多数异源蛋白表达(表4)[8]。不同生物在mRNA翻译过程中对简并密码子的使用频率存在差异,它们在进化过程中形成了一套与其相适应的常用密码子,当外源基因的密码子所对应的tRNA在宿主细胞中的表达量低时,会影响外源基因的翻译效率。密码子优化根据宿主的密码子偏好性调整基因的同义密码子和相关调控元件,减少或消除稀有密码子,提高蛋白的翻译效率,需同时考虑mRNA二级结构、GC含量、酶切位点、稀有密码子、重复密码子、CpG含量、TATA盒等调控区域等影响转录和翻译的因素。考虑到翻译动力学、翻译后折叠、代谢水平等因素,人们提出了一些新策略用于密码子优化,包括密码子协调性、密码子敏感性、调整基因序列等(图5),在提升蛋白表达量的同时提升蛋白表达质量 [9]。

表4. 密码子优化后蛋白表达量提升情况

图5. 密码子优化策略。A,影响蛋白表达的因素,包括基因序列、转录、翻译、翻译后过程等;B,密码子偏好性策略;C,密码子偏好性策略与密码子协调性策略比较;D,密码子敏感性策略;E,基因序列对蛋白表达的影响;F,影响蛋白表达的其他因素。
3.3 表达载体优化
表达载体介导了抗体序列进入宿主及在宿主细胞中的高效表达,载体中很多元件直接或间接参与了目的序列的转录或翻译调控,如promoter、信号肽、enhancer、UTR、polyA、WPRE等,一些常规载体中不常使用的元件包括Insulator、MARs、UCOE、STARs等对抗体的表达也有一定影响。表达载体的分子元件的优化对抗体的表达量及质量均有明显提升(图6)[10]。Kozak序列影响翻译起始,不同的Kozak序列对抗体的表达以及双抗的组装也有重要影响,Noelia Blanco等筛选到了比野生型Kozak序列具有更高翻译活性的序列,且发现+4位为A或C其翻译活性更高(图7)[11]。
目前常使用的抗体表达方法为使用两个载体分别携带重链和轻链编码序列共转染宿主细胞,该方法重链和轻链表达量可控,但该方法工作量大且筛选出目的抗体的概率较低。而采用多启动子表达载体,由于重链、轻链表达盒含有各自独立的启动子,能转录出两种不同的mRNA并进行独立翻译,该方法操作简单,独立的启动子易于调节表达产物的活性并可提高抗体的表达效率。双顺反子载体允许轻链、重链在一个表达框中进行表达,可以很好的调控轻链、重链表达比例,提高抗体表达水平,帮助蛋白更好的折叠,产生较少的聚合物及更优的糖基化修饰,常用的连接子为IRES、Furin-2A(表5)[10] [12]。
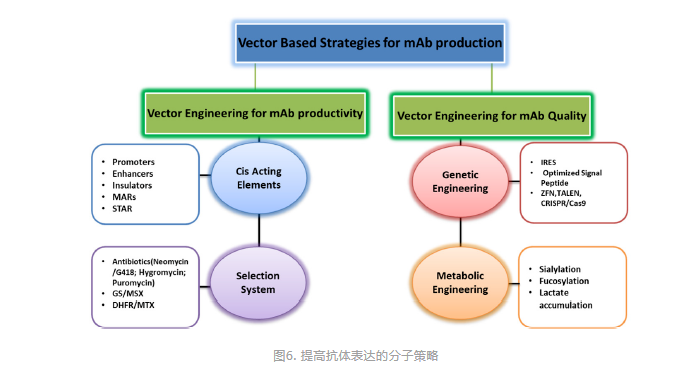
图6. 提高抗体表达的分子策略
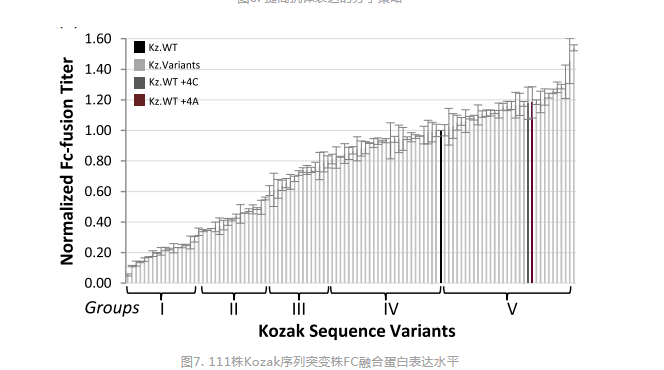
图7. 111株Kozak序列突变株FC融合蛋白表达水平
表5. CHO细胞中重组抗体表达载体优缺点
3.4 转染方法优化
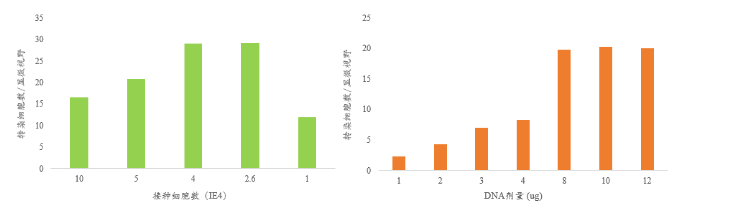
表达载体进入宿主细胞是开启抗体表达的第一步,介导表达载体进入宿主细胞的方法包括磷酸钙法、脂质体法、电转法、PEI法、显微注射等,不同的转染方式对质粒进入不同宿主细胞的效率有显著影响,对于抗体的瞬时或稳定转染(HEK293、CHO),脂质体法或PEI法是最常用的方法。转染方法的优化涉及细胞活力与转染用细胞量、DNA质粒用量、DNA与转染试剂用量、细胞暴露于DNA与脂质体复合物的时间、电转电压、电容、细胞体积等方面(图8),对于不同的宿主细胞及表达载体,需采用合适的优化方案以达到最优的转染效率 [13]。
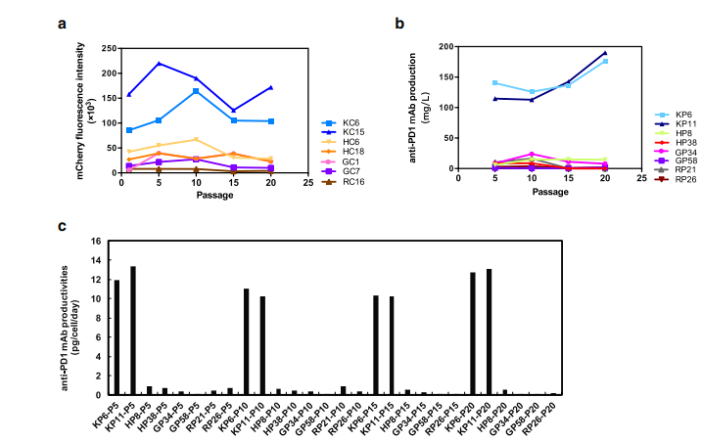
图8. 转染方法优化对转染效率影响。左图,细胞数量对转染效率的影响;右图,DNA剂量对转染效率的影响
小结
抗体表达涉及许多复杂因素的相互作用,很难找到一个通用的系统用于各个抗体的表达,抗体表达优化是一项必要且有意义的工作,在提升抗体表达量、减少抗体生产成本的同时可以提升抗体质量。抗体表达优化需从基因水平、细胞水平、分子水平、细胞培养水平等方面进行,基因组学、蛋白组学的发展将提供更多的信息用于克服目前的研究障碍以促进抗体表达水平质的飞跃。
参考资料
-
Mullard Asher, FDA approves 100th monoclonal antibody product [J]. Nat Rev Drug Discov, 2021.
-
Kamilla Swiech, et al. Human cells: New platform for recombinant therapeutic protein production [J]. Protein Expression and Purification, 2012.
-
Nina K. Jain, et al. A high density CHO-S transient transfection system: Comparison of ExpiCHO and Expi293 [J]. Protein Expression and Purification, 2017.
-
Xiaotian Zhong, et al. A Transient CHO Expression Platform for Robust Antibody Production and Its Enhanced N-Glycan Sialylation on Therapeutic Glycoproteins [J]. Biotechnology progress, 2018.
-
程洪杰等,单克隆抗体电荷异构体分离方法优化[J]. 中国医药生物技术,2014.
-
Amelie Croset, et al. Differences in the glycosylation of recombinant proteins expressed in HEK and CHO cells [J]. Journal of Biotechnology, 2012.
-
David Reinhart, et al. Bioprocessing of recombinant CHO-K1, CHO-DG44 and CHO-S: CHO expression hosts favor either mAb production or biomass synthesis [J]. Biotechnology Journal, 2018.
-
Adnan B. Al-Hawash, et al. Strategies of codon optimization for high-level heterologous protein expression in microbial expression systems [J]. Gene Reports, 2017.
-
杨云彭等,密码子优化策略在异源蛋白表达中的应用[J]. 生物工程学报,2019.
-
Kritika Gupta, et al. Vector-related stratagems for enhanced monoclonal antibody production in mammalian cells [J]. Biotechnology Advances, 2019
-
Noelia Blanco, et al. Tailoring translational strength using Kozak sequence variants improves bispecific antibody assembly and reduces product‐related impurities in CHO cells [J]. Biotechnology and Bioengineering, 2020.
-
李艳梅等, CHO细胞重组抗体表达载体的构建策略及进展[J].中国细胞生物学学报, 2018.
-
李扬等,脂质体介导外源基因体外转染牛胎儿成纤维细胞条件的优化[J].遗传, 2002.
-
Menglin Zhao, et al. Rapid development of stable transgene CHO cell lines by CRISPR/Cas9-mediated site-specific integration into C12orf35 [J]. Applied Microbiology and Biotechnology, 2018.
-
Jee Yon Kim, et al. CHO cells in biotechnology for production of recombinant proteins: current state and further potential [J]. Appl Microbiol Biotechnol,2012.
-
宓庆宇等,CHO 细胞工程化改造的研究进展[J].生物技术,2019.
-
Janike Ehret, et al. Impact of cell culture media additives on IgG glycosylation produced in CHO cell [J]. Biotechnology and Bioengineering, 2018.
-
郑琛,表达抗CD52单克隆抗体CHO细胞灌流培养工艺研究[D],2018

