耐甲氧西林金黄色葡萄球菌(MRSA)是一种重要的人兽共患病原菌。MRSA可以利用生物被膜逃避宿主免疫系统和抗菌药物的杀伤作用而导致顽固性感染,严重威胁人类健康,也给畜牧业造成了巨大的经济损失。常规抗菌药由于其非特异性分布和生物被膜屏障常常导致其疗效低下,并极易诱导细菌耐药性。因此,迫切需要开发具有高效抗生物被膜作用且不易诱导耐药性的新型治疗策略。
近日,华中农业大学精准兽药创制与环境消减技术开发团队巧妙设计了具有级联光动力疗法和营养免疫疗法协同作用的精准纳米系统,以新型的抗菌机制高效抗生物被膜感染,相关成果以“Targeting and Arginine-driven Synergizing Photodynamic Therapy with Nutritional Immunotherapy Nanosystems for Combating MRSA Biofilms”为题,发表在Science Advances上。本研究以PCN-224为光动力平台,开发一种靶向耐甲氧西林金黄色葡萄球菌(MRSA)生物被膜的精氨酸驱动的级联光动力与营养免疫协同治疗的复合纳米系统,并深入研究了该复合纳米系统对生物被膜的杀伤活性及其作用机制。

光动力疗法通过产生活性氧(ROS)实现对细菌的非特异性杀伤且不易诱导细菌耐药性。但是由于生物被膜的抗氧化系统,活性氧的短距离扩散以及光敏剂的溶解性差导致光动力效率差。同时由于生物被膜感染期间细菌对宿主的营养竞争降低宿主免疫反应。因此,为了高效精准治疗MRSA生物被膜感染,课题组建立了精氨酸驱动的级联光动力与营养免疫协同治疗的复合纳米系统(Arg-PCN@Gel)(图1A)。该纳米系统的外壳(明胶)在MRSA分泌的金属基质酶的作用下释放内核Arg-PCN和宿主免疫反应所需的精氨酸(图1A和图1G)。在红光照射下,Arg-PCN@Gel首先产生1O2等ROS(图1B-F),然后通过级联反应产生NO,ONOO-等RNOS多种活性物质(图1H-J)。
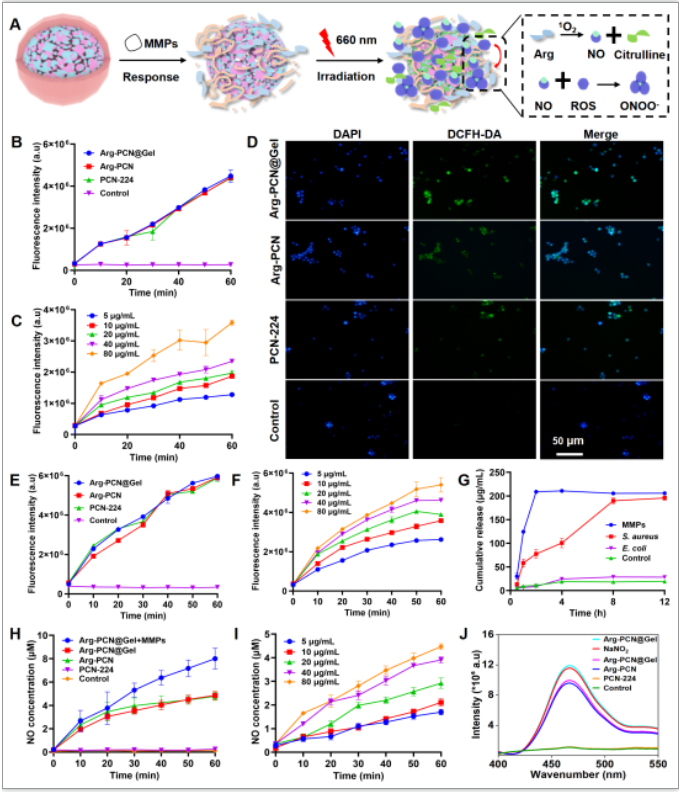
图1在红光辐照下,复合纳米系统的级联反应。
为了检测Arg-PCN@Gel对生物被膜的抗菌活性,在体外培养MRSA成熟生物被膜,并将Arg-PCN@Gel与生物被膜共孵育,结果发现Arg-PCN@Gel可以黏附于生物被膜表面,并随着孵育时间的增加,Arg-PCN@Gel可以进入生物被膜的内部(图2A)。在辐照条件下,Arg-PCN@Gel利用NO有效地破坏成熟的生物膜屏障,促进ROS和ONOO-渗透到生物膜中,破坏生物被膜内的MRSA的细胞壁和细胞膜(图2B-G)。并且Arg-PCN@Gel在辐照的条件下可以进入生物被膜内部对持久性细菌细胞也存在杀伤作用(图2H和I),由此表明Arg-PCN@Gel有望治疗生物被膜所导致的持久性和复发性感染。
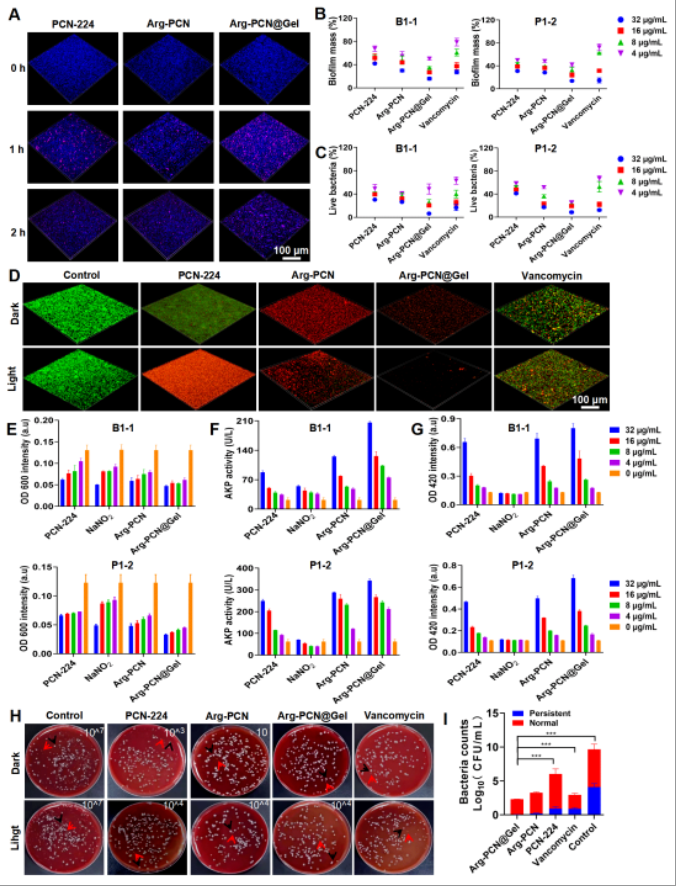
图2 Arg-PCN@Gel的抗生物被膜活性
由于Arg-PCN@Gel在体外良好的抗生物被膜活性,课题组对其抗生物被膜的能里进行了研究。在小鼠生物被膜感染模型中,Arg-PCN@Gel可以靶向生物被膜感染部位,可持续停留15天(图3A-C),并且在治疗初期诱导促炎因子TNF-α和iNOS的表达(图4B和D),并进一步利用精氨酸产生大量NO以达到抗菌效果,在治疗7天后,感染部位的生物被膜被破坏清除(图3G)。随后,逐渐积累的NO不仅清除了细菌,还诱导了IL-4和Arg-1的抗炎因子的表达(图4C和D),从而感染组织利用精氨酸从促炎阶段转化为抗炎阶段来促进伤口愈合(图4F-H)。
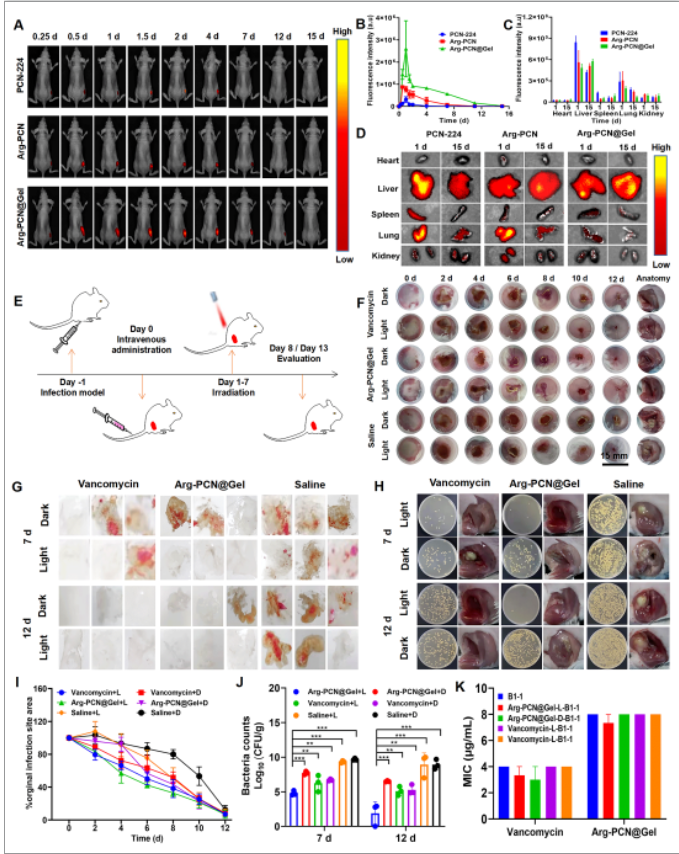
图3 Arg-PCN@Gel的体内抗生物被膜活性
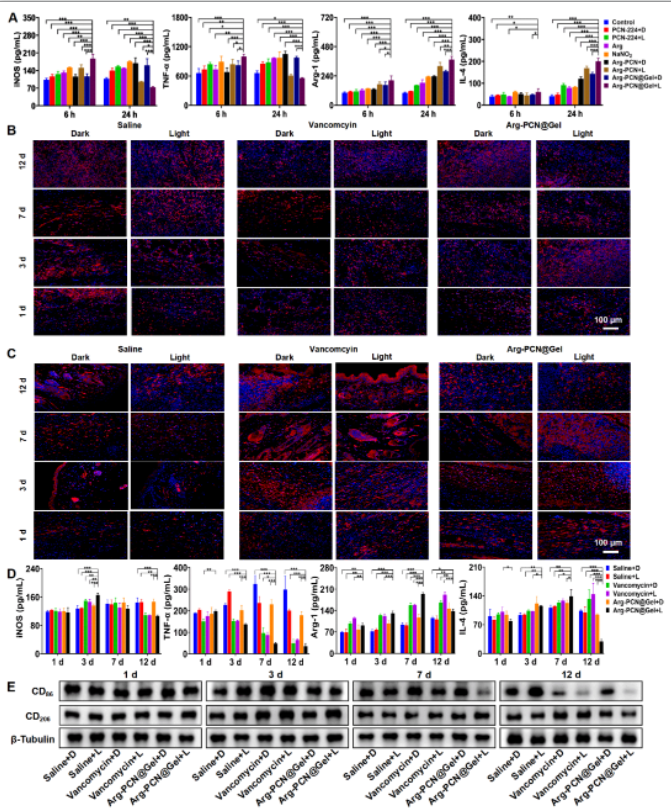
图4 Arg-PCN@Gel的营养免疫治疗
为了阐明Arg-PCN@Gel抗生物被膜的机制,课题组对其处理后的MRSA生物被膜进行了转录组学研究。该纳米系统的外壳(明胶)可以通过靶向MRSA产生的自溶素(atl)而靶向黏附于MRSA生物被膜并被MRSA摄取(图5 A-C)。Arg-PCN@Gel通过下调arsR、copZ、codY、ccpA等来抑制MRSA的元素代谢(图5D和E)、能量利用效率(图5F-H)、精氨酸代谢系统、双组分系统和EPS合成(图5I),以防止生物膜的形成。
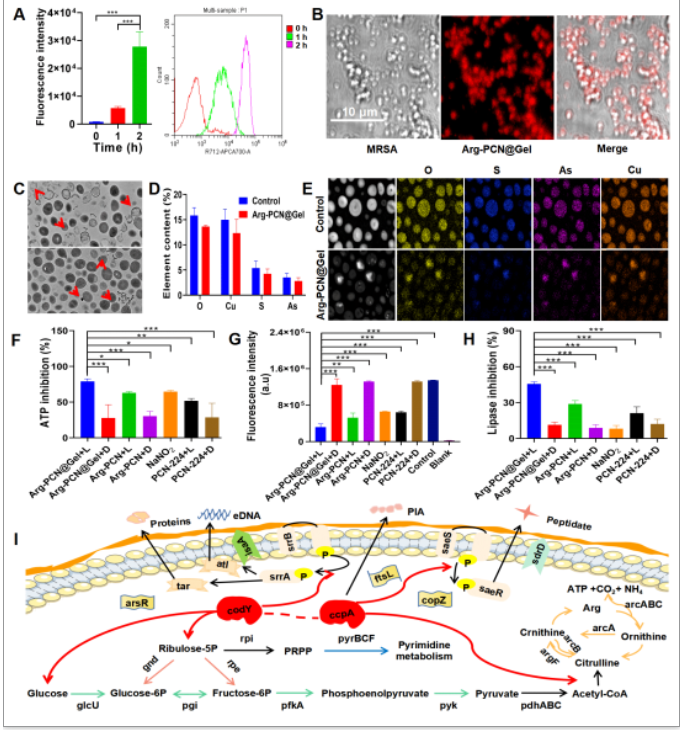
图5 Arg-PCN@Gel抗生物被膜的机制

