固有免疫(innate immunity)是宿主抵御病毒入侵的第一道防线。在病毒感染早期,宿主迅速识别入侵病毒并启动抗病毒固有免疫反应,释放I 型干扰素在内的多种抗病毒细胞因子来抵御病毒感染。cGAS-STING是识别DNA病毒感染的重要信号通路,cGAS识别入侵病毒DNA后促进cGAMP的生成,进而引起STING的激活,诱导Ⅰ型干扰素和干扰素刺激基因的表达启动宿主的抗病毒固有免疫反应。因此,cGAS-STING介导的DNA信号识别是启动宿主抗病毒免疫应答的关键步骤。
宿主的营养状况是决定感染性疾病结局的关键因素,硒作为一种人体必需的微量营养素,在多种生理过程中起着重要作用。硒的生物学功能主要通过硒蛋白来发挥,大多数硒蛋白是位于细胞质中的可溶性蛋白,通过调节氧化还原途径起到抵御氧化应激的作用。硒蛋白家族中有8个成员定位在内质网,这些内质网硒蛋白的功能尚未明确。硒蛋白K(SELENOK)是一种内质网硒蛋白,目前研究发现其在免疫反应中发挥重要作用,然而SELENOK在STING激活和抗病毒固有免疫反应中的潜在作用尚不清楚。该研究揭示了内质网硒蛋白K通过促进STING寡聚化来增强宿主抗病毒固有免疫反应。

为了研究巨噬细胞中内质网硒蛋白在cGAS-STING通路中潜在的调节机制,作者首先分析了8种内质网硒蛋白在小鼠原代腹腔巨噬细胞(PM)中对cGAS-STING信号通路激活的影响,发现Selenok敲低显著抑制单纯疱疹病毒1(HSV-1)感染诱导的I型干扰素反应,敲低其他内质网硒蛋白基因未发现类似作用(图1)。

图1 内质网驻留硒蛋白对cGAS-STING信号转导的影响。
(图源:Lin Lv, et al., PLoS Pathog, 2023)
Selenok缺陷抑制cGAS介导识别的HSV-1感染和干扰素刺激DNA(ISD)诱导的IFN-β分泌和mRNA表达。然而,由RIG-I介导识别的RNA病毒仙台病毒(SeV)所诱导的IFN-β表达不受的影响。因此,硒蛋白K选择性促进cGAS-STING信号通路依赖的抗病毒固有免疫反应(图2)。
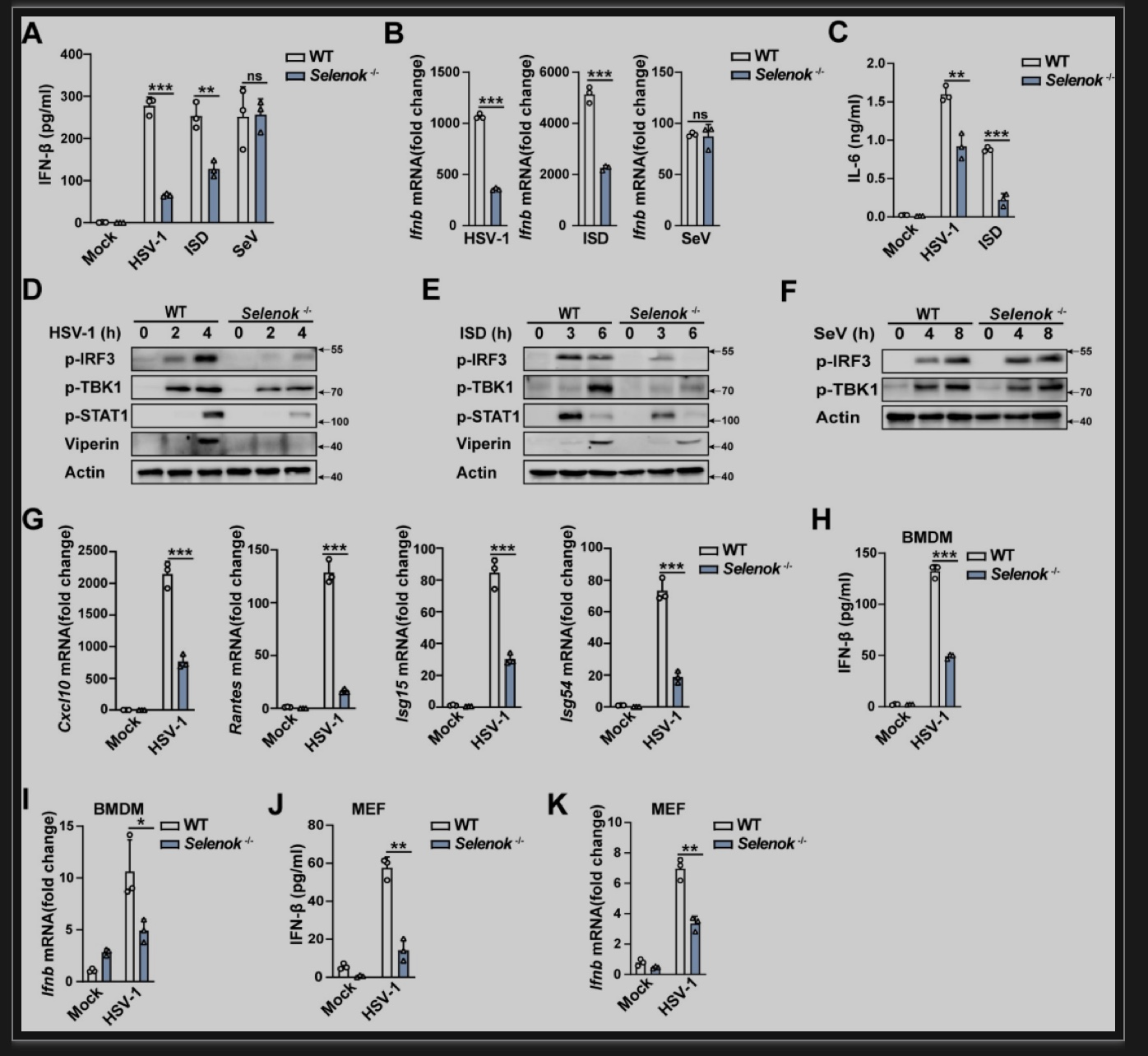
图2 Selenok缺陷抑制cGAS-STING依赖性抗病毒免疫反应
(图源:Lin Lv, et al., PLoS Pathog, 2023)
接下来作者探究了硒蛋白K与体内病毒感染的生理和病理相关性。在HSV-1感染后,Selenok缺陷小鼠的IFN-β和IL-6分泌显著降低,相应的脾、肺、脑中HSV-1的含量远高于对照小鼠,且存在更明显的炎症细胞浸润。此外,相比于对照小鼠,Selenok缺陷小鼠在HSV-1感染后的生存率显著降低。因此,Selenok缺陷显著抑制宿主对HSV-1的抗病毒固有免疫反应(图3)。
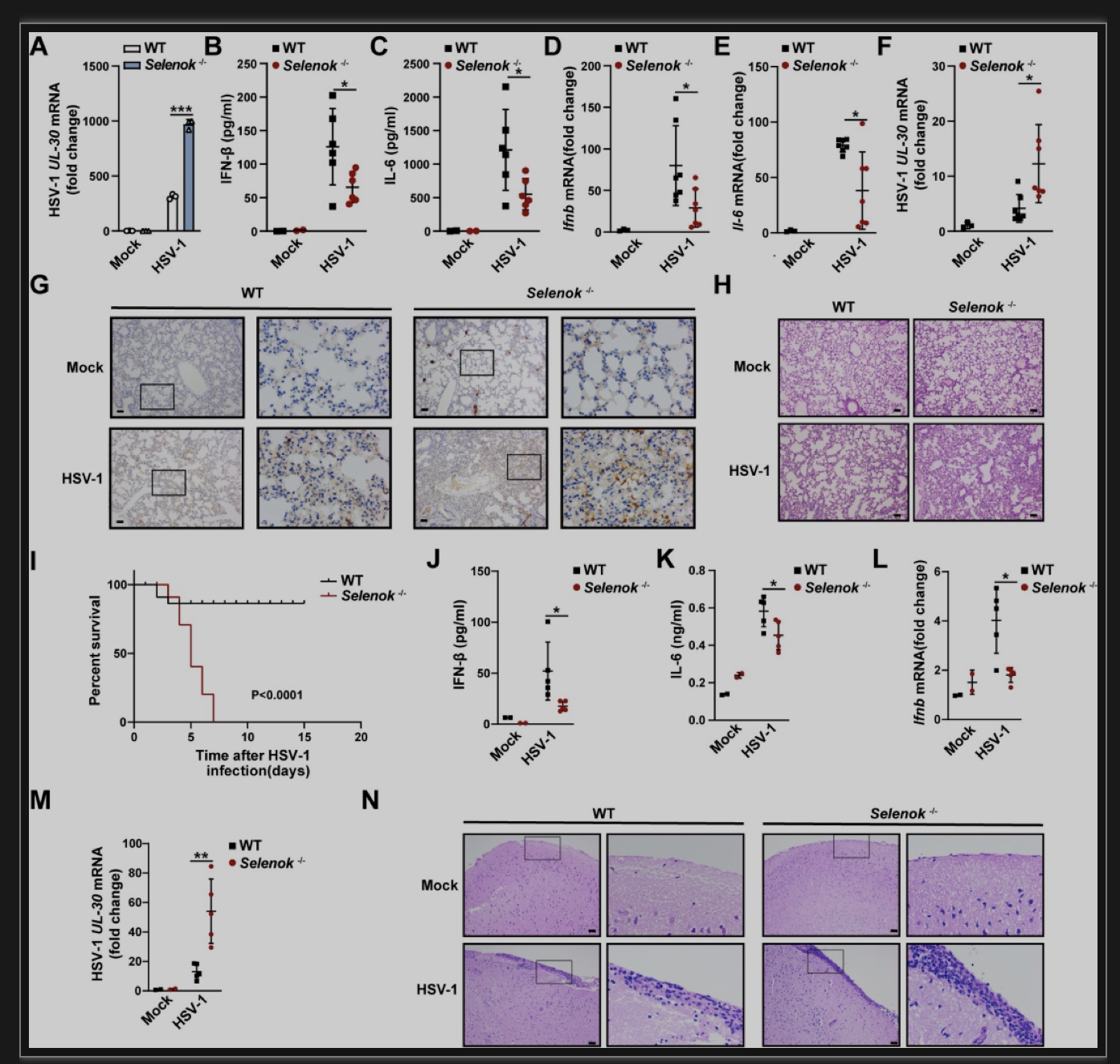
图3 Selenok缺陷在体内针对性抑制HSV-1引起的免疫反应
(图源:Lin Lv, et al., PLoS Pathog, 2023)
接下来,作者阐明了硒蛋白K促进cGAS-STING依赖性通路传导的节点。cGAS-STING诱导的IFN-β荧光素酶活性在Selenok高表达处理的HEK293T细胞中受到显著促进,而TBK1诱导的IFN-β荧光素酶活性并无差异,表明硒蛋白K可能靶向cGAS或STING。然而,硒蛋白K对cGAS与ISD的结合能力没有影响,也不能进一步影响HSV-1感染导致的cGAMP的生成,表明硒蛋白K可能靶向STING或其下游靶标。接下来,作者检测了硒蛋白K在STING直接激活中的作用,Selenok缺陷显著抑制cGAMP和DMXAA诱导的IFN-β分泌和mRNA表达及TBK1、IRF3和STAT1的磷酸化。因此,硒蛋白K靶向STING,而非cGAS(图4)。
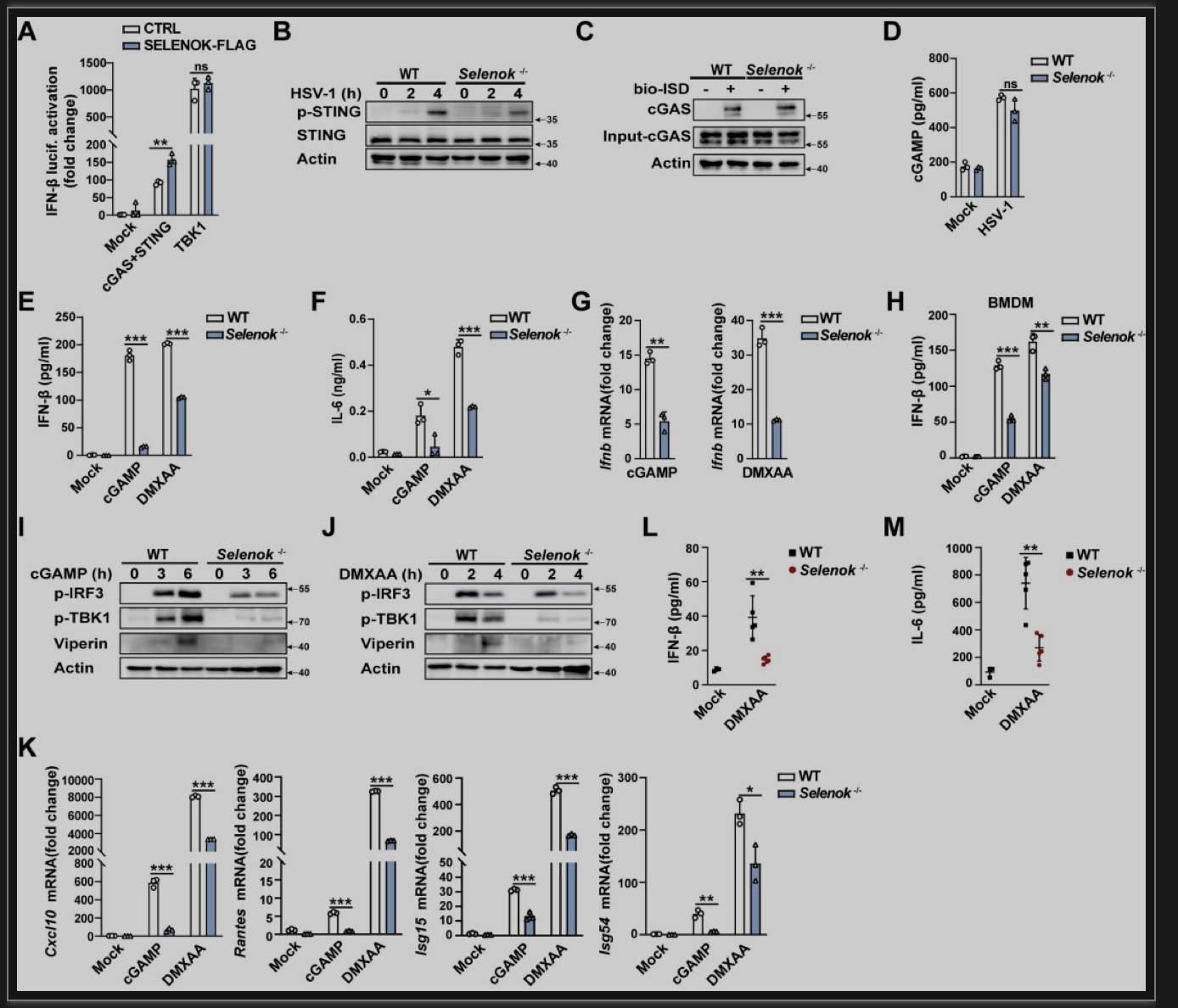
图4 Selenok缺陷抑制STING激活
(图源:Lin Lv, et al., PLoS Pathog, 2023)
硒蛋白K与STING通过内质网结构域相互作用,STING激活后,SELENOK-STING复合体从内质网转位到高尔基体,以上结果提示内质网中硒蛋白K与STING的相互作用有利于促进STING激活(图5)。
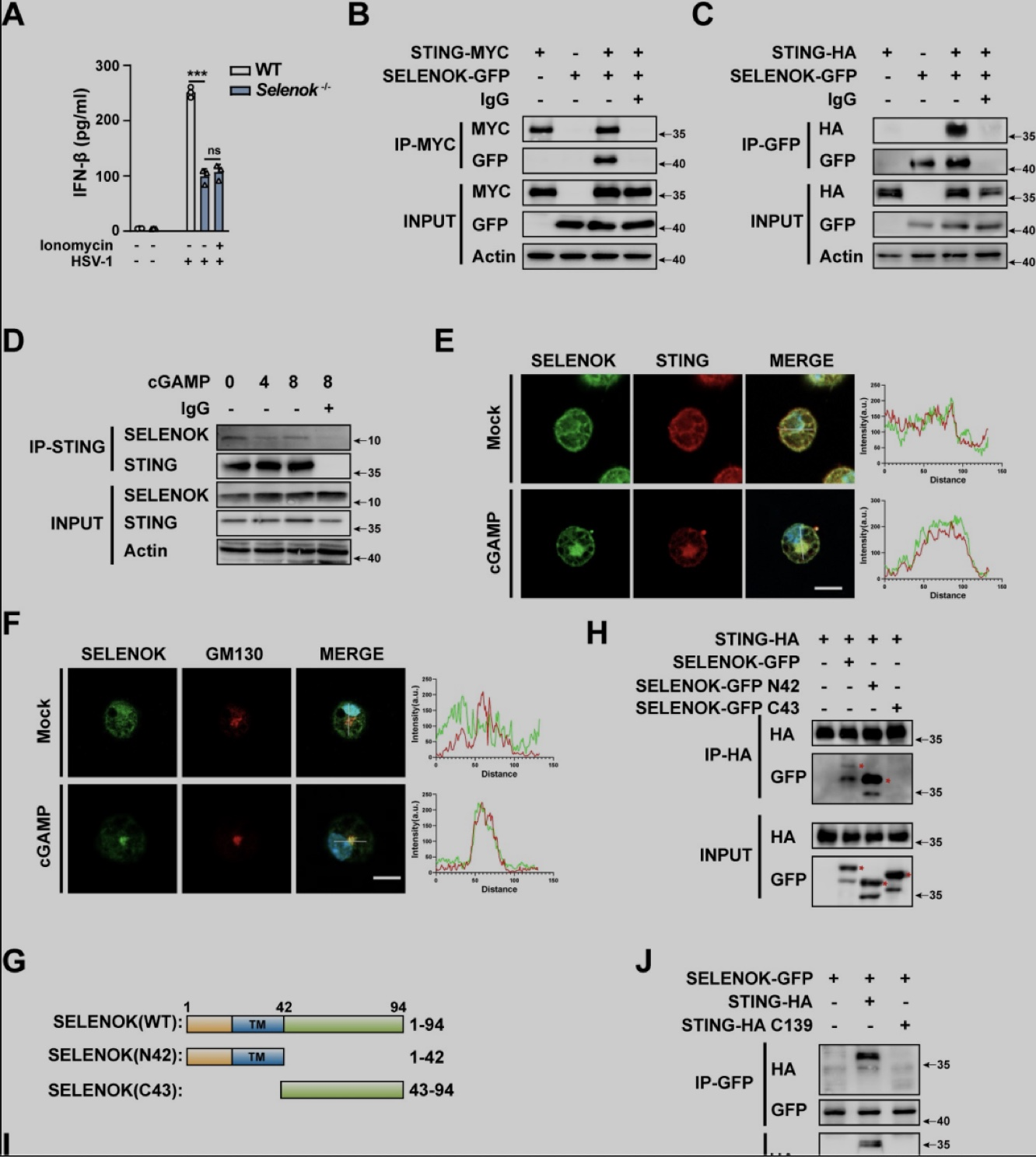
图5 硒蛋白K与STING相互作用
(图源:Lin Lv, et al., PLoS Pathog, 2023)
静息状态下STING以二聚体的形式定位在内质网,cGAMP与STING二聚体结合诱导STING发生寡聚化,使其通过外壳蛋白复合物II(COP-II)从内质网转位到高尔基体。STING的二聚化不受硒蛋白K的影响。BFA可以阻断蛋白质从内质网向高尔基体的转位。作者发现BFA处理或通过抑制COP-II的重要组分SEC13表达来破坏囊泡运输作用对STING寡聚化均没有显著影响,说明STING寡聚化发生在转位之前。与对照组相比,Selenok缺陷小鼠原代腹腔巨噬细胞中STING寡聚化显著降低,Selenok缺陷小鼠胚胎成纤维细胞中STING向COP-II和高尔基体的转位显著降低。在HEK293T细胞中硒蛋白K可以在没有cGAMP刺激的情况下直接促进STING寡聚化,且硒蛋白K介导的STING寡聚化同样不受到BFA的抑制。Selenok缺陷不能抑制STING棕榈酰化的发生,且硒蛋白K介导的STING寡聚化不依赖其C88/91棕榈酰化位点,硒蛋白K以棕榈酰化非依赖的形式促进STING寡聚化的发生。因此,硒蛋白K促进内质网中STING的寡聚化,进而允许其从内质网转位到高尔基体(图6)。
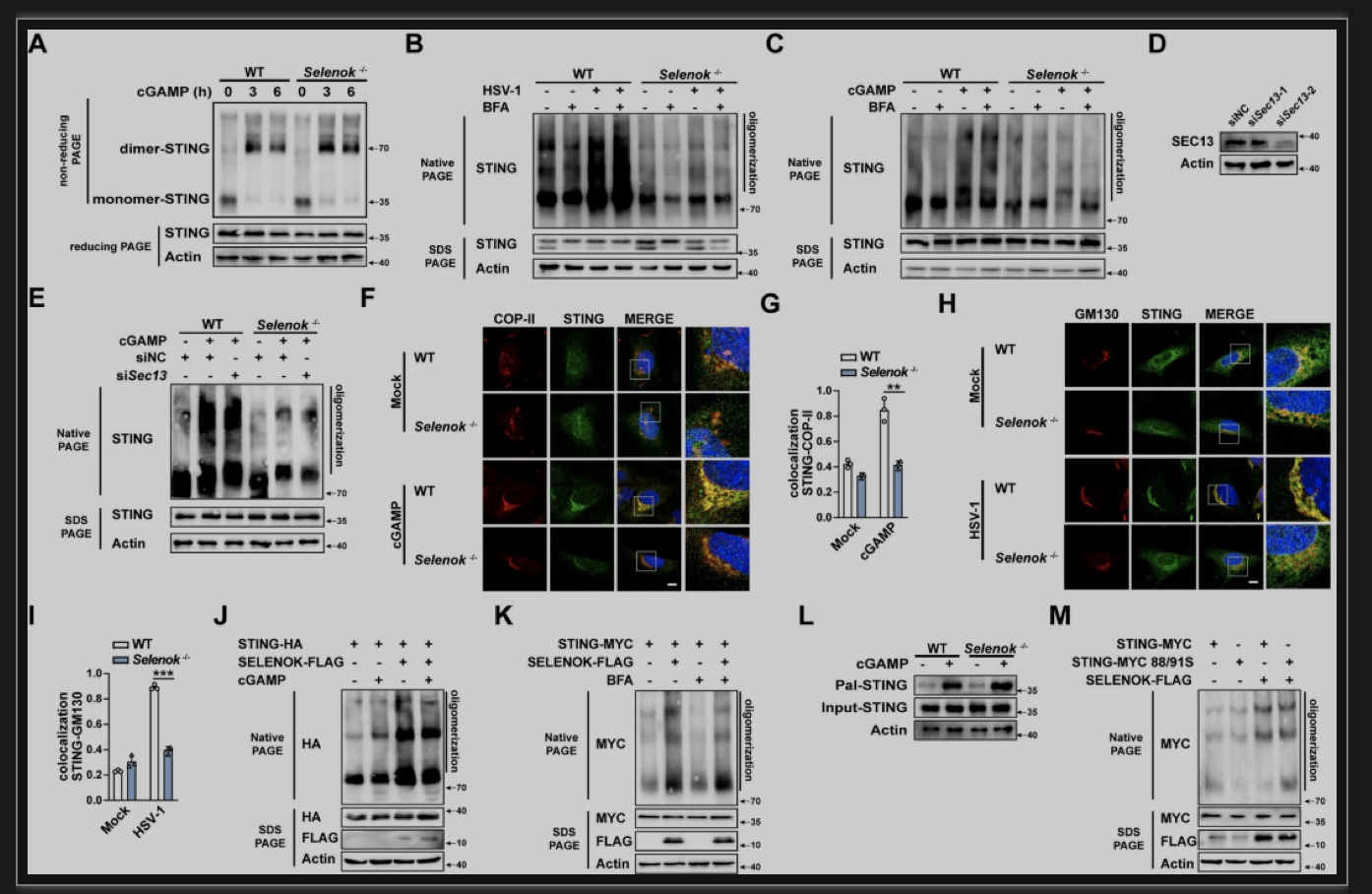
图6硒蛋白K促进STING寡聚化
(图源:Lin Lv, et al., PLoS Pathog, 2023)
膳食营养元素硒通过维持硒蛋白的合成和表达在生理过程中起着重要作用。适量的硒处理可以促进HSV-1感染诱导的IFN-β分泌并抑制病毒复制。硒处理促进硒蛋白K的表达,有趣的是,HSV-1感染和IFN-β处理同样可以促进硒蛋白K的表达。机制上,HSV-1感染和IFN-β促进了硒蛋白K的合成但并不影响Selenok的转录。因此,IFN-β诱导的硒蛋白K表达提供了一种正反馈途径以增强STING依赖的宿主抗病毒防御能力(图7)。
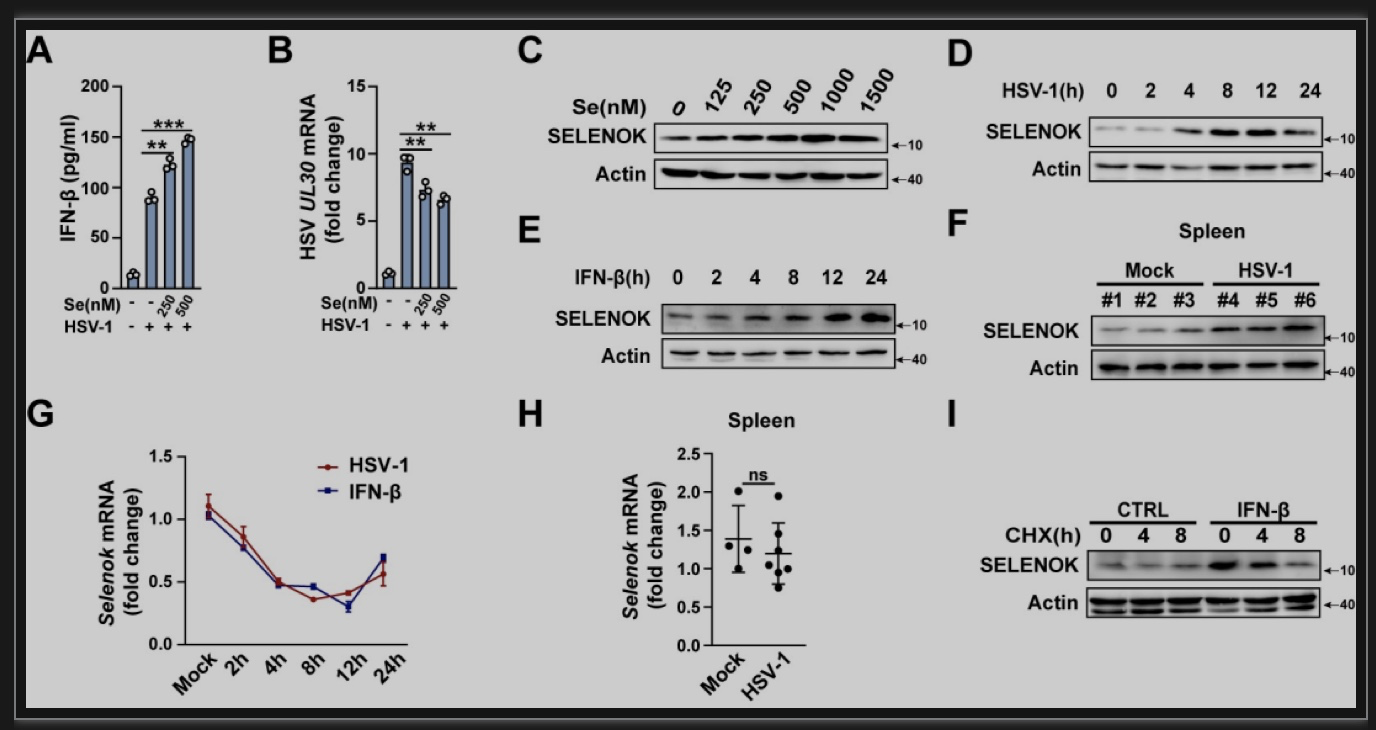
图7 IFN-β促进硒蛋白K表达
(图源:Lin Lv, et al., PLoS Pathog, 2023)
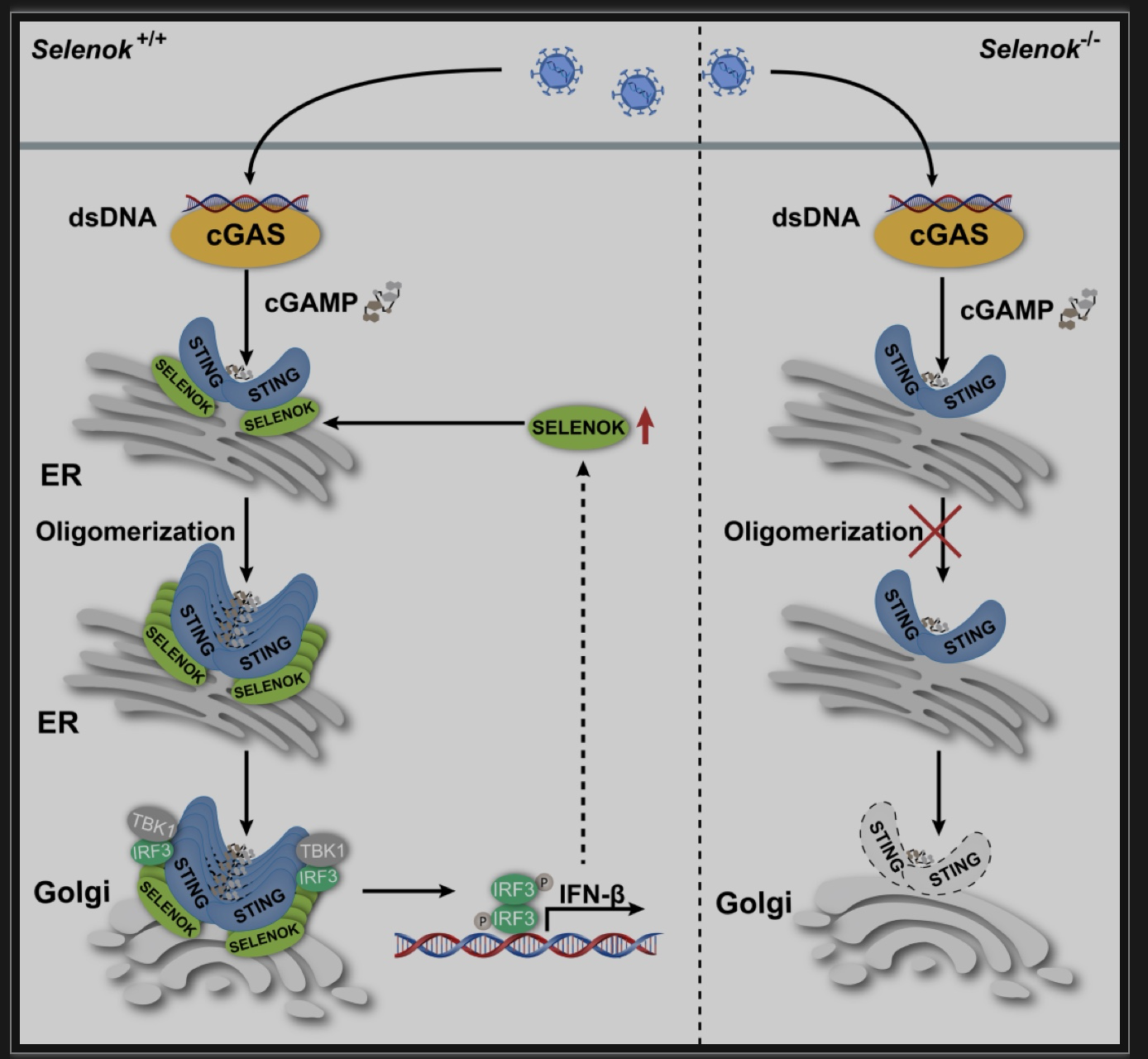
图8 硒蛋白K在STING依赖的抗病毒固有免疫反应中的作用
(图源:Lin Lv, et al., PLoS Pathog, 2023)
综上所述,该研究发现确定硒蛋白K是固有免疫反应中的一种抗病毒宿主因子,并阐明了硒蛋白K在STING激活中的作用,即促进其寡聚化发生。STING的异常激活与多种病理情况的发生息息相关,说明STING是一个重要的药物作用靶点。该研究结果表明,通过硒介导的硒蛋白K表达靶向调控STING激活可能是治疗STING相关疾病的重要治疗策略(图8)。

