阿尔茨海默病(AD)是一种多因素疾病,其神经病理学特征为淀粉样β(Aβ)斑块和tau神经纤维缠结[1,2]。小胶质细胞激活在AD标志蛋白病的积累中起着关键作用,在AD中,Aβ病理可触发微胶质细胞激活[3,4],但在人脑中,Aβ斑块和激活的小胶质细胞仅在分布上部分重叠[5,6],并且微胶质细胞激活可能发生在可证明的Aβ沉积之前[3]。载脂蛋白Eε4 (APOEε4)等位基因是散发性AD的主要遗传危险因素[7]。APOEε4和Aβ沉积之间的联系是导致AD进展的重要因素[8]。然而,最近的动物研究表明,APOEε4基因型也可能通过增强脑炎症、tau积累和神经退行性变的a β独立途径参与AD的发病[9,10]。尚不清楚APOEε4等位基因的存在是否与AD人脑中的微胶质细胞激活有关。在活体中描述这种关联对于确认APOEε4对小胶质细胞稳态的不依赖a β的有害影响以及支持治疗策略的发展至关重要。
这项研究测试了APOEε4状态和小胶质细胞激活在衰老和AD谱系中的活个体之间的关系。研究结果支持了APOEε4基因型通过激活与早期tau沉积相关的大脑区域的小胶质细胞,在AD发病中发挥独立于Aβ的作用。
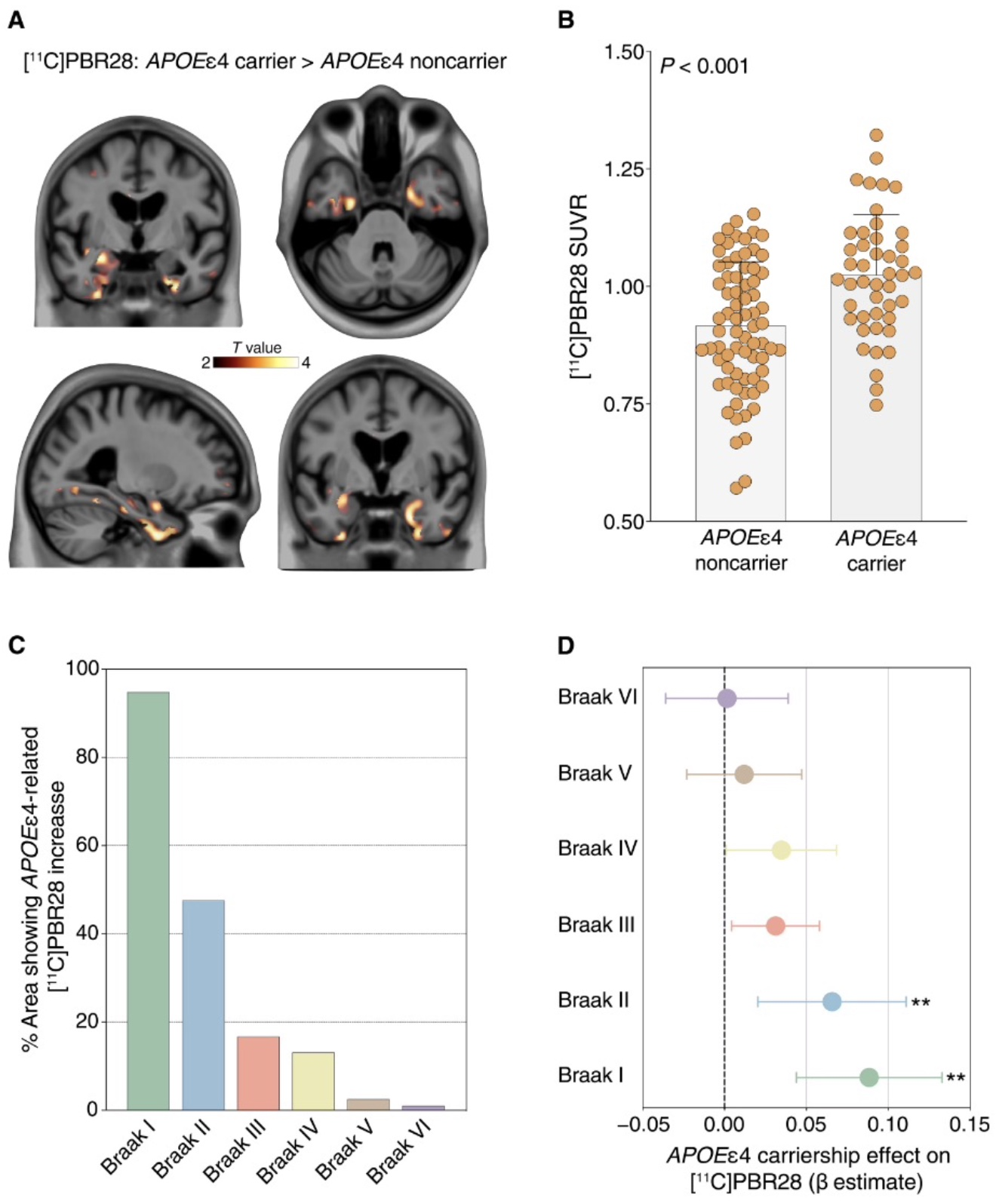
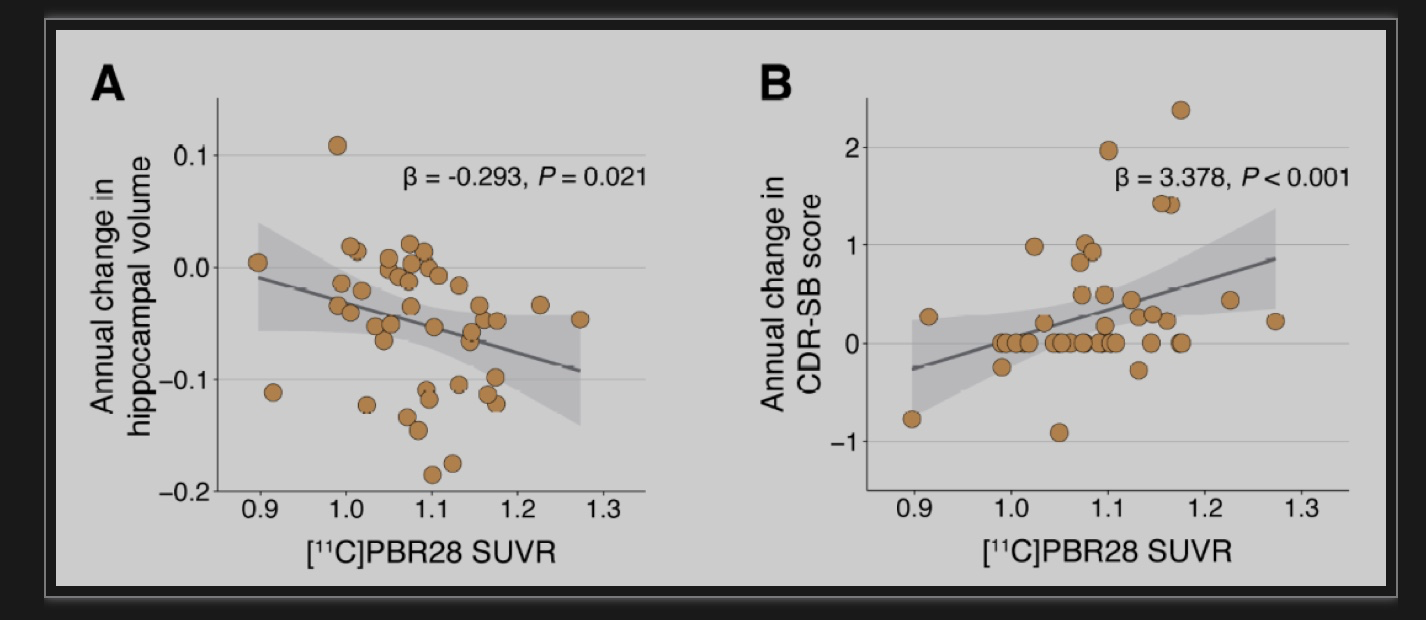
该研究筛选了606例参与者并检测了易位蛋白(TSPO)基因rs6971多态性。在314个高亲和力结合剂中研究了118个处于衰老和AD谱系的个体(79个认知未受损(CU),23个轻度认知障碍(MCI)、16个AD痴呆),并进行了[18F]AZD4694 Aβ PET、[18F]MK6240 tau PET、[11C]PBR28微神经胶质激活PET、磁共振成像(MRI)以及APOE基因分型。调整了年龄、性别和临床诊断的线性回归分析结果显示,APOEε4携带者相对于非携带者有更高的[11C]PBR28摄取,主要在内侧颞叶结构,这些区域对应于早期Braak期(图1A和B)。APOEε4等位基因与[11C]PBR28的相关性从Braak I到VI逐渐减弱(图1 c, d)。在具有可用临床随访数据(基线后≥1年)的42例个体中,研究人员测试了小胶质细胞激活与纵向神经退行性变和临床衰退的相关性。结果显示,APOEε4对小胶质细胞激活的影响易受影响的大脑区域中[11C]PBR28 SUVR较高,与海马纵向萎缩率较高和临床衰退(图2)相关。
图 1 APOEε4与早期Braak区小胶质细胞活化有关。
(图源:Ferrari-Souza JP, et al., Sci Adv, 2023)
图2 易受APOEε4影响的大脑区域的小胶质细胞激活与海马纵向萎缩和临床衰退相关。
(图源:Ferrari-Souza JP,et al., Sci Adv, 2023)
APOEε4基因型与AD标志蛋白病的[11C]PBR28摄取之间的线性回归分析显示,在Braak I-II区域,APOEε4等位基因的存在与较高的[11C]PBR28摄取之间存在统计学意义上的相关性。Braak I-II [11C]PBR28 SUVR与局部tau PET SUVR显著相关,而不是全局Aβ PET SUVR。在51名参与者的亚组中(31名CU、12名MCI和8名AD痴呆),对脑脊液(CSF)Aβ1-42和tau在苏氨酸181(p-tau181)磷酸化进行了敏感性分析。同样发现APOEε4等位基因的存在与Braak I-II区较高的[11C]PBR28 SUVR显著相关。在六个Braak区域进行的探索性分析支持APOEε4与[11C]PBR28摄取的研究关联主要局限于早期Braak区域,通过成像或流体生物标志物评估AD标志蛋白。
二、APOE基因表达类似于APOEε4相关的微胶质激活模式
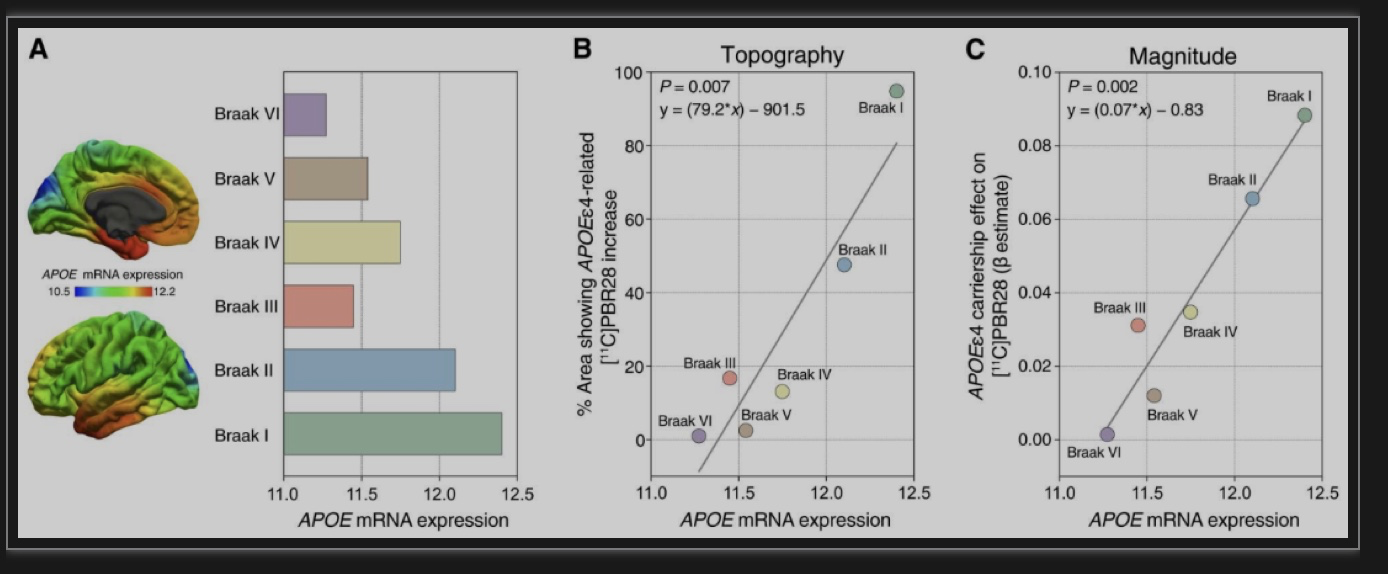
研究者分析了来自Allen人脑图谱的6个CU个体死后大脑中APOE mRNA的分布,在Braak区域观察到了不同的APOE基因表达水平,从Braak I到VI,APOE基因表达水平逐渐降低(图3A),这表明大脑APOE基因表达水平部分遵循Braak样阶段。此外,线性回归表明,在Braak区域Allen APOE mRNA表达的区域模式预测了该研究在人群中观察到的APOEε4对[11C]PBR28吸收影响的大小(图3B和C)。
图3 习得的气味表征对消失很敏感,但可以迅速恢复。
(图源:Ferrari-Souza JP, et al., Sci Adv, 2023)
三、小胶质细胞活化介导APOEε4对AD标记物的Aβ独立作用
该研究使用结构方程模型探究APOEε4、微胶质细胞激活、Aβ、tau、海马体积和临床功能之间的关系。在一个评估内侧颞叶结构中微胶质激活和tau蛋白病理的模型中,发现[11C]PBR28微胶质激活摄取的增加部分介导了APOEε4对Braak I-II区tau蛋白PET摄取升高的影响,而不依赖于Aβ PET。该模型还显示了一个单独的途径,其中APOEε4对高tau PET摄取的影响部分是通过高Aβ PET负荷而独立于小胶质细胞激活发生的。值得注意的是,导致内侧颞tau病变的Aβ不依赖通路和Aβ依赖通路都与海马体积降低相关,并最终导致更高的临床损伤严重程度(图4)。
图 4. APOEε4通过激活小胶质细胞独立于Aβ参与阿尔茨海默病(AD)的进展。。
(图源:Ferrari-Souza JP, et al., Sci Adv, 2023)
这项研究观察到APOEε4等位基因的存在与早期Braak期区域的小胶质细胞激活有关,这种关系在考虑了AD标志蛋白病变后仍然存在。还发现APOE基因表达的脑分布预测了在该研究的研究人群中观察到的APOEε4相关微胶质激活模式。最后,证明了小胶质细胞激活通过Aβ独立通路部分介导了APOEε4对区域tau积累的影响,这进一步与神经退行性变和临床损伤相关。针对ApoE和小胶质细胞激活之间相互作用的疾病修饰疗法有可能减缓AD的下游进展。在AD模型中,微神经胶质激活先于并驱动tau蛋白以braak样模式从内侧颞叶扩散到新皮层[11],尽管在内侧颞结构中触发微神经胶质激活的相关机制尚不完全清楚。总之,这项研究结果支持了APOEε4通过增加神经炎症参与AD早期进展的假设。